להמחיש Lignification Dynamics בצמחים עם לחץ על כימיה: תיוג כפולה היא האושר!
Summary
בליס, פרוטוקול תיוג כפול ללמוד דינמיקה lignification, פותחה. שימוש monolignol סינתטי כתבים ושילוב רציפים של bioorthogonal SPAAC, CuAAC לחץ תגובות, מתודולוגיה זו סוללת את הדרך כדי ניתוח מעמיק של הגורמים המסדירים את להן של lignins ב הפיסקו.
Abstract
ליגנין הוא לאחד biopolymers הנפוץ ביותר על פני כדור הארץ, מרכיב עיקרי של ביומסה lignocellulosic. זה פולימר בעל תאים פנוליים ממלא תפקיד חיוני הגנה מבניים בתחום הפיתוח החיים של צמחים. למרות מורכבות מנגנוני ויסות lignification תהליכים ויוו חריפה להשפעה של valorization תעשייתי של מוצרים רבים הצמחי, הקהילה המדעית יש עדיין דרך ארוכה ללכת בשביל לפענח אותם. ב- 3 שלבים פשוטים זרימת עבודה, פרוטוקול תיוג כפול שהוצגו במסמך זה מאפשר bioimaging מחקרים של פעיל lignifying אזורי של רקמות הצמח. הצעד הראשון מורכב ב שיתוף מטבולית של שני עיתונאים כימי עצמאית, המחליפים של שני monolignols מקורי כי להצמיח ליגנין H-G-יחידות. לאחר שהשתלבה גדל ליגנין פולימרים, כל כתב אז במיוחד תווית משלו בדיקה פלורסנט באמצעות שילוב רציפים של bioorthogonal SPAAC/CuAAC לחץ על תגובות. בשילוב עם autofluorescence ליגנין, גישה זו מובילה הדור של מפות תלת-צבעי לוקליזציה של ליגנין בתוך קירות התא הצמח על ידי מיקרוסקופ קונפוקלי פלורסצנטיות, מספק מידע מדויק המרחבי על נוכחות או היעדרות של פעיל מכונות lignification-קנה המידה של צמח רקמות, תאים ושכבות שונות דופן התא.
Introduction
בשני העשורים האחרונים, האסטרטגיה כתב כימי התפתחה מתודולוגיה שני שלבים חזק כדי לחקור את הדינמיקה ואת הפונקציות של מולקולות שאינן גנטית מקודד. 1 , 2 , 3 באסטרטגיה אנלוגי סינתטי של biomolecule עניין עם אפנון קטן – כתב כימי – עובר תחילה מטבוליזם האורגניזם החי, ולאחר מכן בדיקה כימית (למשל., fluorophore על ידי קרינה פלואורסצנטית מיקרוסקופיה קונפוקלית הדמיה) קשורה covalently הכתב incorporated ויה bioorthogonal לחץ על כימיה. המכשיר חייב להגיב במהירות, במיוחד עם השינוי כימי הציג בעת היותו אינרטי כדי כל מולקולות נוכח במערכת החיים. במובנים רבים, שיטה זו גוברת על המגבלות של טכניקות נפוצות bioconjugation באמצעות לחץ ספציפי מאוד כימיה ligations ובכך מספק הזדמנות לעקוב מטבוליטים או ובמקרו-מולקולות ביולוגיות כי היו נגישים בעבר חי מערכות4,5,6.
למרות הפופולריות בצמיחה מהירה של שיטה זו עוצמה של תאים חיידקיים ובעלי חיים, דוחות המתאר את השימוש בביולוגית הצמח הם כמה מפתיע, המרחק בין7,8,9,10, 11,12. היינו מעוניינים במיוחד ליישם אסטרטגיה זו בצמחים ללמוד היווצרות של ליגנין, לאחד biopolymers הנפוץ ביותר על פני כדור הארץ, מרכיב עיקרי של ביומסה lignocellulosic. 13 , 14 ליגנין הוא פולימר בעל תאים פנוליים זה ממלא תפקיד חיוני הגנה מבניים בתחום הפיתוח החיים של צמחים.
הוא בדרך כלל מורכב moieties 4-hydroxyphenylpropanoid שלושה: H (p– hydroxyphenyl), G (guaiacyl) ויחידות S (syringyl) נגזר בהתאמה בין 3 ‘monolignols’ (p– coumaryl, coniferyl ו- sinapyl כהלים) כי הם מסונתז דרך השביל phenylpropanoid בציטופלסמה של התא (איור 1). לאחר להיות מיוצא דופן התא, monolignols הם מחומצן לקיצוניים peroxidases או laccases לאחר מכן הם עוברים צימוד הרדיקלי גרידא כימי תגובות פולימריזציה כדי ליגנין פולימרים, תהליך הנקרא lignification. 15 , 16 למרות lignins חריפה להשפיע על valorization תעשייתי של רבים הצמחי מוצרים, הקהילה המדעית יש עדיין דרך ארוכה ללכת כדי לפענח את המנגנון הסבוך ויסות lignification לו.
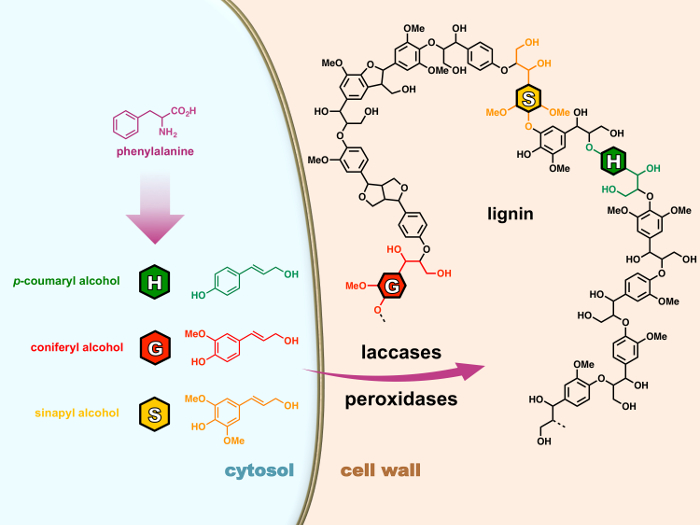
איור 1: תהליך lignification בתאי צמח. Monolignols הם biosynthesized של פנילאלנין ב ציטוזול. לאחר להיות מיוצא דופן התא, monolignols הם מחומצן לקיצוניים peroxidases או laccases לאחר מכן הם עוברים צימוד הרדיקלי גרידא כימי תגובות פולימריזציה כדי ליגנין פולימרים, תהליך הנקרא lignification. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
למרות דיווחים על השימוש bioorthogonal תגובות לניתוח glycan רבים,2,3,17 שלהם יישום דוגמאות לסוגים אחרים של מולקולות הן פחות. השימוש bioorthogonal כימיה למטרות bioimaging ליגנין רק לאחרונה היה חלוץ ידי. Tobimatsu et al. 8 ב תודרנית לבנה כדי לספק מידע אודות שילוב של coniferyl המחליפים אלכוהול לתוך הפולימר ליגנין איפה זה יוצר את יחידות G,8,9 ובכך הממחיש את הוכחת את זה כתב כימי אסטרטגיות ישימות בהקשר זה. השימוש CuAAC היה ללמוד גם באמצעות נגזרת אלכוהול שונים coniferyl חודש כמה מאוחר יותר בוקובסקי ואח. 9 . אולם, ליגנין מכיל גם יחידות H ו- S הבנה עמוקה יותר של תהליך lignification דורש יותר ידע איך כל monolignols משולבים הפולימר, מה הגורמים עשויות לשלוט הקומפוזיציה שלה. הפיתוחים החדשים בתחום זה כיום תלויים פיתוח מתודולוגיות יעיל כדי לעקוב אחר כתבים כימיות מרובות בו-זמנית במערכות החיים. אף-על-פי כמה כתבות על glycans הניחו את היסודות בשנים האחרונות18,19,20,21,22, כפול תיוג גישות נשארים אתגר גדול ב bioorthogonal כימיה. אם פרוטוקול לחץ לשחזור תיוג-יחיד הוא קשה לפתח, ואז כפול תיוג גישות הדורשים אופטימיזציה במשולב שני הדדית תואמת bioorthogonal תגובות על שני הכתבים כימיים נפרדים הם אפילו יותר קשה. כמה דוגמאות כי חלוץ היבט זה השתמשו בשילוב של אזיד-אלקין אתקרב זן cycloaddition (SPAAC) ותגובות תגובת דילס-אלדר (DAinv) דרישה אלקטרונית הופכי אלקן-tetrazine ללמוד glycans בתאים בעלי חיים. עם זאת, חשבנו כי bioorthogonality התגובה DAinv לא יכול להיות מובטח ביישום זה בשל המאפיינים המבניים של ליגנין (אשר מורכב של מונומרים אלקטרון-עשיר cinnamyl שהוחלפו מסוג זה יכול להגיב עם אלקטרון עלוב האוויר דינס כגון הגששים tetrazine המשמש בתגובות DAinv), כי זה עלול לייצר שאינם ספציפיים תיוג. בנוסף, התגובהinv DA דורש ידיות כימיים קשים לאכסון גישה, כמו גם להיות מגושם ולא lipophilic ובכך מעלים את האפשרות כי הקצב של התאגדות, תחבורה ו/או לוקליזציה של החומר הכימי כתב ויוו עלולים להיות מושפעים. כפי שקלנו כי ההיבט האחרון היה רלוונטי במיוחד במקרה של גישה כימיה בלחיצה ללמוד lignification, אנחנו בחרה בכיוון שונה ופיתח באמצעות Bioorthogonal מצדו הדמיה רציפים אסטרטגיה (אושר) שילוב של Cycloaddition אזיד-אלקין Strain-Promoted (SPAAC) ו- Cycloaddition אזיד-אלקין קטליזת של נחושת (CuAAC) ויוו. 23
תגובות שני אלו הם אכן שני bioorthogonal הראשי לחץ על תגובות בהן השתמשו עד כה, יותר בפרט כמה דוגמאות של ליגנין הדמיה אשר פורסמו לאחרונה. 8 , 9 אסטרטגיית תיוג כפול שלנו מאפשרת את השימוש של אזיד moiety על monolignol אחד כתב וידיות של אלקין מסוף מצד שני, שני הכימי i) אינרטיים לכיוון מבנים רלוונטי מבחינה ביולוגית, ii) מאוד קטנים בגודלם (איור 2 ). כתוצאה, ההשפעה של אלה שינויים סינתטי על המאפיינים physicochemical של biomolecule שנבחנה ממוזער ובכך להקטין אפשרי אי-התאמות בין סובסטרטים לא טבעיים, הטבעית monolignol מבחינת תחבורה, metabolization המחירים במהלך השלב התאגדות מטבולית. למרות השילוב של SPAAC ו- CuAAC נראה מאוד אינטואיטיבי במבט ראשון, זה לידע שלנו רק הדוגמה השניה של סימון כפול באמצעות אסטרטגיה זו לבין היישום הראשון על מבנים שאינם glycans. 12 , 23
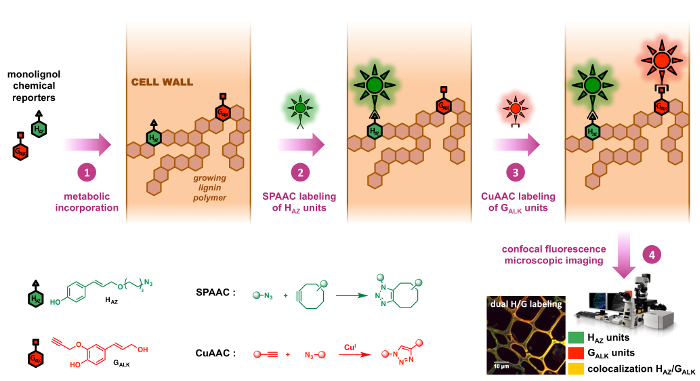
איור 2: אושר כפול תיוג אסטרטגיה. כתבים כימי HAZ GALK מתויג אנלוגים של monolignols מקורית H ו- G בקרב אנשי עסקים ותיירים כאחד. הם משולבים קודם פולימרים ליגנין הגוברת של קירות התא על ידי האכלת אקסוגני (שלב 1). Cyclooctyne – ו אזיד-functionalized הגששים פלורסנט ואז ברצף מאתרים בפני הכתבים incorporated מאת bioorthogonal לחץ על כימיה: התגובה SPAAC (שלב 2) הוא מאוד ספציפי של יחידות HAZ , ואחריו (התגובה CuAAC שלב 3) זה מפורט של GALK יחידות (שלב 3), ובכך לאפשר לוקליזציה ספציפי של שני עיתונאים באופן עצמאי במדגם זהה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
אנו ראשית המיועד לאמת את monolignol מתויג אזיד כתב HAZ (ממלא מקום של p– coumaryl אלכוהול), קודמן של יחידות ליגנין H ו ואז המציאו את אושר כפול תיוג האסטרטגיה שבה הוא משמש במשולב עם קודם לכן דווח מתויג אלקין GALK,9 (ממלא מקום של אלכוהול coniferyl), קודמן של ליגנין G יחידות. ב פרוטוקול לשחזור זה פיתח ובחן, פשתן, זן צמח חשוב מבחינה כלכלית, שילוב מטבולית כפול של HAZ ו- GALK לתוך ליגנין מושגת קודם לפני רציפים SPAAC/CuAAC תיוג. כאן, מתויג HAZ יחידות תחילה במפורש מסומנות באמצעות מצדו SPAAC של fluorophore cyclooctyne-functionalized, ואחריו בתיווך CuAAC מצדו של בדיקה פלורסנט השני במתויג GALK יחידות. שיטה זו שימש לחקור את הדינמיקה של תהליכים lignification בתוך קירות התא צמח וניתן יישומית ויוו לבלום חתכים, חיים נובע, כמו גם אחרים-שתילים, מינים שונים.
Protocol
Representative Results
Discussion
כאמור, הפרוטוקול אושר כפול תיוג שהוצגו במאמר זה היא אחת הדוגמאות הראשונות SPAAC/CuAAC שילוב ויוו12,23. כל שלב היה ביסודיות ממוטב לאמת ואני זה מאוד חשוב כי הסדר שבו השניים לחץ על כימיה תיוג תגובות ברצף מבוצעות מכובד (קרי, SPAAC, ואחריו CuAAC). הצלב כל-הפקדים הראה כי כל שלב תיוג היא ספציפית כאשר הפרוטוקול אושר יישומית23 : ביצוע השלב SPAAC הראשון מוביל chemoselective מאוד תיוג של HAZ אזיד פונקציות על-ידי cyclooctyne functionalized fluorophore דרך תגובה [3 + 2] cycloaddition עם קינטיקה מהר. ברגע יחידות HAZ מתויגים, השלב CuAAC המחייב הפעלה copper(I) מזורז של GALK alkynes מסוף כדי ליצור קישורים triazole על ידי תגובה עם החללית 545 אזיד-עבור חיל הים יכול להתבצע. לעומת זאת, הסדר ההפוך (קרי, CuAAC, ואחריו SPAAC) לא אמור לשמש כמו זה מוביל ליחידה GALK ו- HAZ קרוס-מצמד, אשר מתחרה עם fluorophore מצדו ומשרה ההפסד הדרמטי של האות . חשוב גם להדגיש את נחיצות השלבים כביסה ביניים כדי למנוע כתמים שאינם ספציפיים.
אנחנו הראו כי השיטה שלנו ניתן להחיל עיצובים ניסוי ביולוגיים שונים. האושר תיוג פרוטוקול הוחל לראשונה על חתכים ביד חופשית של גבעולים זרעי פשתן (כ 150-250 מיקרומטר עבה) היו בעבר לחתוך, מודגרות עם monolignols מוכן-לחץ. למרות העיצוב הזה יש את היתרון של צמצום הכמויות הדרושות של הכתב כימי (כפי הדגירה כרכים מופחתים) ושל הקלת ייצור ושכפול סטטיסטית, זה לא, אם אתה קפדן, מערכת ויוו מסוימים המקרים, אינן משקפות בהכרח בכל ההיבטים של דינמיקה lignification אמיתי-עתיים. בתכנון הניסוי השני, לכן התאמנו הפרוטוקול אושר שיטה שבה השתמשת קודם לכן כדי ללמוד שילוב של monolignols radiolabeled אורן, גינקו27. בגישה זו, השורשים ואת גזע של הצמח מופרדים פיזית, הבסיס של כל גזע מודגרת בפתרון monolignol ב מה עשוי להיות שכונה הגישה “אגרטל פרחים”. לאחר שעזב את הגבעולים זמן הרצוי (הדגירה), חתכים הם גזור את הפרוטוקול אושר לבצע. זו אפשרה לנו להראות (i) כי monolignols ששונה מועברים דרך הגבעול חי, משולבים גדל ליגנין פולימרים בתוך קירות התא ואת (ii) כי התבנית לוקליזציה היה בעיקרו של דבר זהה לזו של חתך הרוחב הגישה. זה סוג של ניסוי יש בצורך מבוצע ב צמח חי ואמיתי / תא חי לגשת ומאפשר יותר ניסויים ומחקרים מעמיקים יותר, אך דורשת כמויות יותר כתב כימי. לבסוף, הפרוטוקול אושר שימש גם עם שתילים מפעל פשתן, ייצוג אמיתי חי צמח מודל שבו העיתונאים כימי כנראה נספג דרך השורשים לפני מובלים את הגבעול. בעוד מודל זה יש יתרון ברור של מבוצע ב צמחים חיים, בפועל, זה מוגבל השתילים והוא לא מתאים באמת חוקרים lignification dynamics צמחים בוגרים מסיבות מעשיות (זמן דגירה ארוך, מוגבה כמות של עיתונאים כימי). ובכל זאת, עיצובים ניסוי שלושת אלה הם משלימים, ובכולם יש היתרונות והחסרונות שלהם לגבי ההיבטים המעשיים ומשמעויות ביולוגי בהתאם לסוג השאלה ביולוגי שנענתה.
שפותחה כדי ללמוד את הדינמיקה lignification של פשתן, פרוטוקול שלנו היא מאוד, לא רק מבחינת עיצוב הניסוי הביולוגי, אלא גם מבחינת היישום שלה לשני צמח מינים ורקמות/איברים. למשל, האושר ניתן בקלות להעביר את תודרנית או סוגים של צפצפה נתונות יותר מחקרים עם מוטציות מעלף או דפיקה למטה עבור גנים שונים. בעקרון, מחקרים תיוג כפול עם הגישה שלנו גם ניתן להרחיב את מולקולות אחרות באמצעות שני מבשרי ששונה ברורים של הצמח דופן התא פולימרים – כולל כל שלוש monolignols הראשי או סימנים מקדימים חילוף החומרים שלהם גם כן שונים כמו monosaccharides המהווים המטריקס רב-סוכר. מאז הקמתה, כימיה bioorthogonal אכן בעיקר פותחה כדי לחקור glycans/פוליסכרידים-פחמימה # מיון הפחמימות מטבולית הנדסה (מו)4,5,17,28, אבל באופן מפתיע היו רק מעט מאוד יישומי לשתול ביולוגיה כה7,8,9,10,11,12. מבחינת תאימות של התגובות, המחקר של ליגנין אכן היה תיק מורכב לפתור כמו שני כתבים כימי משולבים באותה רשת לסופרמרקטים הפולימר. האפשרות של Hללא תוויתAZ–GALK קישור היווצרות היה ההיבט להתגבר בשל הקרבה המרחבי של GALK ויחידותAZ Hבתוך 3D מבנה של ליגנין23, מגבלה זה עשויים שלא להופיע אם הכתבים כימי שני אינם כלולים באותו סוג של ביופולימרים או באותו אזור המרחבי של תא נתון כלשהו.
בהיקף רחב יותר המתודולוגיה בליס יכול בעצם להיות מיושם בכל מחקר הדמיה של שני צבעים פלורסצנטיות במודלים חיידקי או בעלי חיים באמצעות שני הכתבים כימיים ברורים הנושאת אזיד תג ותג מסוף אלקין, בהתאמה.
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
אנחנו חבים את FRABio הפדרציה מחקר ולמערכת הדמיה TisBio (אונ’ Lille, CNRS, FR 3688, FRABio, BiochimieStructurale et במכלולים des Fonctionnelle Biomoléculaires) למתן הסביבה טכני להצטיינות להשיג את זה עבודה.
Materials
| (E)-4-(3-(2-(2-(2-azidoethoxy)ethoxy)ethoxy)prop-1-en-1-yl)phenol (HAZ) | Synthesized as in Lion et al. Cell Chem. Biol. 2017, 24, 3, 326-338 | ||
| (E)-4-hydroxy-3-propargyloxycinnamyl alcohol (GALK) | Synthesized as in Lion et al. Cell Chem. Biol. 2017, 24, 3, 326-338 | ||
| 2% sodium hypochlorite | |||
| 20 cm high glass tube | |||
| 250 mL Schott glass bottle | |||
| 48-well Plate | |||
| 5/6-TAMRA-PEG3-Azide | Jena Bioscience | CLK-AZ109-1 | |
| Aluminium foil | |||
| Cheese cloth | |||
| Compost containing clay | |||
| Coniferyl alcohol (G) | Sigma Aldrich | MFCD00002922 | |
| Copper (II) sulfate pentahydrate | |||
| DBCO-PEG4-5/6-Carboxyrhodamine 110 | Jena Bioscience | CLK-A127-1 | |
| Milli-Q Ultrapure water | |||
| Eppendorf 1,5 mL | |||
| EtOH | |||
| Flax seeds (L. usitatissimum L.) | |||
| Fluoromount-G™ Slide Mounting Medium | Electron Microscopy Sciences | 17984-25 | |
| Glass coverslip | |||
| Glass microscope slide | |||
| Growth chamber | CLF-Plant Climatics | For 2-week-old plants culture | |
| Growth chamber | Angelantoni Life Sciences | For 2-month-old plants culture | |
| Magenta plant culture box | For 2-week-old seedling culture | ||
| Methanol | Toxic (SGH02, SGH06, SGH08), work with gloves under a hood | ||
| Micropipette | |||
| Nail polish | |||
| Nikon A1R confocal microscope | Nikon | ||
| Orbital shaker | |||
| Parafilm | |||
| p-Coumaryl alcohol (H) | Carbosynth | FC145653 | |
| Plastic cap | |||
| Plastic pipette | |||
| Plastic pot | For 2-month-old plants culture | ||
| Razor blade | |||
| Rubber band | |||
| Sodium Ascorbate | |||
| Sterile clamp | |||
| Vertical support | |||
| Vortex | |||
| Reagents for liquid and solid ½ MS medium | |||
| KH2PO4 | |||
| KNO3 | |||
| NH4NO3 | |||
| MgSO4.7H2O | |||
| CaCl2.2H2O | |||
| MnSO4.H2O | |||
| ZnSO4.7H2O | |||
| H3BO3 | |||
| KI | |||
| Na2MoO4.2H2O | |||
| CuSO4.5H2O | |||
| CoCl2.6H2O | |||
| Na2EDTA.2H2O | |||
| FeSO4.7H2O | |||
| Thiamine.HCl | |||
| Pyridoxine.HCl | |||
| Glycine | |||
| Nicotinic acid | |||
| Myo-inositol | |||
| Saccharose | |||
| MES hydrate | |||
| Agar |
Riferimenti
- Grammel, M., Hang, H. C. Chemical reporters for biological discovery. Nat Chem Biol. 9 (8), 475-484 (2013).
- Prescher, J. A., Bertozzi, C. R. Chemistry in living systems. Nat Chem Biol. 1 (1), 13-21 (2005).
- Sletten, E. M., Bertozzi, C. R. Bioorthogonal chemistry: fishing for selectivity in a sea of functionality. Ange Chemie (Int Ed. Engl). 48 (38), 6974-6998 (2009).
- Chang, P. V., et al. Metabolic labeling of sialic acids in living animals with alkynyl sugars. Ange Chemie (Int Ed. Engl). 48 (22), 4030-4033 (2009).
- Gilormini, P. A., et al. A sequential bioorthogonal dual strategy: ManNAl and SiaNAl as distinct tools to unravel sialic acid metabolic pathways. Chem. Commun. 52 (11), 2318-2321 (2016).
- Mbua, N. E., et al. Abnormal accumulation and recycling of glycoproteins visualized in Niemann-Pick type C cells using the chemical reporter strategy. Proc Natl Acad Sci U S A. 110 (25), 10207-10212 (2013).
- Anderson, C. T., Wallace, I. S., Somerville, C. R. Metabolic click-labeling with a fucose analog reveals pectin delivery, architecture, and dynamics in Arabidopsis cell walls. Proc Natl Acad Sci U S A. 109 (4), 1329-1334 (2012).
- Tobimatsu, Y., et al. A click chemistry strategy for visualization of plant cell wall lignification. Chem. Commun. 50 (82), 12262-12265 (2014).
- Bukowski, N., et al. Development of a clickable designer monolignol for interrogation of lignification in plant cell walls. Bioconjugate Chem. 25 (12), 2189-2196 (2014).
- Pandey, J. L., et al. A versatile click-compatible monolignol probe to study lignin deposition in plant cell walls. PLOS ONE. 10 (4), e0121334 (2015).
- Pandey, J. L., et al. Investigating biochemical and developmental dependencies of lignification with a click-compatible monolignol analog in Arabidopsis thaliana stems. Front Plant Sci. 7, (2016).
- Zhu, Y., Wu, J., Chen, X. Metabolic labeling and imaging of N-linked glycans in Arabidopsis thaliana. Ange Chemie (Int Ed. Engl). 55 (32), 9301-9305 (2016).
- Boerjan, W., Ralph, J., Baucher, M. Lignin biosynthesis. Annu Rev Plant Biol. 54, 519-546 (2003).
- Weng, J. -. K., Chapple, C. The origin and evolution of lignin biosynthesis. New Phytol. 187 (2), 273-285 (2010).
- Mottiar, Y., Vanholme, R., Boerjan, W., Ralph, J., Mansfield, S. D. Designer lignins: harnessing the plasticity of lignification. Curr Opin Biotechnol. 37, 190-200 (2016).
- Rinaldi, R., et al. Paving the way for lignin valorisation: recent advances in bioengineering, biorefining and catalysis. Ange Chemie (Int Ed). 55 (29), 8164-8215 (2016).
- Wratil, P. R., Horstkorte, R., Reutter, W. Metabolic glycoengineering with N-acyl side chain modified mannosamines. Ange Chemie (Int Ed. Engl). 55 (33), 9482-9512 (2016).
- Feng, L., et al. Bifunctional unnatural sialic acids for dual metabolic labeling of cell-surface sialylated glycans. J Am Chem Soc. 135 (25), 9244-9247 (2013).
- Dumont, M., et al. Plant cell wall imaging by metabolic click-mediated labelling of rhamnogalacturonan II using azido 3-deoxy- d – manno -oct-2-ulosonic acid. Plant J. 85 (3), 437-447 (2016).
- Niederwieser, A., et al. Two-color glycan labeling of live cells by a combination of Diels-Alder and click chemistry. Ange Chemie Int Ed. 52 (15), 4265-4268 (2013).
- Späte, A. -. K., et al. Exploring the potential of norbornene-modified mannosamine derivatives for metabolic glycoengineering. Chem Bio Chem. 17 (14), 1374-1383 (2016).
- Späte, A. -. K., et al. Rapid Labeling of metabolically engineered cell-surface glycoconjugates with a carbamate-linked cyclopropene reporter. Bioconjugate Chem. 25 (1), 147-154 (2014).
- Lion, C., et al. BLISS: a bioorthogonal dual-labeling strategy to unravel lignification dynamics in plants. Cell Chem Biol. 24 (3), 326-338 (2017).
- del Río, J. C., et al. Structural characterization of guaiacyl-rich lignins in flax (Linum usitatissimum) fibers and shives. J Agric Food Chemist. 59 (20), 11088-11099 (2011).
- Huis, R., et al. Natural hypolignification is associated with extensive oligolignol accumulation in flax stems. Plant Physiol. 158 (4), 1893-1915 (2012).
- Chantreau, M., et al. Ectopic lignification in the flax lignified bast fiber1 mutant stem is associated with tissue-specific modifications in gene expression and cell wall composition. The Plant Cell. 26 (11), 4462-4482 (2014).
- Terashima, N., Ko, C., Matsushita, Y., Westermark, U. Monolignol glucosides as intermediate compounds in lignin biosynthesis. Revisiting the cell wall lignification and new 13C-tracer experiments with Ginkgo biloba and Magnolia liliiflora. Holzforschung. 70 (9), 801-810 (2016).
- Noel, M., et al. Probing the CMP-sialic acid donor specificity of two human β-d-galactoside sialyltransferases (ST3Gal I and ST6Gal I) selectively acting on O- and N-glycosylproteins. Chembiochem: Eur J Chem Biol. , (2017).

