Brug af GAL4-UAS System for Funktionel Genetik i Anopheles gambiae
Summary
Det tværpolitiske GAL4-UAS-system er et alsidigt værktøj til modifikation af genekspression på en kontrolleret spatiotemporal måde, som muliggør funktionel genetisk analyse i Anopheles gambiae. De procedurer, der er beskrevet for brug af dette system, er en semi-standardiseret kloningsstrategi, sexing og screening af pupper til fluorescerende proteinmarkører og embryofiksering.
Abstract
Det tværpolitiske GAL4-UAS-system er et alsidigt og kraftfuldt værktøj til funktionel genetisk analyse. Essensen af systemet er at krydse transgene ‘driver’ linjer, der udtrykker gær transskription faktor GAL4 på en vævsspecifik måde, med transgene ‘responder’ linjer bærer en kandidat gen / RNA interferens konstruktion, hvis udtryk er kontrolleret af Upstream Aktivering Sekvenser (UAS), der binder GAL4. I det efterfølgende afkom udtrykkes gen- eller lyddæmpningskonstruktionen således på en foreskrevet spatiotemporal måde, hvilket gør det muligt at analysere de resulterende fænotyper og udlede genfunktion. Det binære system muliggør fleksibilitet i eksperimentelle tilgange til at screene fænotyper genereret af transgene udtryk i flere vævsspecifikke mønstre, selv om alvorlige fitness omkostninger er induceret. Vi har tilpasset dette system til Anopheles gambiae, den vigtigste malaria vektor i Afrika.
I denne artikel leverer vi nogle af de fælles procedurer, der anvendes under GAL4-UAS-analyse. Vi beskriver an. gambiae GAL4-UAS linjer, der allerede er genereret, samt kloning af nye responder konstruktioner til upregulation og RNAi knockdown. Vi specificerer en trinvis vejledning til sexing af myg pupper til at etablere genetiske kors, der også omfatter screening afkom til at følge arv af fluorescerende genmarkører, der mærker føreren og responder indsættelser. Vi præsenterer også en protokol for rydning af an gambiae embryoner for at studere embryonal udvikling. Endelig introducerer vi potentielle tilpasninger af metoden til at generere driverlinjer gennem CRISPR/Cas9-indsættelse af GAL4 nedstrøms af målgener.
Introduction
Det tværpolitiske GAL4-UAS-system er arbejdshesten for funktionel karakterisering af gener i insektmodelorganismen Drosophila melanogaster1,2,3. For at bruge GAL4-UAS-systemet krydses transgene førerlinjer, der udtrykker gærtransskriptionsfaktoren GAL4 under kontrol af en lovgivningsmæssig sekvens, med responderlinjer, der bærer et interessegen eller RNA-interferens (RNAi) konstruktion kontrolleret af en Upstream Activation Sequence (UAS), der er anerkendt af GAL4. Afkommet af dette kors udtrykker transgene af interesse i en spatiotemporal mønster dikteret af promotor kontrollerende GAL4 udtryk (figur 1). Fænotyper, der vises af afkom af driver-responder kors kan vurderes at belyse funktionen af kandidat gener. Selvom D. melanogaster er blevet brugt til at undersøge gener fra andre organismer4,5,6,7, er GAL4-UAS-systemet nu blevet tilpasset til brug i insekter af medicinsk og landbrugsmæssig betydning for at give direkte analyse af interessearter 8,9,10,11,12,13,14.
I den afrikanske malaria myg, Anopheles gambiae, GAL4-UAS-systemet blev først testet af celle linje co-transfection9. Flere konstruktioner blev analyseret for effektivitet i forskellige parvis kombinationer og fandt, at 14 tandemly gentagne UAS suppleret med en lille kunstig intron (UAS-14i) viste det bredeste udvalg af aktiveringspotentiale, når de anvendes med et panel af GAL4 drivere. For at demonstrere in vivo-funktionalitet blev disse konstruktioner derefter brugt til at skabe to separate transgene An. gambiae linjer af PiggyBac transformation8: en førerlinje, der transporterer GAL4 drevet af en midgutspecifik promotor, og en responderlinje, der indeholder både luciferase og forbedrede gule fluorescerende protein (eYFP) gener under regulering af UAS-sekvenser. Tarmspecifik luciferaseaktivitet og fluorescens i afkommet indikerede, at systemet var effektivt i Anopheles. Siden da er der blevet oprettet driverlinjer, der udtrykker transgener i andet væv, der er vigtigt for vektorkapacitet og insekticidresistens, herunder oenocytter15 og hæmocytter16, og i et tæt på allestedsnærværende mønster10. Talrige UAS linjer er også blevet genereret til analyse gener menes at være involveret i stofskiftet og beslaglæggelse medieret insekticidresistens, cuticular kulbrinte syntese og fluorescerende tag forskellige celle-og vævstyper (tabel 1). For responder linjer, site-rettet integration af transgene er nu udført af ΦC31 katalyseret rekombination kassette udveksling17,18 at fastsætte den genomiske sammenhæng af UAS regulerede gener. På denne måde normaliseres transgene udtryk med hensyn til genomisk indsættelsessted, hvilket giver mulighed for en mere præcis sammenligning af de fænotypiske virkninger af forskellige kandidatgener.
De responder linjer skabt til dato er designet til enten at udtrykke transgene enten på forhøjede niveauer eller til at reducere genekspression gennem RNA interferens (RNAi). Normalt cDNA kloner er smeltet til UAS sekvens til at generere egnede udtryk plasmider, men fuld genomiske sekvenser er også muligt under forudsætning af, at de ikke er for store til kloning. For at generere lyddæmpningskonstruktioner har vi brugt tre forskellige metoder til at opnå egnede tandem omvendte sekvenser, der danner hårnål dsRNA, der stimulerer RNAi. Disse har inkluderet fusion PCR, asymmetrisk PCR og kommerciel syntese af hårnål konstruktioner. Fælles for hver metode er inkluderingen af en intronsekvens mellem de omvendte sekvenser for at give kloningsstabilitet. Responder plasmider, hvori et gen af interesse / RNAi konstruktion kan indsættes er blevet udviklet15. Disse plasmider bærer også de krævede ΦC31 attB-steder til RMCE (beskrevet i Adolfi, der ledsager JoVE-papir, der beskriver RCME-teknikken i detaljer). Protokoller, der dækker de vigtige trin, der kræves, når du vælger sekvensen til indsættelse i en af disse plasmider til overekspression, er inkluderet i dette manuskript. Derudover er to protokoller for RNAi hårnål konstruere skabelse beskrevet og illustreret.
Når du opretter nye linjer, er identifikation af sjældne transgene individer afgørende at opdrætte fra at etablere og opretholde transgene kolonier. Vigtigst for GAL4-UAS-systemet er det nødvendigt at skelne mellem responder- og førerlinjerne for at etablere kryds og identificere individuelle afkom, der bærer begge transgener. Dette opnås ved at bruge forskellige dominerende valgbare markørgener knyttet til driveren og responderkassetter. Oftest er disse fluorescerende markørgener, der klart kan skelnes ved hjælp af optiske filtre (f.eks. eYFP, eCFP, dsRed). Det er vigtigt, at markører udtrykkes i et kendt og pålideligt spatiotemporalt mønster, da dette gør identifikation af abnormiteter og forurening lettere. Fluorescerende markør genekspression er rutinemæssigt reguleret af den syntetiske 3xP3 promotor, som forårsager øje og ventrale ganglier specifikke udtryk i alle faser af An. gambiae udvikling19. Fluorescerende markører kontrolleret af 3xP3 er inkluderet i alle transformation plasmider beskrevet i denne artikel. En protokol, der beskriver de almindelige metoder, der anvendes til at screene fluorescerende An. gambiae pupae GAL4-UAS linjer er inkluderet her.
Et af nøgleelementerne i GAL4-UAS-systemet er nødvendigheden af at krydse de differentierede driver- og responderlinjer. For at gøre dette skal mandlige og kvindelige fra hver linje adskilles før parring. Voksne er let skelnes ved synet, men for at etablere genetiske kors er det fornuftigt at adskille kønnene før voksen fremkomst for at sikre, at parring ikke har fundet sted. Den generelle størrelse forskel mellem mandlige og kvindelige An. gambiae pupper er for variabel til at være en effektiv og pålidelig metode til kønsbestemmelse20. I stedet giver klare morfologiske forskelle i de ydre kønsorganer et pålideligt grundlag for sexing i An. gambiae. I denne artikel beskriver vi en pålidelig metode til sexing An. gambiae pupper til at oprette passende kors.
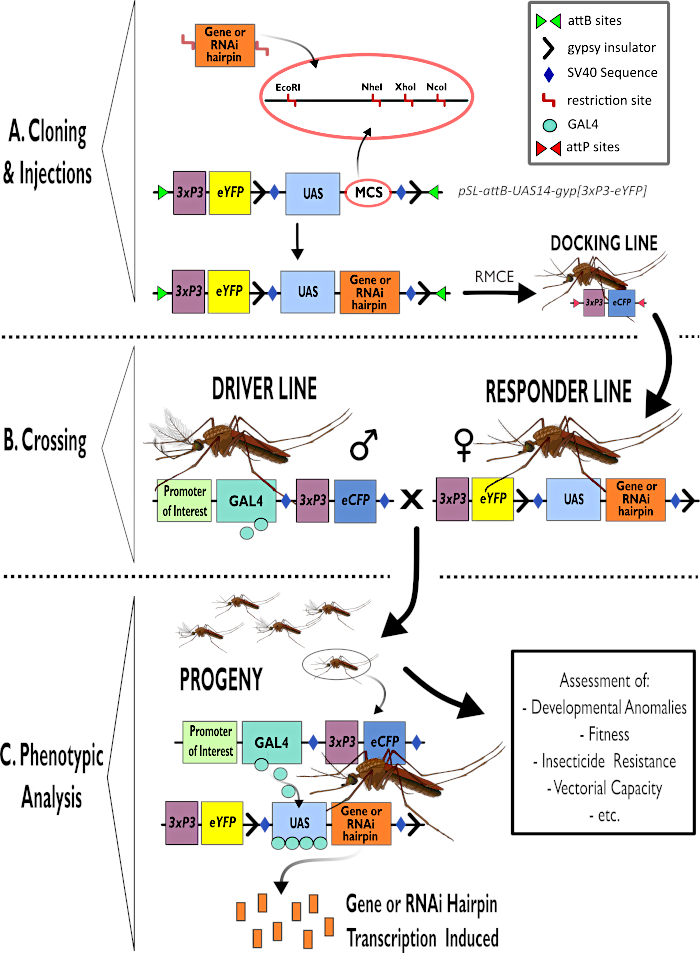
Figur 1 – Diagrammatisk repræsentation af processen for anvendelse af det todelte GAL4-UAS-system i Anopheles gambiae. (A) De vigtigste komponenter i en eksempelvektor (pSL-attB-UAS14-gyp[3xp3-eYFP]) er afbildet med detaljer om de tilgængelige begrænsningssteder (EcoRI, NheI, XhoI og NcoI) inden for de flere kloningssteder, der er egnede til brug til at indsætte hårnålkonstruktions- eller kodningssekvensen for interessegen. Dockinglinjens struktur er også afbildet. (B) Overgangstrinnet illustreres med angivelse af mænds brug fra førerlinjen (med GAL4-driver af en initiativtager af interesse og eCFP drevet af 3xP3-promotoren) og kvinder fra responderlinjen (med interessegen eller hårnålkonstruktionen kontrolleret af en UAS-promotor og en eYFP-markør, der kontrolleres af 3xP3-promotoren). (C) En diagrammatisk gengivelse af GAL4-kørselsekspression af det interessegen, der er af interesse for korsets afkom i B, og en liste over nogle af de typiske fænotyper, der vurderes. Forkortelser: Multiple Cloning Site (MCS), Recombinase medieret kassetteudveksling (RMCE), Upstream Activator Sequence (UAS), forbedret gult fluorescerende protein (eYFP), forbedret cyan fluorescerende protein (eCFP). Klik her for at se en større version af dette tal.
Det er brugen af kryds, der giver gal4-UAS-systemets todelte karakter, som har klare fordele i forhold til mere lineære tilgange. F.eks. kan mange flere kombinationer af fører- og reaktionslinjer vurderes, end det ville være muligt, hvis der skulle genereres og opretholdes en ny transgen linje for hver promotor/genkombination. Endnu vigtigere, det giver mulighed for analyse af gener, der producerer dødelige eller sterile fænotyper, når deres udtryk er forstyrret, som er vanskelige at skabe / vedligeholde i et lineært system. Sådanne dødelige fænotyper kan manifestere sig på alle udviklingsstadier, afhængigt af genfunktionen og spatiotemporal ekspression, men observeres oftest under embryonal udvikling. Visualisering myg embryo udvikling kræver clearing af uigennemsigtig chorion, som frakker æggene. Følgende metoder beskrevet i Trpiš (1970)21 og Kaiser et al. (2014)22 beskriver vi de protokoller, vi bruger til at rette embryoner, samtidig med at vi opretholder strukturel integritet og blegning for at rydde den enkercheion, der tillader mikroskopisk visualisering og billeddannelse.
Protocol
Representative Results
Discussion
Forståelse myg genfunktion er afgørende for at udvikle nye tilgange til at kontrollere Anopheles og indvirkning malaria transmission. Det beskrevne GAL4-UAS-system er et alsidigt og kraftfuldt system til funktionel analyse af kandidatgener, og til dato har vi brugt systemet til at undersøge det genetiske grundlag for insekticidresistens17 og cuticular kulbrinteproduktion15,23 samt til fluorescerende tag forskellige myggecellepo…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi anerkender taknemmeligt finansiering fra LSTM og IVCC (Adriana Adolfi), BBSRC (New Investigator Award (AL), MRC (ph.d.-studerende til BCP: MR / P016197 / 1), Wellcome (Sir Henry Wellcome Postdoctoral stipendium til LG: 215894 / Z / 19 / Z), der har indarbejdet Gal4UAS analyse i forslagene.
Materials
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
Riferimenti
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist’s swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O’Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. Genetica. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. Genetica. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Biologia dello sviluppo. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).

