שימוש במערכת GAL4-UAS לגנטיקה תפקודית בגמביה אנופלס
Summary
מערכת GAL4-UAS הדו-צדדית היא כלי רב-תכליתי לשינוי ביטוי גנים באופן ספתיוטמפורלי מבוקר המאפשר ניתוח גנטי תפקודי בגמביה אנופלס. ההליכים המתוארים לשימוש במערכת זו הם אסטרטגיית שיבוט סטנדרטית למחצה, סקס וסינון של גלמים עבור סמני חלבון פלואורסצנטיים קיבעון עובר.
Abstract
מערכת GAL4-UAS הדו-צדדית היא כלי רב-תכליתי ורב עוצמה לניתוח גנטי פונקציונלי. המהות של המערכת היא לחצות קווי ‘נהג’ מהונדסים המבטאים את גורם שעתוק השמרים GAL4 באופן ספציפי לרקמה, עם קווי ‘מגיב’ מהונדסים הנושאים מבנה הפרעות גן/RNA מועמד שהביטוי שלו נשלט על ידי רצפי הפעלה במעלה הזרם (UAS) הקושרים את GAL4. בצאצאים שלאחר מכן, הגן או מבנה ההשתקה מתבטא אפוא באופן spatiotemporal שנקבע, המאפשר פנוטיפים הנובעים להיות נבזי ותפקוד הגנים להסיק. המערכת הבינארית מאפשרת גמישות בגישות ניסיוניות למסך פנוטיפים הנוצרים על ידי ביטוי טרנסג’ן בדפוסים ספציפיים לרקמות מרובות, גם אם עלויות כושר חמורות מושרות. התאמנו את המערכת הזו לאנופלס גמביה, וקטור המלריה העיקרי באפריקה.
במאמר זה, אנו מספקים חלק מההליכים הנפוצים המשמשים במהלך ניתוח GAL4-UAS. אנו מתארים את קווי AN. gambiae GAL4-UAS שכבר נוצרו, כמו גם את השיבוט של מבני מגיב חדשים עבור upregulation ו RNAi נוקאאוט. אנו מציינים מדריך צעד אחר צעד למין של גולם יתושים כדי ליצור צלבים גנטיים, הכולל גם צאצאי סינון כדי לעקוב אחר ירושה של סמני גנים פלואורסצנטיים המתייגים את הנהג ואת החדרות המגיב. אנו מציגים גם פרוטוקול לפינוי עוברים של גמביה כדי לחקור התפתחות עוברית. לבסוף, אנו מציגים התאמות פוטנציאליות של השיטה ליצירת קווי נהג באמצעות CRISPR/Cas9 החדרה של GAL4 במורד הזרם של גנים היעד.
Introduction
מערכת GAL4-UAS הדו-מפלגתית היא סוס העבודה של אפיון תפקודי של גנים באורגניזם מודל החרקים Drosophila melanogaster1,2,3. כדי להשתמש במערכת GAL4-UAS, קווי נהג מהונדסים, המבטאים את גורם שעתוק השמרים GAL4 תחת שליטה על רצף רגולטורי, נחצים עם קווי מגיב הנושאים מבנה של עניין או הפרעות RNA (RNAi) הנשלט על ידי רצף הפעלה במעלה הזרם (UAS) המוכר על ידי GAL4. צאצאי הצלב הזה מבטאים את הטרנסג’ן של העניין בתבנית מרחבית המוכתבת על ידי האמרגן השולט בביטוי GAL4 (איור 1). פנוטיפים המוצגים על ידי צאצאים של צלבים מגיבים לנהג ניתן להעריך כדי להדגיש את הפונקציה של גנים מועמד. למרות D. melanogaster שימש כדי לבחון גנים של אורגניזמים אחרים4,5,6,7, מערכת GAL4-UAS הותאמה כעת לשימוש חרקים בעלי חשיבות רפואית וחקלאית כדי לספק ניתוח ישיר במינים מעניינים 8,9,10,11,12,13,14.
יתוש מלריה אפריקאי, אנופלס גמביה, מערכת GAL4-UAS נבדקה לראשונה על ידי קו התא co-transfection9. מבנים מרובים נידונו ליעילות בשילובים שונים של זוג ומצאו כי 14 UAS חוזרים על עצמם יחד בתוספת intron מלאכותי קטן (UAS-14i) הציג את הטווח הרחב ביותר של פוטנציאל הפעלה בעת שימוש עם לוח של מנהלי התקנים GAL4. כדי להדגים פונקציונליות vivo, מבנים אלה שימשו אז כדי ליצור שני קווי A. gambiae מהונדסים נפרדים על ידי PiggyBac טרנספורמציה8: קו נהג הנושא GAL4 מונע על ידי מקדם ספציפי midgut, וקו מגיב המכיל הן את לוציפראז וחלבון פלואורסצנטי צהוב משופר (eYFP) גנים תחת ויסות רצפי UAS. פעילות לוציפראז ספציפית במעיים פלואורסצנטיות בצאצאים הצביעו על כך שהמערכת יעילה אנופלס. מאז, קווי נהג נוצרו המבטאים טרנסגנים ברקמות אחרות החשובות לקיבולת וקטורית ועמידות לקוטלי חרקים, כולל oenocytes15 ו hemocytes16, ובתבנית קרובה לכל מקום10. קווי UAS רבים נוצרו גם כדי לאבחן גנים שנחשבו מעורבים בחילוף החומרים ועמידות קוטלי חרקים מתווכים, סינתזת פחמימנים cuticular ולתייג באופן פלואורסצנטי סוגי תאים ורקמות שונים (טבלה 1). עבור קווי המגיב, שילוב מכוון אתר של transgene מבוצע כעת על ידי ΦC31 מזורז recombination חילופי 17,18 כדי לתקן את ההקשר הגנומי של הגנים המוסדרים UAS. בדרך זו, ביטוי טרנסג’ן מנורמל לגבי מיקום הכניסה הגנומית, ומאפשר השוואה מדויקת יותר של ההשפעות הפנוטיפיות של גנים מועמדים שונים.
קווי המגיב שנוצרו עד כה נועדו לבטא את הטרנסג’ן ברמות גבוהות או להפחית ביטוי גנים באמצעות הפרעות RNA (RNAi). בדרך כלל שיבוטי cDNA מותכים לרצף UAS כדי ליצור פלסמידים ביטוי מתאים, אולם רצפים גנומיים מלאים הם גם אפשריים בהנחה שהם לא גדולים מדי עבור שיבוט. כדי ליצור מבנים השתקה, השתמשנו בשלוש שיטות שונות כדי להשיג רצפים הפוכים טנדם מתאים היוצרים dsRNA סיכת ראש הממריץ RNAi. אלה כללו פי.סי.אר היתוך, PCR אסימטרי וסינתזה מסחרית של מבנים סיכת ראש. המשותף לכל שיטה הוא הכללה של רצף אינטרוני בין הרצפים ההפוכים כדי לספק יציבות שיבוט. פלסמידים מגיבים שבהם גן של עניין / RNAi מבנה פותחו15. פלסמידים אלה נושאים גם את אתרי ה- ΦC31 ATTB הנדרשים עבור RMCE (המתואר באדולפי המלווה נייר JoVE המתאר בפירוט את טכניקת ה- RCME). פרוטוקולים המכסים את השלבים החשובים הנדרשים בעת בחירת הרצף להכנסה לאחד הפלסמידים האלה לביטוי יתר כלולים בכתב יד זה. בנוסף, שני פרוטוקולים ליצירת מבנה סיכת ראש RNAi מתוארים ומאוירים.
בעת יצירת קווים חדשים, זיהוי של אנשים מהונדסים נדירים הוא חיוני להתרבות כדי להקים ולתחזק מושבות מהונדסות. והכי חשוב עבור מערכת GAL4-UAS יש צורך להבחין בין קווי המגיב והנהג כדי ליצור צלבים ולזהות צאצאים בודדים הנושאים את שני הטרנסגנים. זה מושג באמצעות גנים שונים דומיננטיים סמן לבחירה מקושרים לנהג קלטות מגיב. לרוב אלה הם גנים סמן פלואורסצנטי כי הם בבירור להבחין באמצעות מסננים אופטיים (למשל, eYFP, eCFP, dsRed). חשוב כי סמנים באים לידי ביטוי בתבנית spatiotemporal ידוע ואמין כמו זה עושה זיהוי של חריגות וזיהום קל יותר. ביטוי גן סמן פלואורסצנטי מוסדר באופן שגרתי על ידי מקדם 3xP3 סינתטי, אשר גורם לביטוי ספציפי עין וגרעעים גחוניים בכל שלבי פיתוח An. gambiae19. סמנים פלואורסצנטיים הנשלטים על ידי 3xP3 כלולים בכל פלסמידים טרנספורמציה המתוארים במאמר זה. פרוטוקול המפרט את השיטות הנפוצות המשמשות לסינון קווי גלם גלם GAL4-UAS פלואורסצנטי כלול כאן.
אחד המרכיבים העיקריים של מערכת GAL4-UAS הוא הצורך לחצות את קווי הנהג והמגיב המסומנים באופן דיפרנציאלי. כדי לעשות את זה זכר ונקבות מכל שורה חייב להיות מופרד לפני ההזדווגות. מבוגרים ניתנים להבחנה בקלות על ידי ראייה, עם זאת, עבור הקמת צלבים גנטיים זה הגיוני להפריד את המינים לפני הופעת מבוגר כדי להבטיח כי ההזדווגות לא התרחשה. הבדל הגודל הכללי בין גולם א. גמביה זכר לנקבה משתנה מדי מכדי להיות שיטה יעילה ומהימנה לקביעת מין20. במקום זאת הבדלים מורפולוגיים ברורים באיברי המין החיצוניים מספקים בסיס אמין למין ב – An. gambiae. במאמר זה, אנו מתארים שיטה אמינה למין גולם An. gambiae כדי להגדיר צלבים מתאימים.
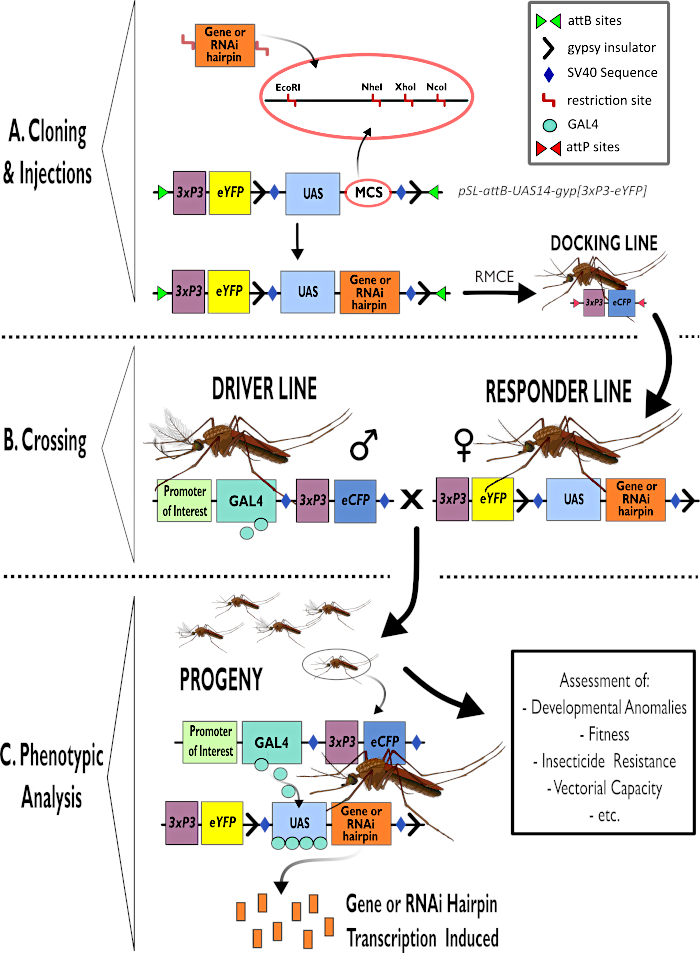
איור 1 – ייצוג דיאגרמתי של תהליך לשימוש במערכת GAL4-UAS הדו-מפלגתית ב-Anopheles gambiae. (A) הרכיבים העיקריים של וקטור לדוגמה (pSL-attB-UAS14-gyp[3xp3-eYFP]) מתוארים, המפרטים את אתרי ההגבלה הזמינים (EcoRI, NheI, XhoI ו- NcoI) בתוך אתרי השיבוט המרובים המתאימים לשימוש כדי להכניס את מבנה סיכת הראש או רצף הקידוד עבור גן העניין. מבנה קו העגינה מתואר גם הוא. (ב) שלב המעבר מומחש המציין את השימוש בזכרים מקו הנהג (נשיאת נהג GAL4 על ידי מקדם עניין ו- eCFP המונע על ידי מקדם 3xP3) ונקבות מקו המגיב (הנושא את גן העניין או מבנה סיכת הראש הנשלט על ידי מקדם UAS וסמן eYFP הנשלט על ידי מקדם 3xP3). (ג) ייצוג דיאגרמתי של ביטוי נהיגה GAL4 של גן העניין בצאצאי הצלב ב- B ורשימה של כמה מהפנוטיפים הטיפוסיים המוערכים. קיצורים: אתר שיבוט מרובים (MCS), החלפת קלטות בתיווך רקומבינאז (RMCE), רצף מפעיל במעלה הזרם (UAS), חלבון פלואורסצנטי צהוב משופר (eYFP), חלבון פלואורסצנטי ציאן משופר (eCFP). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
זהו השימוש בצלבים המספק את האופי הדו-צדדי של מערכת GAL4-UAS, שיש לה יתרונות ברורים על פני גישות ליניאריות יותר. לדוגמה, ניתן להעריך שילובים רבים יותר של קווי נהג ומגיב מאשר היה אפשרי אם היה צורך ליצור ולתחזק קו מהונדס חדש עבור כל שילוב מקדם / גנים. חשוב מכך, הוא מאפשר ניתוח של גנים המייצרים פנוטיפים קטלניים או סטריליים כאשר הביטוי שלהם מוטרד אשר קשה ליצור / לתחזק במערכת ליניארית. פנוטיפים קטלניים כאלה יכולים להתבטא בכל השלבים ההתפתחותיים, בהתאם לתפקוד הגנים ולביטוי spatiotemporal, אך הם נצפים לרוב במהלך התפתחות עוברית. הדמיית התפתחות העובר יתוש דורש ניקוי של chorion אטום אשר מצפה את הביצים. בעקבות שיטות המתוארות ב- Trpiš (1970)21 וקייזר ואח ‘ (2014)22, אנו מתארים את הפרוטוקולים בהם אנו משתמשים כדי לתקן עוברים, תוך שמירה על שלמות מבנית, והלבנה כדי לנקות את האנדוריון המאפשר הדמיה והפכה מיקרוסקופית.
Protocol
Representative Results
Discussion
הבנת תפקוד גן היתושים חיונית לפיתוח גישות חדשות לשליטה באנופלים ולהשפעת העברת המלריה. מערכת GAL4-UAS המתוארת היא מערכת רב-תכליתית וחזקה לניתוח פונקציונלי של גנים מועמדים ועד כה השתמשנו במערכת כדי לבחון את הבסיס הגנטי של עמידות לחומרי הדברה17 וייצור פחמימנים חמודי?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
אנו מודים במימון מ- LSTM ו- IVCC (אדריאנה אדולפי), BBSRC (פרס החוקר החדש (AL), MRC (סטודנט לדוקטורט ל- BCP:MR/P016197/1), Wellcome (מלגת פוסט-דוקטורט של סר הנרי וולקום ל- LG: 215894/Z/19/Z) ששילבו את ניתוח Gal4UAS בהצעות.
Materials
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
Riferimenti
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist’s swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O’Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. Genetica. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. Genetica. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Biologia dello sviluppo. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).

