استخدام نظام GAL4-UAS لعلم الوراثة الوظيفية في أنوفيليس غامبيا
Summary
نظام GAL4-UAS ثنائي الأطراف هو أداة متعددة الاستخدامات لتعديل التعبير الجيني بطريقة ندواتية خاضعة للرقابة تسمح بالتحليل الوراثي الوظيفي في أنوفيليس غامبيا. والإجراءات الموصوفة لاستخدام هذا النظام هي استراتيجية استنساخ شبه موحدة، والجنس وفحص الخوادر للكشف عن علامات البروتين الفلورية تثبيت الأجنة.
Abstract
نظام GAL4-UAS ثنائي الأطراف هو أداة متعددة الاستخدامات وقوية للتحليل الجيني الوظيفي. جوهر النظام هو عبور خطوط “السائق” المعدلة وراثيا التي تعبر عن عامل نسخ الخميرة GAL4 بطريقة محددة الأنسجة، مع خطوط “المستجيب” المعدلة وراثيا تحمل الجينات مرشح / الجيش الملكي النيبالي تدخل بناء الذي يتم التحكم في التعبير عن طريق تسلسل التنشيط المنبع (UAS) التي تربط GAL4. في ذرية ما تلا ذلك، يتم التعبير عن بناء الجينات أو إسكات بطريقة محددة الفضة، مما يتيح الأنماط الظاهرية الناتجة أن يتم فحصها واستدلال وظيفة الجينات. يتيح النظام الثنائي المرونة في النهج التجريبية لفحص الأنماط الظاهرية الناتجة عن التعبير المتحول في أنماط متعددة خاصة بالأنسجة ، حتى لو تم تحريض تكاليف اللياقة البدنية الشديدة. وقد قمنا بتكييف هذا النظام مع أنوفيليس غامبيا، الناقل الرئيسي للملاريا في أفريقيا.
في هذه المقالة، نقدم بعض الإجراءات الشائعة المستخدمة أثناء تحليل GAL4-UAS. ونصف خطوط An. gambiae GAL4-UAS التي تم إنشاؤها بالفعل، وكذلك استنساخ البنى المستجيبة الجديدة ل upregulation وRNAi بالضربة القاضية. نحدد دليلا خطوة بخطوة لممارسة الجنس مع جرو البعوض لإنشاء الصلبان الوراثية ، والتي تشمل أيضا فحص ذرية لمتابعة ميراث علامات الجينات الفلورية التي تشير إلى إدخال السائق والمستجيب. كما نقدم بروتوكولا لتطهير أجنة أنغامبيا لدراسة التطور الجنيني. وأخيرا، نقدم التكيفات المحتملة للطريقة لتوليد خطوط السائق من خلال إدراج CRISPR/Cas9 من GAL4 المصب من الجينات المستهدفة.
Introduction
نظام GAL4-UAS ثنائي الأطراف هو العمود الفقري لتوصيف وظيفي للجينات في الكائن الحي نموذج الحشرات Drosophila melanogaster1،2،3. لاستخدام نظام GAL4-UAS ، يتم عبور خطوط السائق المعدلة وراثيا ، والتي تعبر عن عامل نسخ الخميرة GAL4 تحت سيطرة تسلسل تنظيمي ، مع خطوط المستجيب التي تحمل جينا مهما أو بناء تداخل الحمض النووي الريبي (RNAI) الذي يتحكم فيه تسلسل تنشيط المنبع (UAS) المعترف به من قبل GAL4. تعبر ذرية هذا الصليب عن تحويل الاهتمام بنمط ندواتي يمليه المروج الذي يتحكم في تعبير GAL4 (الشكل 1). يمكن تقييم الأنماط الظاهرية التي تظهرها ذرية الصلبان المستجيبة للسائق لتوضيح وظيفة الجينات المرشحة. على الرغم من أن D. melanogaster قد استخدمت لفحص الجينات من الكائنات الحية الأخرى4,5,6,7, وقد تم تكييف نظام GAL4-UAS الآن لاستخدامها في الحشرات ذات الأهمية الطبية والزراعية لتوفير تحليل مباشر في الأنواع ذات الأهمية 8,9,10,11,12,13,14.
وفي بعوضة الملاريا الأفريقية، أنوفيليس غامبيا، تم اختبار نظام GAL4-UAS لأول مرة عن طريق خط الخلية المشترك transfection9. تم فحص العديد من البنى للكفاءة في تركيبات مختلفة ثنائية ووجدت أن 14 UAS المتكررة جنبا إلى جنب تكملها intron اصطناعية صغيرة (UAS-14i) عرض أوسع نطاق من إمكانات التنشيط عند استخدامها مع لوحة من السائقين GAL4. لإثبات في وظائف الجسم الحي، ثم استخدمت هذه البنى لإنشاء خطين منفصلين المعدلة وراثيا An. غامبيا بواسطة PiggyBac transformation8: خط سائق يحمل GAL4 يقودها مروج محدد midgut، وخط المستجيب التي تحتوي على كل من لوسيفيراز وتعزيز الجينات البروتين الفلوري الأصفر (eYFP) تحت تنظيم تسلسل UAS. وأشار نشاط لوسيفيراز محددة الأمعاء والفلورسينس في ذرية أن النظام كان فعالا في Anopheles. ومنذ ذلك الحين، تم إنشاء خطوط للسائق تعبر عن المتحولات في الأنسجة الأخرى الهامة لقدرة النواقل ومقاومة المبيدات الحشرية، بما في ذلك oenocytes15 و hemocytes16، وفي نمط قريب من كل مكان10. كما تم إنشاء العديد من خطوط UAS لتقصي الجينات التي يعتقد أنها تشارك في عملية التمثيل الغذائي وعزل مقاومة المبيدات الحشرية بوساطة ، وتركيب الهيدروكربونات الخصية ووضع علامات فلورية على أنواع مختلفة من الخلايا والأنسجة (الجدول 1). بالنسبة لخطوط المستجيب ، يتم الآن تنفيذ التكامل الموجه من الموقع للمتحول من قبل ΦC31 الكاسيت المحفز 17،18 لإصلاح السياق الجينومي للجينات المنظمة ل UAS. وبهذه الطريقة، يتم تطبيع التعبير المتحول فيما يتعلق بموقع الإدراج الجينومي، مما يسمح بإجراء مقارنة أكثر دقة للآثار الظاهرية للجينات المرشحة المختلفة.
تم تصميم خطوط المستجيب التي تم إنشاؤها حتى الآن إما للتعبير عن المتحول إما عند مستويات مرتفعة أو للحد من التعبير الجيني من خلال تداخل الحمض النووي الريبي (RNAAi). عادة ما يتم دمج استنساخ cDNA في تسلسل UAS لتوليد البلازميدات التعبيرية المناسبة ، ولكن التسلسلات الجينومية الكاملة ممكنة أيضا على افتراض أنها ليست كبيرة جدا للاستنساخ. لتوليد بناء إسكات، استخدمنا ثلاث طرق مختلفة للحصول على تسلسل مقلوب جنبا إلى جنب مناسبة التي تشكل دبوس الشعر dsRNA الذي يحفز RNAI. وشملت هذه PCR الانصهار، PCR غير المتماثلة والتوليف التجاري لبنى دبوس الشعر. ومن الشائع في كل طريقة إدراج تسلسل إنتروني بين التسلسلات المقلوبة لتوفير استقرار الاستنساخ. وقد تم تطوير البلازميدات المستجيبة التي يمكن إدخال جين من الفائدة / بناء RNAi15. هذه البلازميدات تحمل أيضا مواقع ATTB ΦC31 المطلوبة لRMCE (الموصوفة في ورقة أدولفي المصاحبة JoVE التي تصف تقنية RCME بالتفصيل). تتضمن هذه المخطوطة بروتوكولات تغطي الخطوات المهمة المطلوبة عند اختيار التسلسل لإدراجه في إحدى هذه البلازميدات للإفراط في التعبير. بالإضافة إلى ذلك، يتم وصف ويتضح بروتوكولين لإنشاء بناء دبوس الشعر RNAi.
عند إنشاء خطوط جديدة، وتحديد الأفراد المعدلة وراثيا نادرة أمر بالغ الأهمية للتكاثر من لإنشاء وصيانة المستعمرات المعدلة وراثيا. والأهم من ذلك بالنسبة لنظام GAL4-UAS هناك ضرورة للتمييز بين خطوط المستجيب والسائق لإنشاء الصلبان وتحديد ذرية الفردية التي تحمل كلا المتحولين. ويتحقق ذلك باستخدام جينات مختلفة مهيمنة للعلامات القابلة للاختيار مرتبطة بمقايس السائق والمستجيب. الأكثر شيوعا هذه هي الجينات علامة الفلورسنت التي يمكن تمييزها بوضوح باستخدام المرشحات البصرية (على سبيل المثال، eYFP، eCFP، dsRed). من المهم أن يتم التعبير عن العلامات في نمط ندواتي معروف وموثوق به لأن هذا يجعل تحديد التشوهات والتلوث أسهل. يتم تنظيم التعبير الجيني لعلامة الفلورسنت بشكل روتيني من قبل المروج الاصطناعي 3xP3 ، والذي يسبب تعبيرا محددا للعين والبطين في جميع مراحل التنمية الغامبية An. يتم تضمين علامات الفلورسنت التي تسيطر عليها 3xP3 في جميع plasmids التحول الموصوفة في هذه المقالة. يتم تضمين بروتوكول يفصل الأساليب الشائعة المستخدمة لفحص خطوط الفلورسنت An. غامبيا PUPAe GAL4-UAS هنا.
أحد العناصر الرئيسية لنظام GAL4-UAS هو ضرورة عبور خطوط السائق والمستجيب المميزة بشكل متفاوت. للقيام بذلك يجب فصل الذكور والإناث من كل خط قبل التزاوج. الكبار يمكن تمييزها بسهولة عن طريق البصر، ومع ذلك، لإنشاء الصلبان الوراثية فمن المعقول لفصل بين الجنسين قبل ظهور الكبار لضمان أن التزاوج لم يحدث. والفرق العام في الحجم بين الذكور والإناث An. gambiae pupae متغير جدا بحيث لا يمكن أن يكون طريقة فعالة ويمكن الاعتماد عليها لتحديد نوع الجنس20. وبدلا من ذلك، توفر الاختلافات المورفولوجية الواضحة في الأعضاء التناسلية الخارجية أساسا موثوقا به لممارسة الجنس في أن غامبيا. في هذه المقالة، ونحن نصف طريقة يمكن الاعتماد عليها لممارسة الجنس An. الغامبية الخوادر لإعداد الصلبان المناسبة.
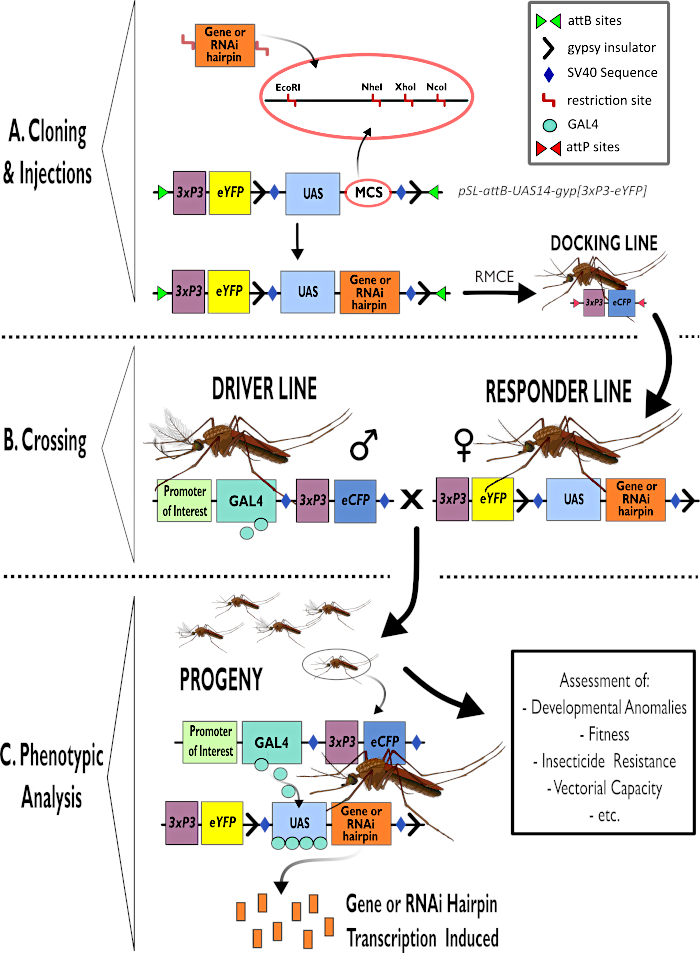
الشكل 1 – التمثيل التخطيطي لعملية استخدام نظام GAL4-UAS ثنائي الأطراف في أنوفيليس غامبيا. (أ) يتم تصوير المكونات الرئيسية لمتجه مثال (pSL-attB-UAS14-gyp [3xp3-eYFP]) ، مع تفصيل مواقع التقييد المتاحة (EcoRI و NheI و XhoI و NcoI) داخل مواقع الاستنساخ المتعددة المناسبة للاستخدام لإدراج بناء دبوس الشعر أو تسلسل الترميز لجين الاهتمام. كما يصور هيكل خط الإرساء. (ب) توضح خطوة العبور استخدام الذكور من خط السائق (تحمل سائق GAL4 من قبل مروج للاهتمام وeCFP يقودها المروج 3xP3) والإناث من خط المستجيب (تحمل جين الاهتمام أو بناء دبوس الشعر التي يسيطر عليها مروج UAS وعلامة eYFP التي يسيطر عليها المروج 3xP3). (ج) تمثيل تخطيطي ل GAL4 يقود التعبير عن جين الاهتمام بذرية الصليب في B وقائمة ببعض الأنماط الظاهرية النموذجية التي يتم تقييمها. الاختصارات: موقع استنساخ متعدد (MCS)، تبادل كاسيت بوساطة إعادة دمج (RMCE)، تسلسل المنشط المنبع (UAS)، البروتين الفلوري الأصفر المعزز (eYFP)، بروتين فلوري سماوي معزز (eCFP). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
إن استخدام الصلبان هو الذي يوفر الطبيعة الثنائية لنظام GAL4-UAS، الذي له مزايا متميزة على النهج الخطية الأكثر. فعلى سبيل المثال، يمكن تقييم توليفات من خطوط السائق والمستجيب أكثر بكثير مما يمكن أن يكون ممكنا إذا كان لا بد من إنشاء خط جديد معدل وراثيا وصيانته لكل تركيبة من مجموعات المروجين/الجينات. والأهم من ذلك، أنه يسمح بتحليل الجينات التي تنتج الأنماط الظاهرية القاتلة أو العقيمة عندما يكون تعبيرها مضطربا والتي يصعب إنشاؤها / صيانتها في نظام خطي. ويمكن أن تظهر هذه الأنماط الظاهرية الفتاكة في جميع مراحل النمو، اعتمادا على وظيفة الجينات والتعبير الصدغي، ولكن غالبا ما يلاحظ أثناء النمو الجنيني. يتطلب تصور نمو جنين البعوض إزالة المشيمة المبهمة التي تغطي البيض. بعد الأساليب الموصوفة في Trpiš (1970)21 وكايزر وآخرون (2014)22، نقوم بوصف البروتوكولات التي نستخدمها لإصلاح الأجنة، مع الحفاظ على السلامة الهيكلية، والتبييض لمسح الإندوشوريون الذي يسمح بالتصور والتصوير المجهريين.
Protocol
Representative Results
Discussion
إن فهم وظيفة الجينات للبعوض أمر حيوي لتطوير نهج جديدة لمكافحة الأنوفيليس والتأثير على انتقال الملاريا. نظام GAL4-UAS الموصوف هو نظام متعدد الاستخدامات وقوي للتحليل الوظيفي للجينات المرشحة وحتى الآن استخدمنا النظام لدراسة الأساس الوراثي لمقاومة المبيدات الحشرية17 وإنتاج ا?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
ونحن نعترف بامتنان التمويل من LSTM وIVCC (أدريانا أدولفي)، BBSRC (جائزة المحقق الجديد (AL)، MRC (درجة الدكتوراه إلى BCP:MR/P016197/1)، ويلكوم (السير هنري ويلكوم زمالة ما بعد الدكتوراه إلى LG: 215894/Z/19/Z) التي أدرجت تحليل Gal4UAS في المقترحات.
Materials
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
Riferimenti
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist’s swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O’Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. Genetica. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. Genetica. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Biologia dello sviluppo. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).

