Utilizzo del sistema GAL4-UAS per la genetica funzionale in Anopheles gambiae
Summary
Il sistema bipartito GAL4-UAS è uno strumento versatile per la modifica dell’espressione genica in modo spaziotemporale controllato che consente l’analisi genetica funzionale in Anopheles gambiae. Le procedure descritte per l’utilizzo di questo sistema sono una strategia di clonazione semi-standardizzata, sexing e screening delle pupe per marcatori proteici fluorescenti e fissazione dell’embrione.
Abstract
Il sistema bipartito GAL4-UAS è uno strumento versatile e potente per l’analisi genetica funzionale. L’essenza del sistema è quella di incrociare linee transgeniche “driver” che esprimono il fattore di trascrizione del lievito GAL4 in modo specifico per il tessuto, con linee transgeniche “responder” portatrici di un costrutto di interferenza gene/RNA candidato la cui espressione è controllata da Upstream Activation Sequences (UAS) che legano GAL4. Nella progenie che ne consegue, il gene o il costrutto di silenziamento è quindi espresso in modo spaziotemporale prescritto, consentendo di dosare i fenotipi risultanti e di dedurre la funzione genica. Il sistema binario consente flessibilità negli approcci sperimentali per lo screening dei fenotipi generati dall’espressione transgenica in più modelli tessuto-specifici, anche se sono indotti gravi costi di fitness. Abbiamo adattato questo sistema per Anopheles gambiae, il principale vettore di malaria in Africa.
In questo articolo vengono fornite alcune delle procedure comuni utilizzate durante l’analisi GAL4-UAS. Descriviamo le linee An. gambiae GAL4-UAS già generate, così come la clonazione di nuovi costrutti di responder per l’upregulation e il knockdown RNAi. Specifichiamo una guida passo passo per il sexing delle pupe di zanzara per stabilire incroci genetici, che include anche lo screening della progenie per seguire l’ereditarietà di marcatori genetici fluorescenti che etichettano le inserzioni del conducente e del soccorritore. Presentiamo anche un protocollo per la rimozione degli embrioni di An. gambiae per studiare lo sviluppo embrionale. Infine, introduciamo potenziali adattamenti del metodo per generare linee driver attraverso l’inserimento CRISPR/Cas9 di GAL4 a valle dei geni bersaglio.
Introduction
Il sistema bipartito GAL4-UAS è il cavallo di battaglia della caratterizzazione funzionale dei geni nell’organismo modello di insetto Drosophila melanogaster1,2,3. Per utilizzare il sistema GAL4-UAS, le linee driver transgeniche, che esprimono il fattore di trascrizione del lievito GAL4 sotto il controllo di una sequenza regolatoria, vengono incrociate con linee di responder portatrici di un costrutto di genico di interesse o di interferenza dell’RNA (RNAi) controllato da una sequenza di attivazione a monte (UAS) riconosciuta da GAL4. La progenie di questa croce esprime il transgene di interesse per un pattern spaziotemporale dettato dal promotore che controlla l’espressione GAL4 (Figura 1). I fenotipi visualizzati dalla progenie di incroci driver-responder possono essere valutati per chiarire la funzione dei geni candidati. Sebbene D. melanogaster sia stato utilizzato per esaminare geni di altri organismi4,5,6,7, il sistema GAL4-UAS è stato ora adattato per l’uso in insetti di importanza medica e agricola per fornire analisi dirette nelle specie di interesse 8,9,10,11,12,13,14.
Nella zanzara africana della malaria, Anopheles gambiae, il sistema GAL4-UAS è stato testato per la prima volta dalla co-trasfezione della linea cellulare9. Sono stati analizzati più costrutti per l’efficienza in diverse combinazioni a coppie e hanno scoperto che 14 UAS ripetuti in tandem integrati con un piccolo introne artificiale (UAS-14i) mostravano la più ampia gamma di potenziale di attivazione quando utilizzati con un pannello di driver GAL4. Per dimostrare la funzionalità in vivo, questi costrutti sono stati poi utilizzati per creare due linee transgeniche Separate an. gambiae mediante la trasformazione piggyBac8: una linea driver che trasporta GAL4 guidata da un promotore specifico del midgut e una linea di risposta contenente sia la luciferasi che i geni della proteina fluorescente gialla potenziata (eYFP) sotto la regolazione delle sequenze UAS. L’attività della luciferasi specifica dell’intestino e la fluorescenza nella progenie indicavano che il sistema era efficiente in Anopheles. Da allora, sono state create linee driver che esprimono transgeni in altri tessuti importanti per la capacità vettoriale e la resistenza agli insetticidi, compresi gli enociti15 e gli emociti16, e in un modello quasi onnipresente10. Sono state inoltre generate numerose linee UAS per analizzare geni ritenuti coinvolti nel metabolismo e nel sequestro mediato dalla resistenza agli insetticidi, dalla sintesi di idrocarburi cuticolari e per etichettare fluorescentemente diversi tipi di cellule e tessuti (Tabella 1). Per le linee di risposta, l’integrazione site-directed del transgene viene ora eseguita mediante scambio di cassette di ricombinazione catalizzate ΦC31111117,18 per fissare il contesto genomico dei geni regolati UAS. In questo modo, l’espressione transgenica viene normalizzata per quanto riguarda la posizione di inserimento genomico, consentendo un confronto più accurato degli effetti fenotipici di diversi geni candidati.
Le linee di risposta create fino ad oggi sono progettate per esprimere il transgene a livelli elevati o per ridurre l’espressione genica attraverso l’interferenza dell’RNA (RNAi). Di solito i cloni di cDNA sono fusi alla sequenza UAS per generare plasmidi di espressione adatti, tuttavia anche le sequenze genomiche complete sono fattibili supponendo che non siano troppo grandi per la clonazione. Per generare costrutti di silenziamento, abbiamo usato tre diversi metodi per ottenere sequenze invertite in tandem adatte che formano dsRNA a forcina che stimola l’RNAi. Questi hanno incluso la PCR di fusione, la PCR asimmetrica e la sintesi commerciale di costrutti a forcina. Comune a ciascun metodo è l’inclusione di una sequenza di introni tra le sequenze invertite per fornire stabilità di clonazione. Sono stati sviluppati plasmidi responder in cui può essere inserito un costrutto gene di interesse/RNAi15. Questi plasmidi portano anche i siti ΦC31 attB richiesti per RMCE (descritti in Adolfi che accompagna l’articolo JoVE che descrive la tecnica RCME in dettaglio). I protocolli che coprono i passaggi importanti richiesti quando si seleziona la sequenza per l’inserimento in uno di questi plasmidi per la sovraespressione sono inclusi in questo manoscritto. Inoltre, vengono descritti e illustrati due protocolli per la creazione di costrutti a forcina RNAi.
Quando si creano nuove linee, l’identificazione di individui transgenici rari è fondamentale per riprodursi per stabilire e mantenere colonie transgeniche. Ancora più importante per il sistema GAL4-UAS c’è la necessità di distinguere le linee di risposta e driver per stabilire incroci e identificare la progenie individuale che trasporta entrambi i transgeni. Ciò si ottiene utilizzando diversi geni marcatori selezionabili dominanti collegati alle cassette del conducente e del risponditore. Più comunemente si tratta di geni marcatori fluorescenti che sono chiaramente distinguibili utilizzando filtri ottici (ad esempio, eYFP, eCFP, dsRed). È importante che i marcatori siano espressi in un modello spaziotemporale noto e affidabile in quanto ciò rende più facile l’identificazione delle anomalie e della contaminazione. L’espressione genica dei marcatori fluorescenti è regolata di routine dal promotore sintetico 3xP3, che causa l’espressione specifica dei gangli oculari e ventrali in tutte le fasi dello sviluppo di An. gambiae19. I marcatori fluorescenti controllati da 3xP3 sono inclusi in tutti i plasmidi di trasformazione descritti in questo articolo. Un protocollo che descrive in dettaglio i metodi comuni utilizzati per schermare le linee fluorescenti An. gambiae pupae GAL4-UAS è incluso qui.
Uno degli elementi chiave del sistema GAL4-UAS è la necessità di attraversare le linee di guida e di risposta con marcatura differenziale. Per fare questo maschio e femmine da ogni linea devono essere separati prima dell’accoppiamento. Gli adulti sono facilmente distinguibili dalla vista, tuttavia, per stabilire incroci genetici è sensato separare i sessi prima dell’emergere degli adulti per garantire che l’accoppiamento non si sia verificato. La differenza generale di dimensioni tra maschio e femmina An. gambiae pupae è troppo variabile per essere un metodo efficiente e affidabile di determinazione del sesso20. Invece chiare differenze morfologiche nei genitali esterni forniscono una base affidabile per il sexing in An. gambiae. In questo articolo, descriviamo un metodo affidabile per il sexing An. gambiae pupae per impostare croci appropriate.
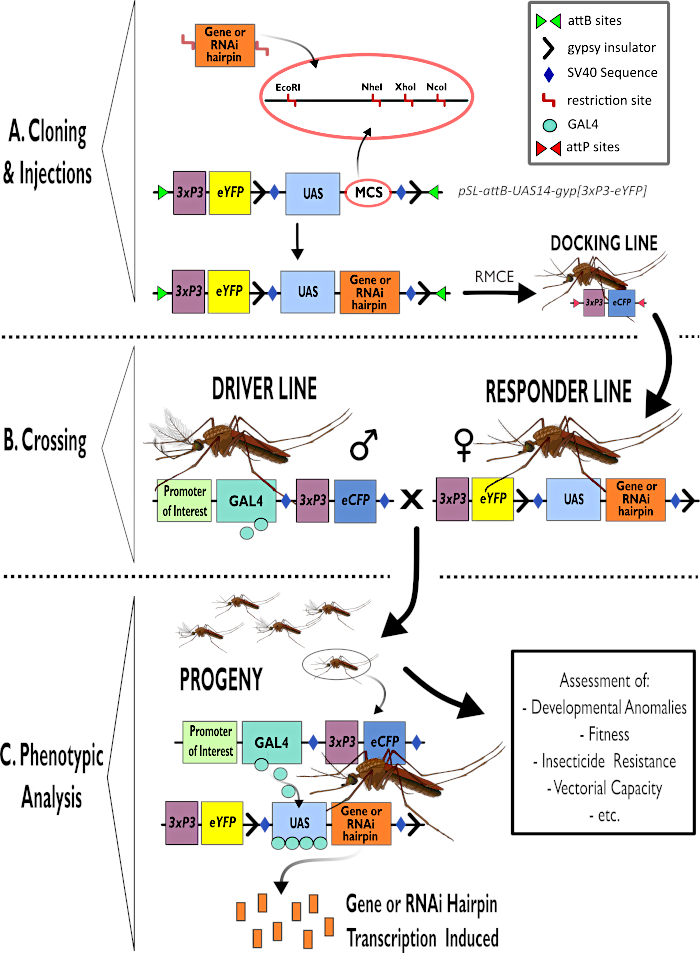
Figura 1 – Rappresentazione diagrammatica del processo per l’utilizzo del sistema bipartito GAL4-UAS in Anopheles gambiae. (A) Sono rappresentati i componenti principali di un vettore di esempio (pSL-attB-UAS14-gyp[3xp3-eYFP]), che descrivono in dettaglio i siti di restrizione disponibili (EcoRI, NheI, XhoI e NcoI) all’interno dei siti di clonazione multipli che sono adatti all’uso per inserire il costrutto a forcina o la sequenza codificante per il gene di interesse. Anche la struttura della linea di attracco è raffigurata. (B) La fase di attraversamento è illustrata indicando l’uso di maschi dalla linea di guida (che trasportano il conducente GAL4 da un promotore di interesse e eCFP guidato dal promotore 3xP3) e femmine dalla linea di risposta (portatori del gene di interesse o del costrutto a forcina controllato da un promotore UAS e da un marcatore eYFP controllato dal promotore 3xP3). (C) Una rappresentazione diagrammatica dell’espressione trainante GAL4 del gene di interesse nella progenie della croce in B e un elenco di alcuni dei fenotipi tipici che vengono valutati. Abbreviazioni: Multiple Cloning Site (MCS), Recombinase mediated cassette exchange (RMCE), Upstream Activator Sequence (UAS), enhanced yellow fluorescent protein (eYFP), enhanced cyan fluorescent protein (eCFP). Fare clic qui per visualizzare una versione più grande di questa figura.
È l’uso delle croci che fornisce la natura bipartita del sistema GAL4-UAS, che presenta vantaggi distinti rispetto agli approcci più lineari. Ad esempio, è possibile valutare molte più combinazioni di linee driver e responder di quanto sarebbe fattibile se una nuova linea transgenica dovesse essere generata e mantenuta per ciascuna combinazione promotore/gene. Ancora più importante, consente l’analisi di geni che producono fenotipi letali o sterili quando la loro espressione è perturbata che sono difficili da creare / mantenere in un sistema lineare. Tali fenotipi letali possono manifestarsi in tutte le fasi dello sviluppo, a seconda della funzione genica e dell’espressione spaziotemporale, ma sono più spesso osservati durante lo sviluppo embrionale. Visualizzare lo sviluppo dell’embrione di zanzara richiede la pulizia del corion opaco che ricopre le uova. Seguendo i metodi descritti in Trpiš (1970)21 e Kaiser et al. (2014)22, descriviamo i protocolli che usiamo per fissare gli embrioni, pur mantenendo l’integrità strutturale, e lo sbiancamento per eliminare l’endocorion che consente la visualizzazione microscopica e l’imaging.
Protocol
Representative Results
Discussion
Comprendere la funzione del gene della zanzara è vitale per sviluppare nuovi approcci per controllare l’anofele e influenzare la trasmissione della malaria. Il sistema GAL4-UAS descritto è un sistema versatile e potente per l’analisi funzionale dei geni candidati e ad oggi abbiamo utilizzato il sistema per esaminare le basi genetiche della resistenza agli insetticidi17 e della produzione di idrocarburi cuticolari15,23, nonché per etichettare fluorescentemente diverse popolazioni di cel…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Riconosciamo con gratitudine i finanziamenti di LSTM e IVCC (Adriana Adolfi), BBSRC (New Investigator Award (AL), MRC (PhD studentship a BCP: MR / P016197 / 1), Wellcome (Sir Henry Wellcome Postdoctoral fellowship to LG: 215894 / Z / 19 / Z) che hanno incorporato l’analisi Gal4UAS nelle proposte.
Materials
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
Riferimenti
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist’s swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O’Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. Genetica. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. Genetica. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Biologia dello sviluppo. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).

