Anopheles gambiae'de Fonksiyonel Genetik için GAL4-UAS Sistemini Kullanma
Summary
bipartit GAL4-UAS sistemi, Anopheles gambiae’de fonksiyonel genetik analize izin veren kontrollü bir mekansal şekilde gen ekspresyonunun değiştirilmesi için çok yönlü bir araçtır. Bu sistemi kullanmak için açıklanan prosedürler yarı standart bir klonlama stratejisi, floresan protein belirteçleri ve embriyo fiksasyonu için pupaların cinsiyetlenmesi ve taranmasıdır.
Abstract
bipartit GAL4-UAS sistemi fonksiyonel genetik analiz için çok yönlü ve güçlü bir araçtır. Sistemin özü, maya transkripsiyon faktörü GAL4’ü dokuya özgü bir şekilde ifade eden transgenik ‘sürücü’ çizgilerini, ifadesi GAL4’ü bağlayan Yukarı Akış Aktivasyon Dizileri (UAS) tarafından kontrol edilen bir aday gen / RNA girişim yapısı taşıyan transgenik ‘yanıtlayıcı’ çizgilerle geçmektir. Ortaya çıkan soyda, gen veya susturma yapısı böylece öngörülen bir mekanotemporal şekilde ifade edilir ve ortaya çıkan fenotiplerin test edilmesine ve gen fonksiyonunun ortaya çıkarılmasına olanak tanır. İkili sistem, ciddi fitness maliyetleri indüklseniz bile, dokuya özgü birden fazla desende transgene ekspresyosu tarafından oluşturulan fenotipleri taramak için deneysel yaklaşımlarda esneklik sağlar. Bu sistemi Afrika’daki başlıca sıtma vektörü olan Anopheles gambiae için uyarladık.
Bu makalede, GAL4-UAS analizi sırasında kullanılan yaygın prosedürlerden bazılarını sunuyoruz. An. gambiae GAL4-UAS hatlarının yanı sıra, yeniden nüfusa alma ve RNAi devirme için yeni yanıtlayıcı yapılarının klonlanmasını açıklıyoruz. Genetik haçlar oluşturmak için sivrisinek pupalarının cinsiyeti için adım adım bir kılavuz belirtiyoruz, bu da sürücüyü ve yanıtlayıcı eklemelerini etiketleyen floresan gen belirteçlerinin kalıtımını takip etmek için tarama soyunu da içerir. Ayrıca embriyonik gelişimi incelemek için An. gambiae embriyolarının temizlenmesi için bir protokol sunuyoruz. Son olarak, hedef genlerin GAL4 aşağı akışının CRISPR/Cas9 yerleştirilmesi yoluyla sürücü hatları oluşturmak için yöntemin potansiyel uyarlamalarını sunuyoruz.
Introduction
Bipartit GAL4-UAS sistemi, böcek modeli organizma Drosophila melanogaster1,2,3’teki genlerin fonksiyonel karakterizasyonunun çalışma atıdır. GAL4-UAS sistemini kullanmak için, bir düzenleyici sıranın kontrolü altındaki maya transkripsiyon faktörü GAL4’ü ifade eden transgenik sürücü hatları, GAL4 tarafından tanınan bir Yukarı Akış Aktivasyon Sırası (UAS) tarafından kontrol edilen bir ilgi geni veya RNA paraziti (RNAi) yapısı taşıyan yanıtlayıcı çizgilerle geçilir. Bu haçın soyu, GAL4 ekspresyonunun kontrolüne geçen organizatör tarafından dikte edilen mekansal bir desene olan ilginin transgenesini ifade eder (Şekil 1). Sürücü-yanıtlayıcı haçların soyu tarafından görüntülenen fenotipler, aday genlerin işlevini aydınlatacak şekilde değerlendirilebilir. D. melanogaster diğer organizmalardan gelen genleri incelemek için kullanılmış olmasına rağmen4,5,6,7, GAL4-UAS sistemi şimdi ilgi türlerinde doğrudan analiz sağlamak için tıbbi ve tarımsal öneme sahip böceklerde kullanılmak üzere uyarlanmıştır 8,9,10,11,12,13,14.
Afrika sıtma sivrisinek, Anopheles gambiae, GAL4-UAS sistemi ilk hücre hattı ortak transfection9 tarafından test edildi. Farklı çift yönlü kombinasyonlarda verimlilik için birden fazla yapı test edildi ve küçük bir yapay intron (UAS-14i) ile desteklenmiş 14 tandemly tekrarlanan UAS’ın GAL4 sürücülerinden oluşan bir panelle kullanıldığında en geniş aktivasyon potansiyelini gösterdiği bulundu. In vivo işlevselliğini göstermek için, bu yapılar daha sonra PiggyBac dönüşümü8 tarafından iki ayrı transgenik An. gambiae hattı oluşturmak için kullanıldı: ortagut spesifik bir promotör tarafından sürülen GAL4 taşıyan bir sürücü hattı ve UAS dizilerinin düzenlenmesi altında hem luciferaz hem de gelişmiş sarı floresan protein (eYFP) genlerini içeren bir yanıtlayıcı hattı. Bağırsak spesifik luciferaz aktivitesi ve soydaki floresan, sistemin Anopheles’te verimli olduğunu gösterdi. O zamandan beri, oenositler15 ve hemositler16 da dahil olmak üzere vektörel kapasite ve insektisit direnci için önemli olan diğer dokularda ve her yerde bulunan bir desene yakın bir desende transgenes ifade eden sürücü çizgileri oluşturulmuştur10. Metabolizma ve sequestrasyon aracılı insektisit direnci, kütiküler hidrokarbon sentezi ve farklı hücre ve doku tiplerini floresan olarak etiketlemede rol aldığı düşünülen genleri test etmek için de çok sayıda UAS hattı oluşturulmuştur (Tablo 1). Yanıtlayıcı hatlar için, transjenin raya yönelik entegrasyonu, UAS tarafından düzenlenen genlerin genomik bağlamını düzeltmek için ΦC31 katalze rekombinasyon kaseti değişimi17,18 tarafından gerçekleştirilir. Bu şekilde, transgene ekspresyonu genomik ekleme konumu ile ilgili olarak normalleştirilerek farklı aday genlerin fenotipik etkilerinin daha doğru karşılaştırılmasına olanak sağlar.
Bugüne kadar oluşturulan yanıtlayıcı çizgiler, transjeni yüksek seviyelerde ifade etmek veya RNA paraziti (RNAi) yoluyla gen ekspresyonını azaltmak için tasarlanmıştır. Genellikle cDNA klonları uygun ekspresyon plazmidleri oluşturmak için UAS dizisine kaynaşır, ancak tam genomik diziler klonlama için çok büyük olmadıkları varsayılarak da mümkündür. Susturma yapıları oluşturmak için, RNAi’yi uyaran saç tokası dsRNA’yı oluşturan uygun tandem ters diziler elde etmek için üç farklı yöntem kullandık. Bunlar arasında füzyon PCR, asimetrik PCR ve saç tokası yapılarının ticari sentezi yer alıp almamaktadır. Her yöntem için ortak, klonlama kararlılığı sağlamak için ters diziler arasında bir intron dizisinin dahil edilmesidir. İlgi/RNAi yapısı geninin yerleştirilebileceği yanıtlayıcı plazmidler geliştirilmiştir15. Bu plazmidler ayrıca RMCE için gerekli ΦC31 attB sitelerini de taşır (RCME tekniğini ayrıntılı olarak açıklayan Adolfi eşlik eden JoVE kağıdında açıklanmıştır). Bu makaleye, aşırı ifade için bu plazmidlerden birine ekleme sırası seçilirken gereken önemli adımları kapsayan protokoller yer almaktadır. Ayrıca, RNAi saç tokası yapı oluşturma için iki protokol açıklanmış ve gösterilmiştir.
Yeni çizgiler oluştururken, nadir transgenik bireylerin tanımlanması, transgenik koloniler kurmak ve sürdürmek için üremek için çok önemlidir. Gal4-UAS sistemi için en önemlisi, çaprazlar oluşturmak ve her iki transjeni taşıyan bireysel soyları tanımlamak için yanıtlayıcı ve sürücü hatlarını ayırt etmek bir gerekliliktir. Bu, sürücü ve yanıtlayıcı kasetlere bağlı farklı baskın seçilebilir işaretleyici genleri kullanılarak elde edilir. En yaygın olarak bunlar optik filtreler (örneğin, eYFP, eCFP, dsRed) kullanılarak açıkça ayırt edilebilen floresan işaret genleridir. Anormalliklerin ve kontaminasyonun tanımlanmasının kolay hale getirdiğinden, belirteçlerin bilinen ve güvenilir bir mekansal desende ifade olması önemlidir. Floresan belirteç gen ekspresyumu, An. gambiae gelişiminin tüm aşamalarında göz ve ventral gangliyon spesifik ifadeye neden olan sentetik 3xP3 promotörü tarafından rutin olarak düzenlenir19. 3xP3 tarafından kontrol edilen floresan belirteçler, bu makalede açıklanan tüm dönüşüm plazmidlerine dahildir. Floresan An. gambiae pupa gal4-UAS hatlarını taramak için kullanılan yaygın yöntemleri ayrıntılı olarak açıklayan bir protokol burada yer almaktadır.
GAL4-UAS sisteminin temel unsurlarından biri, farklı şekilde işaretlenmiş sürücü ve yanıtlayıcı hatlarını geçme zorunluluğudur. Bunu yapmak için her satırdan erkek ve dişi çiftleşmeden önce ayrılmalıdır. Yetişkinler göz göre göre kolayca ayırt edilebilir, ancak genetik haçlar oluşturmak için çiftleşmenin gerçekleşmemesini sağlamak için yetişkin ortaya çıkmasından önce cinsiyetleri ayırmak mantıklıdır. Erkek ve dişi An. gambiae pupa arasındaki genel boyut farkı, etkili ve güvenilir bir cinsiyet belirleme yöntemi olamayacak kadar değişkendir20. Bunun yerine dış cinsel organdaki açık morfolojik farklılıklar , An. gambiae’de seks için güvenilir bir temel sağlar. Bu yazıda, uygun haçları kurmak için An. gambiae pupaları seks yapmak için güvenilir bir yöntem açıklıyoruz.
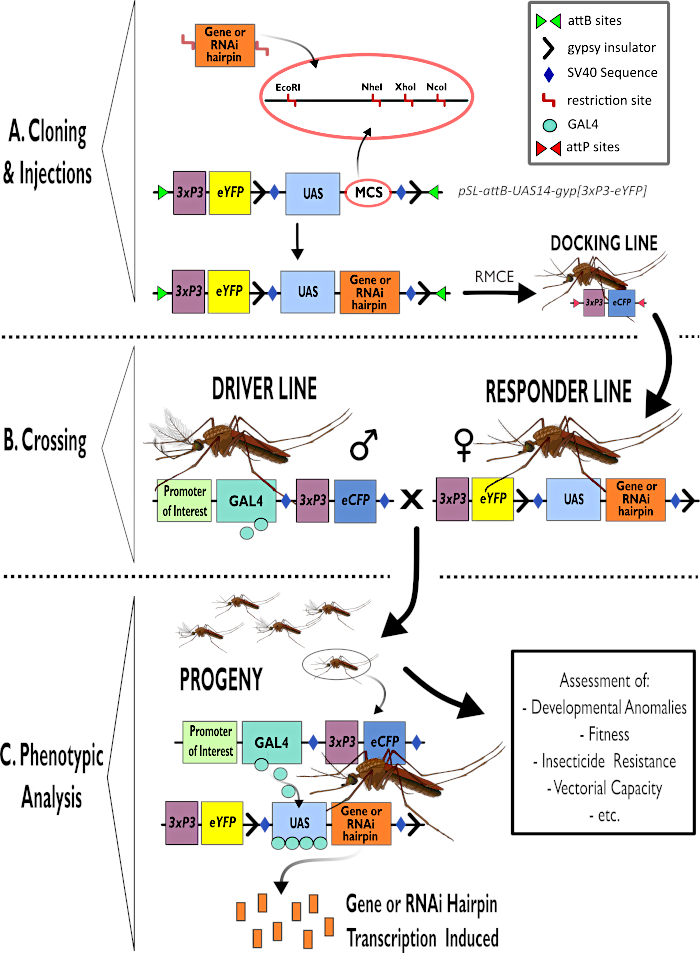
Şekil 1 – Anopheles gambiae’de bipartit GAL4-UAS Sisteminin kullanımına yönelik sürecin şemamatik gösterimi. (A) Örnek bir vektörün ana bileşenleri (pSL-attB-UAS14-gyp[3xp3-eYFP]), ilgi çekici gen için saç tokası yapısı veya kodlama sırası eklemek için kullanıma uygun çoklu klonlama siteleri içindeki mevcut kısıtlama sitelerini (EcoRI, NheI, XhoI ve NcoI) ayrıntılı olarak açıklar. Yanaşma hattının yapısı da tasvir edilir. (B) Geçiş adımı, sürücü hattından erkeklerin (GAL4 sürücüsünü 3xP3 promotörü tarafından yönlendirilen bir ilgi verici ve eCFP tarafından taşıyan) ve yanıtlayıcı çizgiden kadınların (bir UAS promotörü ve 3xP3 promotörü tarafından kontrol edilen bir eYFP işaretleyicisi tarafından kontrol edilen ilgi genini veya saç tokası yapısını taşıyan) kullanımını göstermektedir. (C) GAL4’ün B’deki haçın soyuna ilgi geninin itici ifadesinin diyagramsal bir gösterimi ve değerlendirilen tipik fenotiplerden bazılarının bir listesi. Kısaltmalar: Çoklu Klonlama Bölgesi (MCS), Rekombinoz aracılı kaset değişimi (RMCE), Upstream Aktivatör Sırası (UAS), gelişmiş sarı floresan protein (eYFP), gelişmiş siyan floresan protein (eCFP). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Daha doğrusal yaklaşımlara göre belirgin avantajlara sahip olan GAL4-UAS sisteminin iki partili doğasını sağlayan haçların kullanılmasıdır. Örneğin, her promotör/gen kombinasyonu için yeni bir transgenik hat oluşturulması ve sürdürülmesi gerekiyorsa, sürücü ve yanıtlayıcı hatlarının birçok kombinasyonu uygulanabilir olacaktır. Daha da önemlisi, doğrusal bir sistemde oluşturulması/sürdürülmesi zor olan ifadeleri bozunduğunda ölümcül veya steril fenotip üreten genlerin analizine izin verir. Bu tür ölümcül fenotipler, gen fonksiyonuna ve mekansal ifadeye bağlı olarak tüm gelişim aşamalarında ortaya çıkabilir, ancak en sık embriyonik gelişim sırasında gözlenir. Sivrisinek embriyo gelişimini görselleştirmek, yumurtaları kaplayan opak koronun temizlenmesini gerektirir. Trpiš (1970)21 ve Kaiser ve ark. (2014)22’de açıklanan yöntemleri izleyerek, yapısal bütünlüğü korurken embriyoları düzeltmek için kullandığımız protokolleri ve mikroskobik görselleştirme ve görüntülemeye izin veren endochorion’u temizlemek için ağartmamızı açıklıyoruz.
Protocol
Representative Results
Discussion
Sivrisinek gen fonksiyonunu anlamak, Anopheles’i kontrol etmek ve sıtma bulaşmasını etkilemek için yeni yaklaşımlar geliştirmek için hayati öneme sahiptir. Açıklanan GAL4-UAS sistemi, aday genlerin fonksiyonel analizi için çok yönlü ve güçlü bir sistemdir ve bugüne kadar sistemi insektisit direncinin genetik temelini incelemek için kullandık17 ve cutiküler hidrokarbon üretimi15,23, ayrıca farklı sivrisine…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Tekliflere Gal4UAS analizini dahil eden LSTM ve IVCC (Adriana Adolfi), BBSRC (Yeni Araştırmacı Ödülü (AL), MRC (BCP’ye doktora öğrenciliği:MR/P016197/1), Wellcome (Sir Henry Wellcome Doktora Sonrası LG: 215894/Z/19/Z) tarafından finanse edildiğini memnuniyetle kabul ediyoruz.
Materials
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
Riferimenti
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist’s swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O’Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. Genetica. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. Genetica. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Biologia dello sviluppo. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).

