Structuur-functie studies in muis embryonale stamcellen gebruiken recombinase-gemedieerde cassette uitwisseling
Summary
Eiwitten vaak meerdere domeinen die verschillende cellulaire functies kunnen uitoefenen. Gene knock-outs (KO) beschouw dit niet als functionele diversiteit. Hier melden wij een recombinatie-gemedieerde cassette uitwisseling (RMCE) gebaseerde structuur-functie benadering KO embryonale stamcellen waarmee de moleculaire dissectie van verschillende functionele domeinen of varianten van een eiwit.
Abstract
Genmanipulatie in muizenembryo's of embryonale stamcellen (mESCs) maakt voor de studie van de functie van een bepaald eiwit. Eiwitten zijn de werkpaarden van de cel en vaak uit meerdere functionele domeinen, die kan worden beïnvloed door posttranslationele modificaties. De uitputting van het gehele eiwit in conditionele of constitutief knock-out (KO) muizen geen rekening houden met deze functionele diversiteit en regelgeving. Een mES lijn en een afgeleide muismodel, waarbij een docking site voor FLPe-recombinatie gemedieerde cassette uitwisseling (RMCE) binnen de ROSA26 (R26) locus was ingebracht, werd eerder beschreven. Hier doen we verslag van een structuur-functie benadering die het mogelijk maakt voor de moleculaire dissectie van de verschillende functionaliteiten van een multidomein eiwit. Daartoe moet RMCE compatibele muizen worden gekruist met KO muizen en RMCE-compatibele KO mESCs moeten worden geïsoleerd. Vervolgens kan een panel van vermeende redding constructen worden geïntroduceerd in de R26 locus via RMCE targeting. De kandidaat rescue cDNAs kunnen gemakkelijk ingebracht tussen RMCE plaatsen van de richtende vector door middel van recombinatie klonering. Vervolgens worden KO mESCs getransfecteerd met het richtende vector in combinatie met een FLPe recombinase expressieplasmide. RMCE reactiveert het promoter-loze neomycine-resistentiegen in het ROSA26 aanlegplaatsen en maakt de keuze van de juiste targeting. Daardoor worden hoge targeting efficiëntie bijna 100% verkregen, waardoor het inbrengen van meerdere mogelijke redding constructen in een semi-high throughput manier. Tenslotte kan een veelvoud van R26-aangedreven rescue constructen worden getest op hun vermogen om het fenotype dat waargenomen ouderlijke KO mESCs redden. We presenteren een proof-of-principle structuur-functie studie p120 catenine (p120ctn) KO mESCs behulp endoderm differentiatie embryo lichamen (EB's) als fenotypische uitlezing. Deze benadering maakt de identificatie van belangrijke domeinen vermoedelijke stroomafwaartse routes en ziekte-relevante gegevensmutaties die KO fenotypes voor een bepaald eiwit ten grondslag liggen.
Introduction
Geschat wordt dat zoogdieren genomen bevatten ongeveer 20.000 eiwitcoderende genen. Alternatief splitsen en posttranslationele modificaties verder te verhogen het eiwit repertoire. Eiwitten een modulaire constructie 1 en bevatten vaak meerdere interactie-domeinen, waardoor hun rekrutering in verschillende eiwitcomplexen en hun deelname aan verschillende celprocessen 2 mogelijk. Een voorbeeld is de multifunctionele eiwit genaamd p120ctn. p120ctn wordt gecodeerd door het gen Ctnnd1 en bestaat uit een groot centraal armadillo herhalende domein geflankeerd door een N-terminale en C-terminale gebied. De armadillo domein van p120ctn bindt aan een sterk geconserveerd juxtamembraandomein klassieke cadherinen, die betrokken zijn bij cel-cel adhesie, maar bindt ook aan de transcriptionele repressor Kaiso. Het N-terminale domein van p120ctn interageert met andere kinasen, fosfatasen, kleine RhoGTPases en microtubule geassocieerde pProteins 3. Interessant is dat als gevolg van alternatieve splicing, p120ctn isovormen kunnen worden gegenereerd uit vier alternatieve startcodons 4. p120ctn isovorm 1A is het langst, zoals vertaald vanaf de meest 5' startcodon en bevat de volledige lengte N-eindstandige segment. In p120ctn isovormen 3 en 4, wordt dit N-eindstandige segment gedeeltelijk en volledig respectievelijk verwijderd. Inzicht in de precieze rol van eiwitten (of eiwit isovormen) en hun domeinen in verschillende cellulaire functies blijft een uitdaging.
Gen-targeting in mESCs maakt het bestuderen van de functie van een proteïne door genetische deletie van het overeenkomstige gen en heeft een grote bijdrage tot de identificatie van ontwikkelings belangrijk en ziekte-relevante genen en pathways. Deze doorbraak in reverse genetics was het gevolg van de ontwikkelingen op het gebied van mES isolatie en gene targeting als gevolg van homologe recombinatie 5 </sup>. Homologe recombinatie is een werkwijze waarbij DNA-fragmenten worden uitgewisseld tussen twee gelijkaardige of identieke nucle- resten na dubbelstrengs (ds) DNA-breuken. Normaal gesproken, HR is inefficiënt omdat dsDNA pauzes zijn zeldzaam. Onlangs zou de efficiëntie van homologie gerichte gerichte mutagenese worden verhoogd middels plaatsspecifieke nucleasen 6, 7, maar helaas zijn deze gevoelig voor off-doeleffecten 8. Een meer betrouwbare techniek voor gen targeting inschakelen is RMCE, die gebaseerd is op plaatsspecifieke recombinatie systeem zoals Cre / loxP of FLPe / Frt. LoxP en Frt sequentie in bacteriofaag P1 en Saccharomyces cerevisiae, respectievelijk, en bestaan uit 34 bp, waaronder een asymmetrische 8 bp sequentie die de oriëntatie van de site bepaalt. Anderzijds de oriëntatie van, bijvoorbeeld twee loxP plaatsen in de DNA strook bepaalt of de floxed DNA wordt uitgesneden of inversed upon Cre gemedieerde recombinatie 9. Bovendien kan Cre ook translocatie induceert wanneer twee plaatsen zich op verschillende chromosomen. RMCE maakt hiervan heterospecifiek recombinatie locaties die niet kruisreageren en die zijn ingebed in een genomische locus. In aanwezigheid van een donor plasmide dat een DNA-fragment geflankeerd door dezelfde heterospecifiek plaatsen bevat, zal de recombinase dit DNA-fragment in te voegen in de RMCE-compatibele genomische locus verdubbelen als gevolg van gelijktijdige translocatie (figuur 1). Hier kunnen alleen correct RMCE gerichte klonen render geneesmiddelresistentie door een promotor van de inkomende vector die herstelt een "gevangen" promoter-less neomycine resistentiegen (neo R) in de R26 genoom van het docking cellen (figuur 1) 10, 11. Dit resulteert in een zeer hoge targeting efficiency, vaak in de buurt van 100% 11, </ sup> 12. Concluderend-RMCE gebaseerde targeting is zeer efficiënt en kan worden gebruikt voor structuur-functie studies; echter, het vereist een prefab genomische locus.
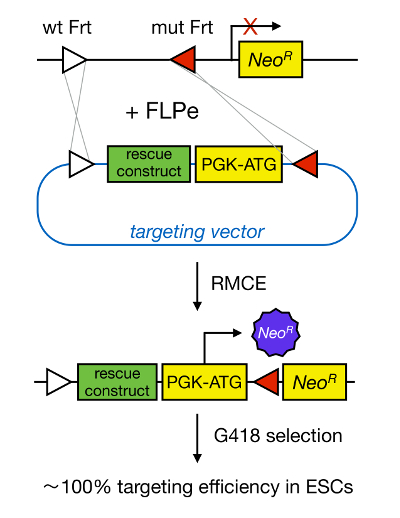
Figuur 1. Schematische weergave van RMCE-gemedieerde targeting. RMCE maakt de uitwisseling van DNA-segmenten uit een inkomend richtende vector op een bepaalde genomische locus als zowel haven heterospecifiek twee FRT-plaatsen (aangegeven door witte en rode driehoekjes). Bovendien, de gemanipuleerde genome locus bevat een promoter en afgeknot neomycine-resistentie (Neo R) gen. Door een promoter en startcodon in het inkomende DNA-fragment, enige juiste recombinatiegebeurtenissen herstellen neomycine resistentie, wat resulteert in hoge rendementen targeting. Klik hier om een grotere versie van t bekijkenzijn figuur.
Genome Engineering in mESCs maakt het mogelijk om het genereren van RMCE-compatibele muizen. In 1981, twee slaagden in het vastleggen van pluripotente cellen van de binnenste celmassa (ICM) van blastocysten en het handhaven in kweek 13, 14. mESCs in staat zijn zelfvernieuwing en differentiatie tot alle embryonale en volwassen cellen, inclusief de geslachtscellen-cellijn. Daarom gen-targeting in mESCs maakt reverse genetische studies door de ontwikkeling van constitutieve of voorwaardelijke (via het Cre / loxP systeem) KO muizen. Echter, de klassieke manier om de muis ES-cellen te isoleren is zeer inefficiënt. Aantal belangrijke verbeteringen sterk verhoogd succes voor het afleiden mES lijnen, inclusief het gebruik van een bepaald serum-vervanging (SR) -medium 15, afwisselend mES medium met SR en foetaal runderserum (FBS) 16 en het gebruik farmacologische verbindingen zoals pluripotin of 17 2i. Pluripotin, een klein synthetisch molecuul, maakt de voortplanting van mESCs in een ongedifferentieerde toestand bij afwezigheid van leukemie remmende factor (LIF) en muis embryonale fibroblasten (MEF) 18. Tenslotte is aangetoond dat mESCs kan worden geïsoleerd met een zeer hoog rendement (bijna 100%) wanneer een SR / FBS medium afwisseling protocol wordt gecombineerd met LIF en pluripotin 19, 20. Deze protocollen maken de efficiënte isolatie van RMCE-compatibele KO mESCs die vervolgens kunnen worden gebruikt voor structuur-functie studies.
Dit artikel beschrijft een werkwijze die het mogelijk maakt om de belangrijkste domeinen of resten te identificeren in een eiwit dat verantwoordelijk is voor specifieke cellulaire processen. Te dien einde, een pijpleiding van geavanceerde technologieën die het mogelijk maken een efficiënte mES isolatie, targeting vector assemblage en mES targeting was creërend. Als zodanig grote panelen met eiwit isovormen, domain mutanten en downstream effectoren in KO mESCs kan worden ingevoerd en kan worden geëvalueerd op hun vermogen om de in vitro KO fenotype te redden.
Protocol
Representative Results
Discussion
Onze mES isolatie methode is gebruiksvriendelijk en vereist geen geavanceerde vaardigheden of apparatuur, zoals microchirurgie van blastocysten. Zo, deze technologie is toegankelijk voor een groot deel van de wetenschappelijke gemeenschap. Iedereen met basic celkweek ervaring kan voortplanten ICM uitwassen en stellen mESCs lijnen. Echter, de spoelen en de behandeling van blastocysten enige oefening vereist. Een mond pipet wordt gebruikt om blastocysten overdracht en bestaat uit een micropipet, een micropipet houder, sla…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wij danken Jinke D'Hont, Frederique Van Rockeghem, Natalie Farla, Kelly Lemeire en Riet De Rycke voor hun uitstekende technische ondersteuning. We danken ook Eef Parthoens, Evelien Van Hamme, en Amanda Goncalves uit de bio-imaging Core Facility van de Ontsteking Onderzoekscentrum voor hun deskundige hulp. Wij erkennen de leden van onze onderzoeksgroep voor waardevolle discussies. Dit werk werd ondersteund door het Federaal Wetenschapsbeleid (Belspo Interuniversitaire attractiepolen – Award IAP VII-07 DevRepair; https://devrepair.be), door de Geneeskundige Stichting Koningin Elisabeth, België (GSKE 2008-2010; http: // www .fmre-gske.be), en door de gecoördineerde Research Actions (GOA 01G01908) van de Universiteit Gent, België (http://www.ugent.be/en/ghentuniv). SG is een postdoctoraal onderzoeker van het Flanders Research Funds (FWO-V).
Materials
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20°C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23G needles | Fine-ject | 8697 | |
| 1-ml syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 ml distilled water, autoclave and store at 4°C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment: | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 ml, 10 ml and 25 ml | |||
| 15-ml and 50-ml conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μl) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37°C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media: | |||
| MEF Medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| SR-based mESC medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR ) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/ml recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium): | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4°C; warm 30 min at 37°C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/ml ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
References
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1 (2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243 (2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55 (2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).

