מחקרי מבנה-תפקוד תאי גזע עוברי עכבר שימוש recombinase בתיווך Exchange קסטה
Summary
חלבונים בדרך כלל מכילים מספר תחומים שיכולים להפעיל פונקציות סלולריות שונות. ג'ין לדפוק-outs (KO) לא מחשיב מגוון תפקודי זו. כאן, אנו מדווחים חילופי קלטת בתיווך רקומבינציה (RMCE) גישת מבנה-תפקוד מבוסס בתאי גזע עוברי KO המאפשרת דיסקציה המולקולרי של תחומים או הגירסות פונקציונליים השונים של חלבון.
Abstract
הנדסת גנים עוברים עכברים או תאי גזע עובריים (mESCs) מאפשרת לחקר הפונקציה של חלבון נתון. חלבונים הם סוסי העבודה של התא ולעתים קרובות כוללים תחומים פונקציונליים מרובים, אשר יכול להיות מושפע שינויים posttranslational. הדלדול של החלבון השלם עכברים מותנה או מכונן נוק-אאוט (KO) אינו לוקח בחשבון זה גיוון תקנה פונקציונלי. קו המסקלין במודל עכברי נגזר, שבו אתר עגינה עבור חילופי קלטת בתיווך רקומבינציה FLPe (RMCE) הוכנס בתוך הלוקוס ROSA26 (R26), דווחו בעבר. כאן, אנו מדווחים על גישת מבנה-תפקוד המאפשרת דיסקציה מולקולרי של הפונקציות השונות של חלבון multidomain. לשם כך, העכברים RMCE תואם חייב להיות חצה עם עכברים KO ואז mESCs RMCE תואם KO חייב להיות מבודד. הבא, פנל של מבני הצלה משוערים יכול להיות מוחדר לוקוס R26 באמצעות RMCE targeting. CDNAs הצלת המועמד ניתן להוסיף בקלות בין אתרי RMCE של וקטור המיקוד באמצעות שיבוט רקומבינציה. הבא, mESCs KO הם transfected עם וקטור מיקוד בשילוב עם פלסמיד ביטוי recombinase FLPe. RMCE reactivates גן neomycin-התנגדות פחות האמרגן של אתרי עגינת ROSA26 ומאפשר את הבחירה של אירוע הנכון למיקוד. בדרך זו, התייעלות מיקוד גבוה קרובה 100% מתקבלות, המאפשרת החדרה של מבני הצלה משוערים מרובים באופן תפוקה למחצה גבוה. לבסוף, מספר רב של מבני הצלת מונחת R26 יכול להיבדק על יכולת להציל את הפנוטיפ כי נצפה mESCs הורית KO. אנו מציגים מחקר הוכחה של עקרון מבנה-תפקוד ב קטנין P120 (p120ctn) mESCs KO באמצעות בידול endoderm ב גופים embryoid (EBS) כמו את ההודעה פנוטיפי. גישה זו מאפשרת זיהוי של תחומים חשובים, מסלולים במורד משוערים, ונקודת מחלה רלוונטיתמוטציות העומדים בבסיס פנוטיפים KO עבור חלבון נתון.
Introduction
הערכה היא כי הגנום יונק מכיל כ 20,000 גנים המקודדים לחלבונים. שחבור אלטרנטיבי ושינויי posttranslational להגביר עוד יותר את רפרטואר החלבון. יש חלבוני מבנה מודולרי 1 ולעתים קרובות מכילים תחומי אינטראקציה מרובים, המאפשרים הגיוס שלהם לתוך מתחמי חלבון שונים השתתפותם תהליכים תאיים רבים 2. דוגמה אחת היא חלבון רב תפקודי הנקרא p120ctn. p120ctn מקודד על ידי הגן Ctnnd1 ו מורכב מתחום חוזרים ארמדיל מרכזי גדול ולצידו ידי N-מסוף אזור הטרמינל-C. התחום ארמדיל של p120ctn נקשר לתחום juxtamembrane השמור ביותר של cadherins הקלסית, אשר מעורבים תאי תאי הידבקות, אבל זה גם נקשר מדכא תעתיק Kaiso. התחום מסוף-N של p120ctn אינטראקציה עם קינאזות שונות, phosphatases, RhoGTPases קטן, ו- p-מזוהה microtubuleroteins 3. מעניין, כתוצאה של שחבור חלופי, isoforms p120ctn ניתן להפיק ארבעה קודונים התחלה חלופה 4. 1A איזופורם p120ctn הוא הארוך ביותר, כפי שהוא מתורגם מן-5 ביותר להתחיל קודון ומכיל קטע באורך מלא N-terminal. בשנת p120ctn isoforms 3 ו 4, זה קטע N-terminal נמחק חלקית לחלוטין, בהתאמה. הבנת התפקיד המדויק של חלבונים (או isoforms חלבון) ועל התחומים שלהם פונקציות סלולריות שונות עדיין מהווה אתגר.
ג'ין מיקוד mESCs מאפשר הלימוד של הפונקציה של חלבון דרך המחיקה הגנטית של הגן המתאים ואת תרם רב לזיהוי גנים ושבילים התפתחותית חשובים ומחל-רלוונטיות. זו פריצת דרך גנטיקה הפוכה הייתה התוצאה של התקדמות בתחומי בידוד המסקלין ואת גן המיקוד בשל הומולוגי 5 </sעד>. הומולוגיים הוא תהליך שבו שברי DNA הם החליפו בין שני moieties גרעין דומה או זהה לאחר הפסקות פעמיים גדילי דנ"א (DS). בדרך כלל, HR אינו יעיל משום הפסקות dsDNA הן נדירות. לאחרונה, את היעילות של גנים בבימויו הומולוגית מיקוד יכולה להיות מוגברת באמצעות nucleases ספציפי באתר 6, 7, אבל לצערי, אלה נוטים השפעות חוץ-יעד 8. טכניקה אמינה יותר כדי לאפשר גן המיקוד הוא RMCE, אשר מבוססת על מערכות רקומבינציה ספציפי באתר כגון Cre / loxP או FLPe / FRT. LoxP ורצף FRT נמצאים P1 בקטריופאג ו שמר האפייה, בהתאמה, וכוללת 34 נ"ב, כולל רצף BP אסימטרי 8 הקובע את הכיוון של האתר. מצד השני, את הכיוון של, למשל, שני אתרי loxP בתוך מתיחת DNA יקבעו אם הדנ"א floxed הופך ניכר או inversed על רקומבינציה 9 בתיווך Cre. יתר על כן, Cre יכול גם לגרום טרנסלוקציה אם שני האתרים נמצאים על כרומוזומים שונים. RMCE מנצל אתרי רקומבינציה heterospecific כי לא צולב להגיב וכי מוטבעי מוקד הגנומי. בנוכחות פלסמיד התורם המכיל קטע DNA מוקף באותם אתרים heterospecific, את recombinase יוסיף קטע DNA הזה לתוך לוקוס גנומית תואם RMCE בגלל טרנסלוקציה פעמיים סימולטני (איור 1). הנה, רק בצורה הנכונה RMCE במיקוד שיבוטים יכולים לעבד בזכות עמידות לתרופות אמרגן על הווקטור נכנס כי משחזר "לכודים" גני אמרגן-פחות התנגדות neomycin (ניאו R) הנוכחים בגנום R26 של תאי העגינה (איור 1) 10, 11. התוצאה היא יעילות מיקוד גבוהה מאוד, לעתים קרובות קרובה 100% 11, </ sup> 12. לסיכום, מיקוד מבוסס RMCE הוא יעיל ביותר וניתן להשתמש בו ללימודים-פונקציות מבנה; עם זאת, זה דורש מוקד הגנומי טרום מהונדס.
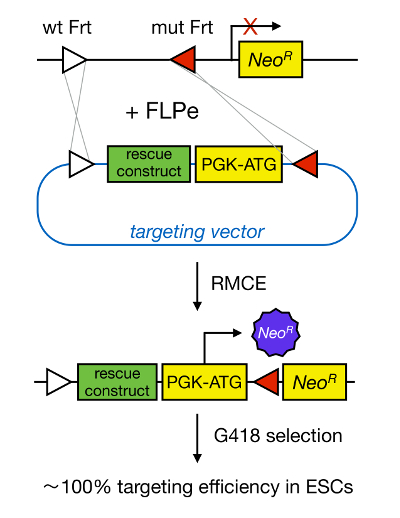
איור 1. ייצוג סכמטי של מיקוד בתיווך RMCE. RMCE מאפשר החלפת מקטעי דנ"א מתוך וקטור מיקוד הנכנסת מוקד הגנומי מוגדר אם הן נמל שני אתרי FRT heterospecific (מתואר על ידי משולשים לבנים ואדומים). בנוסף, לוקוס גנומי מהונדסים מכיל promoterless ו-התנגדות neomycin קטועה גן (ניאו R). על ידי מתן מקדם ולהתחיל קודון של קטע DNA נכנס, רק אירועי רקומבינציה נכונים לשחזר התנגדות neomycin, וכתוצאה מכך יעיל מיקוד גבוה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של tהדמות שלו.
הנדסת הגנום ב mESCs מאפשרת לדור של עכברים תואמים RMCE. בשנת 1981, שתי הקבוצות הצליחו ללכוד תאים פלוריפוטנטיים ממסת התאים הפנימית (ICM) של blastocysts ובשמירה עליהם בתרבות 13, 14. mESCs מסוגל התחדשות עצמית והבחן לתוך כל סוגי תאים עובריים מבוגרים, כולל שושלת התא הניבט. לכן, גן מיקוד mESCs מאפשר לימודים הפוכים-גנטיים באמצעות הפיתוח של מכונן או מותנים (באמצעות מערכת Cre / LoxP) עכברי KO. עם זאת, הדרך הקלאסית לבודד תאי עכבר ES הוא מאוד לא יעיל. שיפורים מרכזיים הגדילו את שיעור ההצלחה מאוד עבור קווי המסקלין נובעים, כוללים השימוש בסרום-החלפה מוגדרת (SR) בינונית 15, לסירוגין בין מדיום המסקלין המכיל סרום שור SR ו עוברי (FBS) 16, ושימוש pharmacoתרכובות לוגיות כגון pluripotin או 2i 17. Pluripotin, מולקולה סינתטית קטנה, מאפשר התפשטות של mESCs במצב מובחן בהעדר גורם מעכבות לוקמיה (LIF) ו פיברובלסטים עובריים בעכבר (MEFs) 18. לבסוף, הוכח כי ניתן לבודד mESCs עם יעילות גבוהה מאוד (קרוב ל 100%), כאשר פרוטוקול ההתחלפות בינוני SR / FBS משולב עם LIF ו pluripotin 19, 20. פרוטוקולים אלה מאפשרים בידוד יעיל של mESCs RMCE תואם KO שיכולים לשמש בהמשך למחקרים מבנה-תפקוד.
מאמר זה מתאר שיטה המאפשרת אחד כדי לזהות את התחומים או שאריות המפתח בתוך חלבון כי הם אחראים על תהליכים תאיים ספציפיים. לשם כך, צנרת של טכנולוגיות מתקדמות המאפשרות בידוד המסקלין יעיל, הרכבת וקטור מיקוד, מיקוד המסקלין הייתה ליצורד. כמו לוחות כאלה, גדולים עם isoforms חלבון, מוטציות תחום ומפעילים במורד הזרם יכול להיות הציג mESCs KO וניתן להעריך את יכולתם להציל את הפנוטיפ KO חוץ גופית.
Protocol
Representative Results
Discussion
שיטת הבידוד המסקלין שלנו הוא ידידותי למשתמש ואינו דורש מיומנויות מתקדמות או ציוד, כגון מיקרו-של blastocysts. לפיכך, הטכנולוגיה הזו נגישה חלק גדול מהקהילה המדעית. כל מי שיש לו ניסיון תרבית תאים בסיסי יכול להפיץ בצמחי ICM ולהקים קווי mESCs. עם זאת, שטיפה וטיפול של blastocysts דורש קצת ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מודים Jinke D'Hont, פרדריק ואן Rockeghem, נטלי Farla, קלי Lemeire, ו Riet דה Rycke לקבלת תמיכה טכנית מעולה שלהם. אנו מודים גם Eef Parthoens, Evelien ואן Hamme, ואמנדה גונסאלביס ממתקן Core bioimaging של מרכז המחקר דלקת לסיוע המומחה שלהם. אנו מודים לחברי קבוצת המחקר שלנו לדיונים חשובים. עבודה זו נתמכה על ידי מדיניות המדע הבלגית (פולני אטרקציה הבינאוניברסיטאי Belspo – פרס IAP VII-07 DevRepair; https://devrepair.be), על ידי הקרן הרפואית המלכה אליזבת, בלגיה (GSKE 2008-2010; http: // www .fmre-gske.be), ועל ידי פעולות מחקר מתואמת (GOA 01G01908) של גנט האוניברסיטה, בלגיה (http://www.ugent.be/en/ghentuniv). SG הוא עמית פוסט של קרנות מחקר פלנדריה (FWO-V).
Materials
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20°C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23G needles | Fine-ject | 8697 | |
| 1-ml syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 ml distilled water, autoclave and store at 4°C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment: | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 ml, 10 ml and 25 ml | |||
| 15-ml and 50-ml conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μl) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37°C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media: | |||
| MEF Medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| SR-based mESC medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR ) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/ml recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium): | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4°C; warm 30 min at 37°C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/ml ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
References
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1 (2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243 (2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55 (2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).

