Struktur-Funktions-Studien in embryonalen Maus-Stammzellen Rekombinase-vermittelten Kassettenaustausch
Summary
Proteine enthalten oft mehrere Domänen, die verschiedene zelluläre Funktionen ausüben kann. Gen-Knock-outs (KO) nicht über diese funktionelle Vielfalt berücksichtigen. Hier berichten wir über eine Rekombination vermittelten Kassettenaustausch (RMCE) -basierte Struktur-Funktions-Ansatz in KO embryonalen Stammzellen, die für die molekulare Präparation von verschiedenen funktionellen Domänen oder Varianten eines Proteins ermöglicht.
Abstract
Gentechnik in Maus-Embryonen oder embryonale Stammzellen (mESCs) ermöglicht die Untersuchung der Funktion eines bestimmten Proteins. Proteine sind die Arbeitspferde der Zelle und bestehen oft aus mehreren funktionellen Domänen, die durch posttranslationale Modifikationen beeinflusst werden kann. Die Verarmung des gesamten Proteins in bedingten oder konstitutiv Knock-out (KO) Mäusen nimmt nicht berücksichtigt diese funktionale Vielfalt und Regulierung. Eine MESC Linie und ein abgeleitetes Mausmodell, in dem eine Andockstelle für FLPe Rekombination vermittelten Kassettenaustausch (RMCE) innerhalb des ROSA26 (R26) Locus eingefügt wurde, wurde bereits berichtet. Hier berichten wir über eine Struktur-Funktions-Ansatz, der für die molekulare Zerlegung der verschiedenen Funktionalitäten eines Multi-Domain Protein ermöglicht. Zu diesem Zweck RMCE-kompatible Mäuse müssen mit KO-Mäusen gekreuzt werden und dann RMCE-kompatibel KO mESCs isoliert werden müssen. Als nächstes kann ein Panel von putativen rescue-Konstrukten in die R26-Locus über RMCE targeti eingeführt werdenng. Die Kandidaten rescue cDNAs kann leicht zwischen RMCE Seiten des Targeting-Vektors unter Verwendung von Rekombinations-Klonierung eingefügt werden. Als nächstes wird KO mESCs mit dem Targeting-Vektor in Kombination transfiziert mit einer FLPe Rekombinase Expressionsplasmid. RMCE reaktiviert die promotorlose Neomycin-Resistenz-Gene in den ROSA26 Andockstellen und ermöglicht die Auswahl des korrekten Targeting-Ereignisses. Auf diese Weise werden hohe Wirkungsgrad Targeting von nahezu 100% erzielt, so dass zum Einsetzen mehrerer putativen rescue Konstrukte in eine halb-hohen Durchsatz Weise. Schließlich kann eine Vielzahl von R26 getriebenen Rettungs Konstrukte auf ihre Fähigkeit getestet werden, um den Phänotyp zu retten, die in Eltern KO mESCs beobachtet wurde. Wir präsentieren eine Proof-of-Principle-Struktur-Wirkungs-Studie in p120 Catenin (p120ctn) KO mESCs mit endoderm Differenzierung in Embryoidkörpern (EVG) als phänotypische Anzeige. Dieser Ansatz ermöglicht die Identifizierung von wichtigen Domänen, putative nachgeschaltete Wege und krankheitsrelevanten PunktMutationen, die KO-Phänotypen für ein bestimmtes Protein zu Grunde liegt.
Introduction
Es wird geschätzt, dass etwa 20.000 Säugergenomen Protein-kodierenden Gene enthalten. Alternatives Spleißen und posttranslationale Modifikationen erhöhen die Proteinrepertoires. Proteine haben einen modularen Aufbau 1 und häufig mehrere Wechselwirkungsdomänen enthalten, die ihre Einstellung 2 in verschiedene Proteinkomplexe und ihre Beteiligung an mehreren zellulären Prozesse ermöglichen. Ein Beispiel dafür ist das multifunktionale Protein namens p120ctn. p120ctn wird durch das CTNND1 Gen codiert und besteht aus einer großen zentralen Domäne Armadillo – Repeat flankiert von einem N-terminalen und C-terminalen Region. Die Armadillo-Domäne von p120ctn bindet an eine hoch konservierten Juxtamembrandomäne der klassischen Cadherine, die in Zell-Zell-Adhäsion beteiligt sind, aber es bindet auch an den Repressor Kaiso. Die N-terminale Domäne von p120ctn interagiert mit verschiedenen Kinasen, Phosphatasen, kleinen RhoGTPasen und Mikrotubuli-assoziierte proteins 3. Interessanterweise als Ergebnis des alternativen Spleißens, p120ctn Isoformen können 4 aus vier alternativen Startcodons erzeugt werden. p120ctn Isoform 1A ist die längste, wie es aus dem am meisten 5' translatiert wird Startcodon und enthält die Volllängen-N-terminales Segment. In p120ctn Isoformen 3 und 4 ist dieses N-terminale Segment teilweise gelöscht und vollständig sind. die genaue Rolle von Proteinen (oder Protein-Isoformen) und die Domänen in verschiedenen zellulären Funktionen zu verstehen, bleibt eine Herausforderung.
Gen-Targeting in mESCs ermöglicht die Untersuchung der Funktion eines Proteins durch die genetische Deletion des entsprechenden Gens und hat weitgehend dazu beigetragen, die Identifizierung von entwicklungs wichtig und krankheitsrelevanten Genen und Wegen. Dieser Durchbruch in der reversen Genetik war das Ergebnis der Fortschritte in den Bereichen der MESC Isolierung und Gene aufgrund homologer Rekombination Targeting 5 </sup>. Homologe Rekombination ist ein Verfahren, bei der DNA-Fragmenten zwischen zwei ähnlichen oder identischen Nukleins Einheiten nach doppelsträngige (ds) DNA-Brüchen ausgetauscht werden. Normalerweise ist HR ineffizient, weil dsDNA Pausen selten sind. Seit kurzem wird die Effizienz der Homologie-directed gene targeting könnte unter Verwendung von ortsspezifischen Nucleasen erhöht 6, 7, aber unglücklicherweise sind diese anfällig für Nebeneffekte 8. Eine zuverlässigere Technik zu ermöglichen, Gen-Targeting ist RMCE, die auf ortsspezifische Rekombinationssysteme, wie Cre / loxP oder FLPe / FRT-basiert. LoxP und Frt – Sequenz werden in Bakteriophage P1 und Saccharomyces cerevisiae, bzw., und aus 34 bp, einschließlich einer asymmetrischen 8 – bp – Sequenz gefunden, die die Orientierung der Website festlegt. Auf der anderen Seite ist die Orientierung von, zum Beispiel, zwei loxP-Stellen innerhalb einer DNA-Strecke werden bestimmen, ob die floxed DNA exzidiert wird oder i9 nversed nach Cre-vermittelter Rekombination. Darüber hinaus kann Cre induziert auch eine Translokation, wenn zwei Standorte auf verschiedene Chromosomen befinden. RMCE nutzt artfremden Rekombinationsstellen, die nicht kreuzreagieren und das in einer genomischen Locus eingebettet sind. In Anwesenheit eines Donator – Plasmid , das ein DNA – Fragment mit den gleichen hetero Stellen flankierte enthält, fügt die Rekombinase dieses DNA – Fragment in den kompatibelen RMCE genomischen Locus durch doppelte versetzte Translokation (Abbildung 1). Hier wird nur richtig RMCE gezielte Klone können drug resistance dank eines Promotors auf dem ankommenden Vektor rendern , die ein „gefangen“ , stellt promotorlose Neomycinresistenzgen (Neo R) in der R26 Genom der Docking – Zellen (Abbildung 1) 10, 11. Daraus ergibt sich eine sehr hohe Targeting Effizienz, oft nahe 100% 11 </ sup> 12. Abschließend ist RMCE basierte Targeting sehr effizient und kann für Struktur-Funktionen Studien verwendet werden; Jedoch erfordert es eine vorgefertigte genomischen Locus.
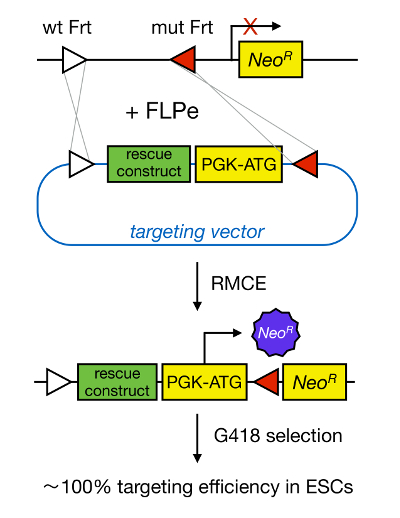
Abbildung 1 : Schematische Darstellung der RMCE Vermittelte Targeting. RMCE ermöglicht den Austausch von DNA-Segmenten aus einem ankommenden Targeting-Vektor zu einem definierten genomischen Locus, wenn sowohl zwei hetero FRT-Stellen Harbor (dargestellt durch weiße und rote Dreiecke). Darüber hinaus enthält das manipulierte genomischen Locus und ein promotorloses Neomycin-Resistenz verkürztes (Neo R) -Gen. Durch die Bereitstellung von Wiederherstellung einen Promotor und Startcodon in dem ankommenden DNA-Fragmente, nur korrekte Rekombinationsereignisse Neomycin-Resistenz, was zu hohen Effizienzen Targeting. Bitte klicken Sie hier , um eine größere Version t anzuzeigenseine Figur.
Genomtechnik in mESCs ermöglicht die Erzeugung von RMCE-kompatible Mäuse. Im Jahr 1981 gelang es zwei Gruppen von pluripotenten Zellen der inneren Zellmasse (ICM) von Blastozysten in Erfassung und in Kultur 13, 14 aufrechtzuerhalten. mESCs der Lage ist, die Selbsterneuerung und Differenzierung in alle Arten von embryonalen und adulten Zellen, einschließlich der Keimzelllinie. Daher Gene in mESCs Targeting ermöglichen Reverse genetische Studien über die Entwicklung von konstitutiven oder bedingten KO-Mäusen (die Cre / loxP-System verwendet wird). Allerdings ist die klassische Art und Weise Maus-ES-Zellen zu isolieren, ist sehr ineffizient. Verschiedene Verbesserungen haben große stark erhöht die Erfolgsrate für die Ableitung MESC Linien, einschließlich der Verwendung eines definierten serum-Ersatz (SR) Medium 15, im Wechsel zwischen MESC Medium SR und fötales Rinderserum (FBS) , 16, und die Verwendung von pharmakodynamischen enthaltendlogische Verbindungen wie pluripotin oder 2i 17. Pluripotin, ein kleines synthetisches Molekül, ermöglicht die Ausbreitung von mESCs in einem undifferenzierten Zustand in Abwesenheit von Leukämie – Hemmfaktor (LIF) und embryonalen Mausfibroblasten (MEFs) 18. Schließlich hat es sich gezeigt , dass mESCs kann mit einem sehr hohen Wirkungsgrad ( in der Nähe von 100%) isoliert werden , wenn ein SR / FBS – Medium Wechsel – Protokoll mit LIF kombiniert und pluripotin 19, 20. Diese Protokolle ermöglichen die effiziente Isolierung von RMCE-kompatibel KO mESCs, die anschließend für Struktur-Funktions-Studien verwendet werden können.
Dieses Dokument beschreibt ein Verfahren, das man die Schlüssel-Domänen oder Reste innerhalb eines Proteins zu identifizieren, ermöglicht es, die für spezifische zelluläre Prozesse verantwortlich sind. Zu diesem Zweck wird eine Pipeline von fortschrittlichen Technologien, die eine effiziente MESC Isolierung ermöglichen, Targeting-Vektor Montage und MESC Targeting war erstellend. Als solche großen Platten mit Proteinisoformen, Domain – Mutanten und Effektoren können in KO mESCs eingeführt werden können und für ihre Fähigkeit , die in – vitro – KO – Phänotyp zu retten ausgewertet werden.
Protocol
Representative Results
Discussion
Unsere MESC Isolationsmethode ist benutzerfreundlich und erfordert keine fortgeschrittenen Fähigkeiten oder Ausrüstung, wie Mikrochirurgie von Blastozysten. Somit ist diese Technologie zu einem großen Teil der wissenschaftlichen Gemeinschaft zugänglich. Jeder, der Grundzellkultur Erfahrung kann ICM Auswüchse propagieren und mESCs Linien etablieren. Allerdings erfordert die Spülung und die Handhabung von Blastozysten etwas Übung. Ein Mundpipette wird verwendet Blastozysten zu übertragen und besteht aus einer Mikr…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wir danken Jinke D'Hont, Frederique Van Rockeghem, Natalie Farla, Kelly Lemeire und Riet De Rycke für ihre hervorragende technische Unterstützung. Wir danken auch Eef Parthoens, Evelien Van Hamme und Amanda Goncalves vom Bioimaging Core Facility des Inflammation Research Center für ihre Unterstützung von Experten. Wir erkennen an Mitglieder unserer Forschungsgruppe für wertvolle Diskussionen. Diese Arbeit wurde von der belgischen Wissenschaftspolitik unterstützt (BELSPO Interuniversitäre Anziehungsschwerpunkte – Preis IAP VII-07 DevRepair; https://devrepair.be), von der Königin Elisabeth-Stiftung für Medizin, Belgien (GSKE 2008-2010; http: // www .fmre-gske.be) und der konzertierten Forschungsaktionen (GOA 01G01908) der Universität Gent, Belgien (http://www.ugent.be/en/ghentuniv). SG ist ein Postdoctoral Fellow der Flandern Forschungsfonds (FWO-V).
Materials
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20°C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23G needles | Fine-ject | 8697 | |
| 1-ml syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 ml distilled water, autoclave and store at 4°C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment: | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 ml, 10 ml and 25 ml | |||
| 15-ml and 50-ml conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μl) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37°C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media: | |||
| MEF Medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| SR-based mESC medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR ) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/ml recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium): | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4°C; warm 30 min at 37°C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/ml ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
References
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1 (2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243 (2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55 (2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).

