Struktur og funktion Studier i embryonale stamceller fra mus Brug rekombinase-medieret Cassette Exchange
Summary
Proteiner indeholder ofte flere domæner, som kan øve forskellige cellulære funktioner. Gene knock-outs (KO) anser ikke denne funktionel diversitet. Her rapporterer vi en rekombinationsmedieret kassette udveksling (RMCE) -baseret struktur-funktion tilgang i KO embryonale stamceller, som giver mulighed for den molekylære dissektion af forskellige funktionelle domæner eller varianter af et protein.
Abstract
Genmanipulation i muse embryoer eller embryonale stamceller (mESCs) giver mulighed for undersøgelse af funktionen af et givet protein. Proteiner er arbejdsheste cellen og ofte bestå af flere funktionelle domæner, som kan påvirkes af posttranslationelle modifikationer. Udtømningen af hele proteinet i betinget eller konstitutiv knock-out (KO) mus tager ikke højde for denne funktionel diversitet og regulering. En Mesc linje og en afledt musemodel, hvori en docking site for FLPe rekombinationsmedieret kassette udveksling (RMCE) blev indsat i ROSA26 (R26) locus, er tidligere blevet rapporteret. Her rapporterer vi på en struktur-funktion tilgang, der muliggør molekylær dissektion af de forskellige funktioner i en multidomæneproteinet protein. Med henblik herpå skal RMCE-kompatibel mus krydses med KO mus og derefter RMCE-kompatible KO mESCs skal isoleres. Dernæst kan et panel af formodede rednings konstrukter indføres i R26 locus via RMCE targeting. Kandidatforbindelserne rednings cDNA'er kan nemt indsættes mellem RMCE sites af målvektoren ved hjælp rekombination kloning. Dernæst KO mESCs transficeret med målvektoren i kombination med et FLPe rekombinase ekspressionsplasmid. RMCE reaktiverer promotorløse neomycinresistensgen i ROSA26 docking sites og tillader selektion af den korrekte targeting event. På denne måde opnås høj målretning effektivitet tæt på 100%, hvilket muliggør indsættelse af flere formodede rednings konstruktioner i en semi-high throughput måde. Endelig kan et væld af R26-drevne rednings-konstruktioner testes for deres evne til at redde fænotype, der blev observeret i forældrenes KO mESCs. Vi præsenterer en proof-of-principle struktur-funktion undersøgelse i p120 catenin (p120ctn) KO mESCs anvender endoderm differentiering i embryoide legemer (EBS) som den fænotypiske udlæsning. Derigennem kan identifikation af vigtige domæner, formodede nedstrømsstier, og sygdomsfri relevante punktmutationer, der ligger til grund for KO fænotyper for et givet protein.
Introduction
Det anslås, at pattedyrgenomer indeholder omkring 20.000 proteinkodende gener. Alternativ splejsning og posttranslationelle modifikationer yderligere øge protein repertoire. Proteiner har en modulær struktur 1 og ofte indeholde multiple interaktionsdomæner, som tillader deres rekruttering til forskellige protein-komplekser og deres deltagelse i flere cellulære processer 2. Et eksempel er det multifunktionelle protein kaldet p120ctn. p120ctn kodes af Ctnnd1 genet og består af et stort centralt bæltedyr gentagelsesdomæne flankeret af en N-terminal og en C-terminal region. Bæltedyret domæne p120ctn binder til en særdeles konserveret juxtamembrandomæne af klassiske cadheriner, som er involveret i celle-celle-adhæsion, men det binder også til den transskriptionsrepressor Kaiso. Det N-terminale domæne af p120ctn interagerer med forskellige kinaser, phosphataser, små RhoGTPases og mikrotubulus-associeret proteins 3. Interessant, som et resultat af alternativ splejsning, p120ctn isoformer kan genereres fra fire alternative startkodoner 4. p120ctn isoform 1A er den længste, da det er oversat fra den mest-5' startkodon og indeholder fuldlængde N-terminale segment. I p120ctn isoformerne 3 og 4 er dette N-terminale segment delvist og fuldstændigt henholdsvis slettet. Forstå den præcise rolle proteiner (eller protein-isoformer) og deres domæner i forskellige cellulære funktioner fortsat en udfordring.
Genmålretning i mESCs muliggør studiet af funktionen af et protein gennem genetisk deletion af det tilsvarende gen og har bredt bidraget til identifikation af udviklingsmæssigt vigtige og sygdomsrelaterede relevante gener og veje. Dette gennembrud i revers genetik var resultatet af fremskridt inden for Mesc isolation og genmålretning grund homolog rekombination 5 </sop>. Homolog rekombination er en proces, hvor DNA-fragmenter udveksles mellem to lignende eller identiske nucleinsyre-dele efter dobbeltstrenget (ds) DNA-brud. Normalt HR er ineffektivt, fordi dsDNA pauser er sjældne. Nylig kunne effektiviteten af homologi-dirigeret genmålretning øges ved anvendelse af stedspecifikke nukleaser 6, 7, men desværre disse er tilbøjelige til off-target effekter 8. En mere pålidelig teknik til at muliggøre genmålretning er RMCE, som er baseret på stedspecifikke rekombinationssteder systemer såsom Cre / loxP eller FLPe / Frt. LoxP og Frt sekvens findes i bakteriofag P1 og Saccharomyces cerevisiae henholdsvis og består af 34 bp, herunder en asymmetrisk 8 bp sekvens, der bestemmer orienteringen af sitet. På den anden side, orienteringen af for eksempel to loxP-sites inden for en DNA-strækning vil afgøre, om floxed DNA bliver udskåret eller inversed upon Cre-medieret rekombination 9. Desuden kan Cre også inducere en translokation hvis to steder er placeret på forskellige kromosomer. RMCE drager fordel af Heterospecifikke rekombinationssteder, der ikke krydsreagerer, og som er indlejret i et genomisk locus. I nærvær af et donorplasmid, der indeholder et DNA-fragment flankeret af de samme Heterospecifikke sites, vil rekombinasen indsætte dette DNA-fragment i RMCE-kompatible genomiske locus på grund af dobbeltstrenget samtidig translokation (figur 1). Her, kan kun korrekt RMCE-målrettede kloner gøre lægemiddelresistens takket være en promotor på den indkommende vektor, som genskaber en "fanget," promotor-mindre neomycinresistensgen (NeoR) til stede i R26-genomet af docking-celler (figur 1) 10, 11. Dette resulterer i en meget høj målretning effektivitet, ofte tæt på 100% 11, </ sup> 12. Afslutningsvis RMCE målretning er yderst effektiv og kan anvendes til struktur-funktioner undersøgelser; men det kræver en præfabrikerede genomiske locus.
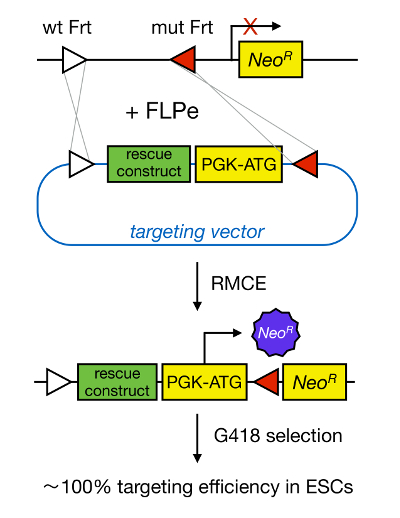
Figur 1. Skematisk repræsentation af RMCE-medieret Målretning. RMCE giver mulighed for udveksling af DNA-segmenter fra et indkommende vektor målretning til en defineret genomisk locus hvis begge harbor to Heterospecifikke FRT-steder (skildret af hvide og røde trekanter). Derudover den konstruerede genomiske locus indeholder et promotorløst og trunkeret neomycin-resistens (NeoR) gen. Ved at tilvejebringe en promotor og startkodon i den indkommende DNA-fragment, kun korrekte rekombinationsbegivenheder genoprette neomycinresistens, hvilket resulterer i effektiviteter høje målretning. Klik her for at se en større version af thans figur.
Genommanipulation i mESCs muliggør frembringelsen af RMCE-kompatibel mus. I 1981, to grupper formået at tage pluripotente celler fra den indre cellemasse (ICM) af blastocyster og opretholdelse dem i kultur 13, 14. mESCs er i stand til selvfornyelse og differentiering i alle typer af embryonale og voksne celler, herunder kim-celle afstamning. Derfor genmålretning i mESCs muliggør omvendt genetiske undersøgelser gennem udvikling af konstitutive eller betingede (ved hjælp af Cre / LoxP-system) KO-mus. Men den klassiske måde at isolere mus ES-celler er meget ineffektiv. Flere store forbedringer har stærkt forøget succesraten for afledt Mesc linjer, herunder anvendelse af et defineret serum-udskiftning (SR) medium 15, vekslende mellem Mesc medium indeholdende SR og føtalt bovint serum (FBS) 16, og anvendelsen af farmakologiske forbindelser, såsom pluripotin eller 2i 17. Pluripotin, en lille syntetisk molekyle, giver mulighed for opformering af mESCs i en udifferentieret tilstand i fravær af leukæmiinhiberende faktor (LIF) og muse embryonale fibroblaster (MEF) 18. Endelig er det blevet vist, at mESCs kan isoleres med en meget høj effektivitet (næsten 100%), når en SR / FBS medium alternerende protokol er kombineret med LIF og pluripotin 19, 20. Disse protokoller muliggør effektiv isolering af RMCE-kompatibel KO mESCs, der efterfølgende kan anvendes til struktur-funktions-undersøgelser.
Dette papir beskriver en fremgangsmåde, der gør det muligt at identificere de vigtigste domæner eller rester i et protein, der er ansvarlige for specifikke cellulære processer. Til dette formål en pipeline af avancerede teknologier, der muliggør effektiv Mesc isolation, målrettede vektor samling, og Mesc målretning var skabed. Som sådan, store paneler med proteinisoformer, domæne mutanter og nedstrømseffektorer kan indføres i KO mESCs og kan evalueres for deres evne til at redde in vitro KO fænotype.
Protocol
Representative Results
Discussion
Vores Mesc isolation metode er brugervenlig og kræver ikke avancerede færdigheder eller udstyr, såsom mikrokirurgi af blastocyster. Således er denne teknologi er tilgængelig for en stor del af det videnskabelige samfund. Enhver med grundlæggende cellekultur erfaring kan forplante ICM udvækster og etablere mESCs linjer. Men skylningen og håndtering af blastocyster kræver nogle praksis. En mundpipette bruges til at overføre blastocyster og består af en mikropipette, en mikropipette holder, slanger og en aspirat…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi takker Jinke D'Hont, Frederique van Rockeghem, Natalie Farla, Kelly Lemeire, og Riet De Rycke for deres fremragende tekniske support. Vi takker også Eef Parthoens, Evelien Van Hamme, og Amanda Goncalves fra Bioimaging Core Facility for Inflammation Forskningscenter for deres eksperthjælp. Vi anerkender medlemmer af vores forskningsgruppe for værdifulde diskussioner. Dette arbejde blev støttet af den belgiske Science Policy (Belspo universitetscenter Type polakker – Award IAP VII-07 DevRepair; https://devrepair.be), af Dronning Elisabeth Medical Foundation, Belgien (GSKE 2008-2010; http: // www .fmre-gske.be), og af de samordnede Research aktioner (GOA 01G01908) af Ghent Universitet, Belgien (http://www.ugent.be/en/ghentuniv). SG er en post.doc af Flandern forskningsmidler (FWO-V).
Materials
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20°C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23G needles | Fine-ject | 8697 | |
| 1-ml syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 ml distilled water, autoclave and store at 4°C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment: | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 ml, 10 ml and 25 ml | |||
| 15-ml and 50-ml conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μl) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37°C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media: | |||
| MEF Medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| SR-based mESC medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR ) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/ml recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium): | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4°C; warm 30 min at 37°C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/ml ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
References
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1 (2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243 (2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55 (2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).

