3色 1 分子 FRET を使用して蛋白質の相互作用の相関関係を研究するには
Summary
ここでは、3色 smFRET データと 3 D アンサンブル隠されたマルコフ モデルとその解析を取得するためのプロトコルを提案する.このアプローチでは、科学者は複雑な蛋白質のシステム、協同性や相関相互作用などからキネティック情報を抽出できます。
Abstract
単一分子蛍光共鳴エネルギー移動 (smFRET) 生体分子のダイナミクスを調べるため広く使用されている生物物理学的技術となっています。自分のタスクを満たすために機能サイクルの相互作用パートナーと共に行動する細胞蛋白質の多くの分子機械を持っています。延長にマルチカラー 2 色 smFRET はそれに 1 つ以上の相互作用や構造変化を同時に調査することが可能。これだけではなく smFRET 実験新しいディメンションを追加しますが、イベントのシーケンスを直接研究して固定化サンプルと全反射蛍光相関相互作用を検出するユニークな可能性を提供しています顕微鏡 (TIRFM)。したがって、マルチカラーの smFRET は以前達成不可能の詳細で定量的な方法で生体分子複合体を研究するための多目的なツールです。
ここでは、蛋白質のマルチカラー smFRET 実験の特別な課題を克服する方法を示します。データを取得するため、運動情報を抽出するための詳細なプロトコルを提案します。これは、トレース選択基準、国家の分離、および 3 D アンサンブル隠されたマルコフ モデル (HMM) を用いたノイズの多いデータから状態軌道の回復が含まれています。他の方法と比較して、運動情報はドエル時間ヒストグラムから、直接 HMM からを回復しません。最尤フレームワーク キネティック モデルを批判的に評価して料金の意味のある不確実性を提供することが出来ます。
熱ショックタンパク質 90 (Hsp90) に本手法を適用しておりますはヌクレオチド結合および蛋白質のコンフォメーション変化が世界を解きほぐすことができます。これにより、Hsp90 二量体の 2 つのヌクレオチド結合ポケットの間の協同性を直接観察できます。
Introduction
多くの蛋白質は、動的錯体の構造変化と幅広い時間スケール1,2,3の一時的な連合を介した他の分子とその機能を発揮します。外部のエネルギー源 (例えばATP) これらの動的相互作用することができます機能サイクルの方向性につながる、最終的に生活のための前提条件のセルに非平衡定常状態を維持する結合。
これらの分子機械を完全に理解するためには、静的な記述の構造研究に導かれては十分ではありません。さらに、基になる運動モデルの知識を持って運動速度定数を決定するために不可欠です。いくつかの既存の方法許可バイナリ相互関心、表面プラズモン共鳴など、(例えば、ジャンプまたはストップト フロー分光読み出しと緩和法の 2 つの分子のダイナミクスを研究する研究者テクニック) と核磁気共鳴。ただし、適用性は、(例えば、 1 つのバインドとバインドされていない状態) の単純な 2 状態系平均一括実験に固有のために制限されてほとんどの場合です。以上の国または中間体が関与している場合、彼らは唯一速度定数の複雑な混合物をもたらします。単一分子光ピンセットや磁気ピンセットや 2 色 smFRET、つまり1 ドナー表面固定化したサンプルを 1 つの受容体 fluorophore など方法は、立体配座の変化すべての速度定数を回復できます。しかしときに、1 つ以上の結合部位に影響を与える相互作用は、これらの方法が限られている残る、2 つ (またはそれ以上) の可能な相関相互作用についてのみ、一連の実験から結論は間接を通じてアクセスできます。
マルチカラー smFRET4,5,6,7,8,9は、リアルタイムで直接、下のこれらのコンポーネント間の相互作用を研究する機会を提供しています近く生理的条件10。これにより、たとえば、リガンドまたは別タンパク質8,9,11のコンホメーション依存的結合を調査する 1 つ。ここで示した全体的なアプローチは、測定チャンバーの表面にタンパク質を付けると時間をかけて (の詳細についてを参照してください9プリズム型観察上の蛍光強度を追跡するための特定の位置で興味のタンパク質のラベルには,12) します。 異なる染料の空間的近接性することができますそれらの間のエネルギー移動から決定されます。(文献13) 蛋白質蛋白質から異なる場合があります戦略をラベリングと smFRET 測定におけるアーティファクトを避けるためのガイドライン14が存在します。
ドナー色素は、マルチカラー smFRET 実験で異なるアクセプター色素にエネルギーを移す可能性があります、ので、すべての染料の相対位置は 1 つの染料だけで15,16の興奮からアクセスできません。しかし、交互にレーザー励起 (アレックス17、および18の見直し) との組み合わせでこのメソッドは、1 秒未満でサブナノ メートル分解すべての時空間的情報を提供します。
原則として、構造情報は色素間の距離を使用して実現できます高解像度はアレックスとマルチカラー smFRET 実験ではすべての蛍光強度の組み合わせから計算されます。しかし、ここで状態の識別、分離、マルチカラー smFRET が不可欠である、運動のモデルの抽出に着目します。三角形分割による構造決定「のみ」が必要な場合、高い信号対雑音比の単純な 2 色 smFRET 実験セットは実行12,19にできます。
部分的な蛍光を用いて (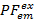 ) 2 つの同時7間のエネルギー移動のためのプロキシとして。PFは、2 色実験の FRET 効率に類似した蛍光強度から計算されます。
) 2 つの同時7間のエネルギー移動のためのプロキシとして。PFは、2 色実験の FRET 効率に類似した蛍光強度から計算されます。
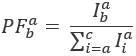
ここで、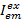 カラー exと励起後放出チャネルemの強度は、 cが最も長い波長を持つ受容体です。検出チャンネルは、試料室が蛍光ライトのスペクトル範囲が異なるレコードの同じ位置を表しています。励起と放射の同じ識別子はこのプロトコルで使用される (すなわち、 「青」、「緑」と”red”)。
カラー exと励起後放出チャネルemの強度は、 cが最も長い波長を持つ受容体です。検出チャンネルは、試料室が蛍光ライトのスペクトル範囲が異なるレコードの同じ位置を表しています。励起と放射の同じ識別子はこのプロトコルで使用される (すなわち、 「青」、「緑」と”red”)。
実験的欠点のため測定された蛍光強度はエネルギー転送のみならず、fluorophore およびセットアップ プロパティにも依存します。2 フルオロ間真のエネルギー伝達効率を得るために修正する測定強度があります。次の手順は、参照9に基づいています。明らかな漏れ (lk、すなわち、別の染料のため指定されたチャネルの蛍光体からの光子検出) の明白なガンマ補正係数 (ag、すなわち色素の蛍光量子収率とチャネルの検出効率) 表示するイベントを漂白アクセプター分子トレースから取得されます。
すべての可能な受容体チャネルにドナー色素の漏出、アクセプター色素漂白しますが、ドナーはまだ蛍光記録された蛍光トレース内のすべてのデータ ポイントから計算されます (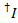 )。
)。
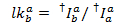
漏れヒストグラムの中央値は明らかな漏洩ファクターとして使用されます。漏れの訂正後、明白なガンマ係数はトレースの同じセットによって決定されます。それはアクセプター色素の漂白時にドナーのチャネルで蛍光の変化による受容体チャネルの蛍光の変化を割ることによって計算されます。
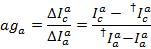
場所c再び、最長波長を持つ受容体の検出チャンネルです。結果の分布の中央値は、明らかな補正係数として使用されます。
各チャンネルで修正された強度は、によって得られます。
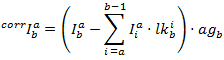
PFによると計算されます。
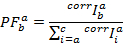
別の集団は、 PFs 多次元空間で分離できます。位置と各状態の幅は、継ぎ手の多次元ガウス関数とデータによって決まります。すべてPFトレースに基づく 1 つのグローバルな HMM の後続の最適化は、観測された挙動の定量的な説明を提供します。率の小さな変更は検出です。
Hmm は、騒々しい時間トレースの収集から状態モデルを推定する方法を提供します。システムは、任意の時点と実際の観測 (すなわち、排出量) で隠された状態はこの隠し状態20の確率関数、離散のセットのいずれかにすると見なされます。観察 smFRET データの場合、放出確率bは私の状態は私あたりは連続ガウス確率密度関数でモデル化できます。定期的に間隔をあけられた離散時間ポイントでから 1 つ別の状態への遷移、時不変であり現在の状態にだけ依存する遷移確率によると発生します。遷移行列Aでは、これらの遷移確率ijをすべて非表示のステート間を含まれています。初期状態分布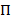 状態固有の確率を与える
状態固有の確率を与える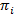 時間トレースの最初の時間の点。最大尤度アプローチを使用して、これらのパラメーターは最高前後バウム ウェルチ アルゴリズム20,21とデータを記述するために最適化できます。最尤推定 (MLE) が得られます。最後に、最も可能性の高い観察の軌道を生成状態シーケンスはビタビ アルゴリズムで推測できます。HMM、単なる「平滑化」のデータが必要とせずデータ セットから抽出運動の状態モデルのドウェル時間を嵌合するための smFRET データ24,25,26の他の HMM 解析と対照をなして使わないヒストグラム27。HMM 解析は、Igor Pro を使用してスクリプトを内部で行われます。コードの実装は、参照21に基づいています。我々 は次のセクション 5 および 6 はこのプロトコル (https://www.singlemolecule.uni-freiburg.de/software/3d-fret) のために当社ホームページのソフトウェア キットと模範的なデータを提供します。完全なソフトウェアは、リクエストを承ります。
時間トレースの最初の時間の点。最大尤度アプローチを使用して、これらのパラメーターは最高前後バウム ウェルチ アルゴリズム20,21とデータを記述するために最適化できます。最尤推定 (MLE) が得られます。最後に、最も可能性の高い観察の軌道を生成状態シーケンスはビタビ アルゴリズムで推測できます。HMM、単なる「平滑化」のデータが必要とせずデータ セットから抽出運動の状態モデルのドウェル時間を嵌合するための smFRET データ24,25,26の他の HMM 解析と対照をなして使わないヒストグラム27。HMM 解析は、Igor Pro を使用してスクリプトを内部で行われます。コードの実装は、参照21に基づいています。我々 は次のセクション 5 および 6 はこのプロトコル (https://www.singlemolecule.uni-freiburg.de/software/3d-fret) のために当社ホームページのソフトウェア キットと模範的なデータを提供します。完全なソフトウェアは、リクエストを承ります。
時間でPFを使用してデータ ポイント <-1 またはPF > 任意の検出チャンネルで 2 がすべての州 (10-200) の発生が少ない確率を割り当てられます。これは、これらのデータ ポイントで人工の遷移を防ぎます。
放出確率のパラメーターは、手順 5.7 ガウス関数による 3 D PFヒストグラムのフィットから取得されます。これらのパラメーターは、HMM の最適化中に固定されます。
提示されたアプローチで初期状態分布ベクトルと遷移行列が、トレースの全体のアンサンブルを記述するグローバルに使用されます。参照27に従って、データ セットからのすべてのN分子に基づいて更新されます。
初期状態の配布の開始パラメーターはPFヒストグラム (ステップ 5.3) の投影から決定され、遷移確率に設定されて 0.05 確率を除いて同じ状態に滞在するそのような物選ばれました。特定の状態のままにする確率を団結を正規化します。
プロファイル尤は、すべて移行率21,22不確実性の意味のある見積もりとなるための信頼区間 (Ci) を与えるためです。特定のレートの CI の境界を計算するための関心の遷移確率は尤以外の値に固定されています。これにより、テスト モデル λ’。尤度の尤度比 (LR) 検定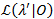 によると特定のデータ セット0が実行されます。
によると特定のデータ セット0が実行されます。
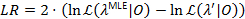
バインド パラメーターはLR 3.841、 2xの 95% の変位値を超えたときに 95% の信頼-1 自由度22,23配布。
Hsp90 を使用してメソッドの力を発揮します。この豊富なタンパク質は、細菌と真核生物で発見され、細胞ストレス応答28の一部です。がん治療29で有望な薬剤標的であります。Hsp90 は各サブユニットの30の N 末端ドメインの 1 つのヌクレオチド結合ポケットのホモです。それは、少なくとも 2 つのグローバル異なるコンフォメーション、閉鎖の 1 つと 1 つ N ターミナル オープン、V 字構造19,31,32間の遷移を受けることができます。二量体の性質は直接 Hsp90 2 つのヌクレオチド結合部位間の相互作用の問題を発生させます。
以下では、データ集録および酵母 Hsp90 とヌクレオチドの 3色 smFRET 実験の解析の手順プロトコルを提供します。蛍光に分類されたアンプ PNP のコンホメーション依存的結合 (AMP-PNP *、非加水分解性 ATP アナログ) が分析します。記述されていたプロシージャのアプリケーション研究ヌクレオチド結合のと同時に Hsp90 のコンフォメーション変化が許認可により Hsp90 の 2 つのヌクレオチド結合ポケットの間の協同性を明らかにします。
Protocol
Representative Results
Discussion
複雑なタンパク質系のこれらの測定値の分析の手順を追って説明 3色 smFRET データを取得する実験を紹介します。このアプローチでは、直接複数の相互作用部位や構造変化との相関を評価するユニークな可能性を提供しています。
タンパク質の適切なマルチカラー分子データを得るために低ノイズ レベルで再現可能な測定を行うことが重要です。これは、フロー商工会議…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この作品は、ドイツ研究振興協会 (INST 39/969-1) し ERC 助成契約 n. 681891 を通じて欧州研究評議会によって資金を供給します。
Materials
| Setup | |||
| vibration-damped optical table | Newport, Irvine, CA, USA | RS2000 | |
| OBIS 473nm LX 75mW LASER | Coherent Inc, Santa Clara, CA, USA | 1185052 | |
| OBIS 532nm LS 50mW LASER | Coherent Inc, Santa Clara, CA, USA | 1261779 | |
| OBIS 594nm LS 60mW LASER | Coherent Inc, Santa Clara, CA, USA | 1233470 | |
| OBIS 637nm LX 140mW LASER | Coherent Inc, Santa Clara, CA, USA | 1196625 | |
| laser control unit | Coherent Inc, Santa Clara, CA, USA | 1234465 | Scientific Remote |
| aspheric telescope lenses | Thorlabs Inc, Newton, New Jersey, USA | d=25.4mm, f=50mm and f=100mm | |
| CF ex1 | AHF analysentechnik AG, Tübingen, Germany | ZET 473/10 | cleanup filter excitation |
| CF ex2 | AHF analysentechnik AG, Tübingen, Germany | ZET 532/10 | cleanup filter excitation |
| CF ex3 | AHF analysentechnik AG, Tübingen, Germany | ZET 594/10 | cleanup filter excitation |
| CF ex4 | Thorlabs Inc, Newton, New Jersey, USA | FL635-10 | cleanup filter excitation |
| DM ex1 | AHF analysentechnik AG, Tübingen, Germany | ZQ594RDC | dichroic mirror excitation |
| DM ex2 | AHF analysentechnik AG, Tübingen, Germany | 570DCXR | dichroic mirror excitation |
| DM ex3 | AHF analysentechnik AG, Tübingen, Germany | ZQ491RDC | dichroic mirror excitation |
| AOTFnC-Vis | AA Opto-Electronic, Orsay, France | ||
| λ/4 plate | Thorlabs Inc, Newton, New Jersey, USA | AQWP05M-600 | |
| CFI Apo TIRF 100x | Nikon Instruments Inc, Melville, NY, USA | high-NA objective | |
| piezo focus positioner MIPOS 250 CAP | piezosystem jena GmbH, Jena, Germany | Piezo Controller NV 40/1 CLE | |
| piezo stepper | Newport, Irvine, CA, USA | PZA12 | PZC200-KT NanoPZ Actuator Kit |
| achromatic aspheric lenses | Qioptiq Photonics GmbH & Co. KG, Göttingen, Germany | G322-304-000 | d=50mm, f=200mm |
| adjustable optical slit | Owis GmbH, Staufen i. Br., Germany | 27.160.1212 | max. aperture 12 x 12 mm |
| DM det1 | AHF analysentechnik AG, Tübingen, Germany | T 600 LPXR | dichroic mirror detection |
| DM det2 | AHF analysentechnik AG, Tübingen, Germany | H 560 LPXR superflat | dichroic mirror detection |
| DM det3 | AHF analysentechnik AG, Tübingen, Germany | HC BS R635 | dichroic mirror detection |
| BP det1 | AHF analysentechnik AG, Tübingen, Germany | 525/40 BrightLine HC | bandpass filter detection |
| BP det2 | AHF analysentechnik AG, Tübingen, Germany | 586/20 BrightLine HC | bandpass filter detection |
| BP det3 | AHF analysentechnik AG, Tübingen, Germany | 631/36 BrightLine HC | bandpass filter detection |
| BP det4 | AHF analysentechnik AG, Tübingen, Germany | 700/75 ET Bandpass | bandpass filter detection |
| optical shutters detection | Vincent Associates, Rochester, NY, USA | Uniblitz VS25S2T0 | |
| EMCCD iXon Ultra 897 | Andor Technology Ltd, Belfast, Northern Ireland | ||
| digital I/O card, PCIe-6535 | National Instruments, Austin, Texas, USA | ||
| syringe pump | Harvard Apparatus, Holliston, MA, USA | PHD22/2000 | |
| Name | Company | Catalog Number | Comments |
| Flow chamber | |||
| quartz slides | G. Finkenbeiner Inc, Waltham, MA, USA | Spectrosil2000, h=3mm | |
| TEGADERM film | 3M Deutschland GmbH, Neuss, Germany | 1626W | 10 x 12cm |
| spray adhesive | 3M Deutschland GmbH, Neuss, Germany | Photo Mount 050777 | |
| glycerol | Carl Zeiss AG, Oberkochen, Germany | Immersol G | |
| immersion oil | OLYMPUS EUROPA SE & CO. KG, Hamburg, Germany | IMMOIL-F30CC | |
| prism | Vogelsberger Quarzglastechnik GmbH, Hauzenberg, Germany | Suprasil1 | |
| aluminium prism holder | custom built | ||
| hollow setscrews | Thorlabs Inc, Newton, New Jersey, USA | with custom drilling | |
| Tygon S3 E-3603 tubing | neoLab Migge GmbH, Heidelberg, Germany | 2-4450 | ACF00001 |
| PTFE tubing | Bohlender GmbH, Grünsfeld, Germany | S1810-08 | |
| Name | Company | Catalog Number | Comments |
| Sample | |||
| yeast Hsp90 D61C, Q385C_biotin | UniProt ID P02829 | ||
| Maleimide derivatives of Atto488, Atto550 | ATTO-TEC GmbH, Siegen, Germany | ||
| AMP-PNP* | Jena Bioscience, Jena, Germany | γ-[(6-Aminohexyl)-imido]-AMP-PNP-Atto647N | |
| Fluospheres | Thermo Fisher Scientific, Waltham, MA, USA | F8764 | amine-modified, 0.2 μm, yellow-green fluorescent |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Andor Solis | Andor Technology Ltd, Belfast, Northern Ireland | version 4.30 | |
| LabVIEW | National Instruments, Austin, Texas, USA | version 2012, 32bit; misc. hardware control | |
| MDS control software | AA Opto-Electronic, Orsay, France | version 2.03a | |
| Coherent Connection | Coherent Inc, Santa Clara, CA, USA | version 3 | |
| Igor Pro | WaveMetrics Inc, Portland, OR, USA | version 6.37 |
References
- Nooren, I. M. A., Thornton, J. M. Diversity of protein-protein interactions. EMBO J. 22 (14), 3486-3492 (2003).
- Marsh, J. A., Teichmann, S. A. Structure, dynamics, assembly, and evolution of protein complexes. Annu Rev Biochem. 84, 551-575 (2015).
- Henzler-Wildman, K., Kern, D. Dynamic personalities of proteins. Nature. 450 (7172), 964-972 (2007).
- Hohng, S., Joo, C., Ha, T. Single-Molecule Three-Color FRET. Biophys J. 87 (2), 1328-1337 (2004).
- Person, B., Stein, I. H., Steinhauer, C., Vogelsang, J., Tinnefeld, P. Correlated movement and bending of nucleic acid structures visualized by multicolor single-molecule spectroscopy. ChemPhysChem. 10 (9-10), 1455-1460 (2009).
- Lee, J., Lee, S., Ragunathan, K., Joo, C., Ha, T., Hohng, S. Single-molecule four-color FRET. Angew Chem Int Ed. 49 (51), 9922-9925 (2010).
- Ratzke, C., Berkemeier, F., Hugel, T. Heat shock protein 90’s mechanochemical cycle is dominated by thermal fluctuations. Proc Natl Acad Sci U S A. 109 (1), 161-166 (2012).
- Ratzke, C., Hellenkamp, B., Hugel, T. Four-colour FRET reveals directionality in the Hsp90 multicomponent machinery. Nat Commun. 5, 4192 (2014).
- Götz, M., Wortmann, P., Schmid, S., Hugel, T. A Multicolor Single-Molecule FRET Approach to Study Protein Dynamics and Interactions Simultaneously. Methods Enzymol. 581, 487-516 (2016).
- Yengo, C. M., Berger, C. L. Fluorescence anisotropy and resonance energy transfer: Powerful tools for measuring real time protein dynamics in a physiological environment. Curr Opin Pharmacol. 10 (6), 731-737 (2010).
- Wortmann,P , ., Götz M, ., Hugel T , . Cooperative Nucleotide Binding in Hsp90 and Its Regulation by Aha1. Biophys J. 113, 1711-1718 (2017).
- Dörfler, T., Eilert, T., Röcker, C., Nagy, J., Michaelis, J. Structural Information from Single-molecule FRET Experiments Using the Fast Nano-positioning System. J Vis Exp. (120), e54782 (2017).
- Stephanopoulos, N., Francis, M. B. Choosing an effective protein bioconjugation strategy. Nature chemical biology. 7 (12), 876-884 (2011).
- Sánchez-Rico, C., Voith von Voithenberg, L., Warner, L., Lamb, D. C., Sattler, M. Effects of Fluorophore Attachment on Protein Conformation and Dynamics Studied by spFRET and NMR Spectroscopy. Chemistry (Weinheim an der Bergstrasse, Germany). , (2017).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nat Methods. 5 (6), 507-516 (2008).
- Lee, N. K., et al. Three-color alternating-laser excitation of single molecules: monitoring multiple interactions and distances. Biophys J. 92 (1), 303-312 (2007).
- Kapanidis, A. N., Lee, N. K., Laurence, T. A., Doose, S., Margeat, E., Weiss, S. Fluorescence-aided molecule sorting: analysis of structure and interactions by alternating-laser excitation of single molecules. Proc Natl Acad Sci U S A. 101 (24), 8936-8941 (2004).
- Hohlbein, J., Craggs, T. D., Cordes, T. Alternating-laser excitation: single-molecule FRET and beyond. Chem Soc Rev. 43 (4), 1156-1171 (2014).
- Hellenkamp, B., Wortmann, P., Kandzia, F., Zacharias, M., Hugel, T. Multidomain structure and correlated dynamics determined by self-consistent FRET networks. Nat Methods. 14, 174-180 (2017).
- Rabiner, L. R. A tutorial on hidden Markov models and selected applications in speech recognition. Proc IEEE. 77 (2), 257-286 (1989).
- Fink, G. A. . Markov Models for Pattern Recognition. , (2014).
- Giudici, P., Ryden, T., Vandekerkhove, P. Likelihood-Ratio Tests for Hidden Markov Models. Biometrics. 56 (3), 742-747 (2000).
- Visser, I., Raijmakers, M. E. J., Molenaar, P. C. M. Confidence intervals for hidden Markov model parameters. Br J Math Stat Psychol. 53 (2), 317-327 (2000).
- McKinney, S. A., Joo, C., Ha, T. Analysis of Single-Molecule FRET Trajectories Using Hidden Markov Modeling. Biophys J. 91 (5), 1941-1951 (2006).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L., Wiggins, C. H. Learning Rates and States from Biophysical Time Series: A Bayesian Approach to Model Selection and Single-Molecule FRET Data. Biophys J. 97 (12), 3196-3205 (2009).
- Greenfeld, M., Pavlichin, D. S., Mabuchi, H., Herschlag, D. Single Molecule Analysis Research Tool (SMART): an integrated approach for analyzing single molecule data. PLoS ONE. 7 (2), e30024 (2012).
- Schmid, S., Götz, M., Hugel, T. Single-Molecule Analysis beyond Dwell Times: Demonstration and Assessment in and out of Equilibrium. Biophys J. 111 (7), 1375-1384 (2016).
- Taipale, M., Jarosz, D. F., Lindquist, S. HSP90 at the hub of protein homeostasis: emerging mechanistic insights. Nat Rev Mol Cell Biol. 11 (7), 515-528 (2010).
- Trepel, J., Mollapour, M., Giaccone, G., Neckers, L. Targeting the dynamic HSP90 complex in cancer. Nat Rev Cancer. 10 (8), 537-549 (2010).
- Wayne, N., Bolon, D. N. Dimerization of Hsp90 is required for in vivo function. Design and analysis of monomers and dimers. J Biol Chem. 282 (48), 35386-35395 (2007).
- Ali, M. M. U., et al. Crystal structure of an Hsp90-nucleotide-p23/Sba1 closed chaperone complex. Nature. 440 (7087), 1013-1017 (2006).
- Southworth, D. R., Agard, D. A. Species-dependent ensembles of conserved conformational states define the Hsp90 chaperone ATPase cycle. Mol Cell. 32 (5), 631-640 (2008).
- Blanchard, S. C., Kim, H. D., Gonzalez, R. L., Puglisi, J. D., Chu, S. tRNA dynamics on the ribosome during translation. Proc Natl Acad Sci U S A. 101 (35), 12893-12898 (2004).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophys J. 94 (5), 1826-1835 (2008).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
- Rognoni, L., Stigler, J., Pelz, B., Ylänne, J., Rief, M. Dynamic force sensing of filamin revealed in single-molecule experiments. Proc Natl Acad Sci U S A. 109 (48), 19679-19684 (2012).
- Okumus, B., Wilson, T. J., Lilley, D. M. J., Ha, T. Vesicle encapsulation studies reveal that single molecule ribozyme heterogeneities are intrinsic. Biophys J. 87 (4), 2798-2806 (2004).
- Boukobza, E., Sonnenfeld, A., Haran, G. Immobilization in Surface-Tethered Lipid Vesicles as a New Tool for Single Biomolecule Spectroscopy. J Phys Chem B. 105 (48), 12165-12170 (2001).
- Levene, M. J., Korlach, J., Turner, S. W., Foquet, M., Craighead, H. G., Webb, W. W. Zero-mode waveguides for single-molecule analysis at high concentrations. Science. 299 (5607), 682-686 (2003).
- Panaretou, B., et al. ATP binding and hydrolysis are essential to the function of the Hsp90 molecular chaperone in vivo. EMBO J. 17 (16), 4829-4836 (1998).

