С использованием трехцветной сингл молекула лад для изучения корреляции взаимодействий протеина
Summary
Здесь мы представляем протокол для получения трехцветных smFRET данных и их анализ с 3D ансамбль скрытой марковской модели. С этим подходом ученые могут извлекать кинетическая информацию из сложных белковых систем, включая кооперативность или коррелированные взаимодействий.
Abstract
Одноместный молекула Фёрстер резонанс передачи энергии (smFRET) стала широко используемый биофизический метод для изучения динамики биомолекул. Для многих молекулярных машин в клетки белки должны действовать вместе с взаимодействия партнеров в функциональных цикла для выполнения их задачи. Расширение два цвета многоцветные smFRET позволяет одновременно исследовать более чем одной взаимодействия или конформационные изменения. Это не только добавляет новое измерение к smFRET эксперименты, но он также предлагает уникальную возможность непосредственно изучить последовательность событий и Обнаружение коррелированных взаимодействия при использовании иммобилизованных образца и полного внутреннего отражения флуоресценции Микроскоп (TIRFM). Таким образом многоцветные smFRET является универсальным инструментом для изучения биомолекулярных комплексов в количественном выражении и ранее недостижимое подробно.
Здесь мы продемонстрируем для преодоления особых проблем многоцветные smFRET экспериментов на белки. Мы представляем подробные протоколы для получения данных и извлечения кинетическая информации. Это включает в себя критерии отбора трассировки, разделение государства и восстановления государства траекторий от шумных данных с использованием 3D ансамбль скрытой марковской модели (HMM). По сравнению с другими методами, кинетическая информация не восстанавливается от гистограммы времени останавливаться, но непосредственно от Хм. Рамки максимального правдоподобия позволяет нам критически оценивать кинетическая модель и для обеспечения значимого неопределенности для ставок.
Применяя метод белка теплового шока 90 (Hsp90), мы в состоянии отделить нуклеотида привязки и глобальные конформационные изменения белка. Это позволяет нам непосредственно наблюдать кооперативность между двумя нуклеотидов привязки очагов Hsp90 димер.
Introduction
Многие белки выполняют свои функции в динамической комплексы с другими молекулами, посредничестве конформационные изменения и переходных ассоциаций по широкому спектру сроков1,2,3. В сочетании с внешнего источника энергии (например, АТФ) эти динамические взаимодействия может привести к получателю в цикле функциональных и в конечном счете сохранить неравновесного установившемся в клетке, необходимым условием для жизни.
Для того чтобы полностью понять эти молекулярные машины, статическое описание, руководствуясь структурных исследований не является достаточным. Кроме того важно иметь знания о базовой кинетической модели и определить константы кинетической скорости. Несколько существующих методов позволяют исследователям изучить динамику бинарных взаимодействий между двумя молекулами интерес, например, поверхностного плазмон резонанс, методы релаксации с спектроскопических индикация (например, прыгать или остановить поток методы) и ядерного магнитного резонанса. Однако их применимости, в большинстве случаев, ограничивается простых систем двух государств (например, одна граница и одно государство, несвязанных) благодаря усреднение присущие массовых экспериментов. В тех случаях, когда речь идет о более государств или промежуточных продуктов они дают только сложная смесь константы скорости. Одноместный молекула методы, такие как магнитные или оптические пинцеты или два цвета smFRET, то есть, один из доноров и один акцепторной Флюорофор, с образец поверхности прикол может восстановить константы скорости для всех наблюдаемых конформационных изменений. Однако когда дело доходит до взаимодействия, затрагивающих более одной привязки сайта, эти методы по-прежнему ограничены, и информация о возможной корреляции двух (или более) взаимодействия только будут доступны через косвенные выводы из набора экспериментов.
Многоцветные smFRET4,5,6,,78,9 предлагает возможность изучить взаимодействие между этими компонентами непосредственно в режиме реального времени и под рядом физиологические условия10. Это позволяет исследовать например, конформация зависимых Связывание лиганда или другой белок8,9,11. Общий подход, представленные здесь является маркировать белки интерес в определенных позициях, прикрепить один белка на поверхности измерительной камеры, а также отслеживать интенсивности флуоресценции со временем на призму типа TIRFM (для подробности см 9 , 12). пространственная близость различных красителей, затем может быть определено из передачи энергии между ними. Маркировка стратегии может варьироваться от белка белка (обзор в 13) и руководящие принципы, чтобы избежать артефактов в smFRET измерения существуют14.
Поскольку краска доноров может передавать энергию различных акцептора красителей в эксперименте многоцветные smFRET, относительное положение всех красителей не доступен от возбуждения одного красителя только15,16. Но в сочетании с чередующимися лазерного возбуждения (Алекс17и рассмотренных в 18) Этот метод обеспечивает все пространственно временной информации на секунды и резолюции Подкомиссии нанометров.
В принципе высоким разрешением, которую структурная информация может быть достигнуто с помощью расстояния между краситель рассчитывается из комбинации всех интенсивностью флюоресценции в многоцветные smFRET эксперимент с АЛЕКСОМ. Однако здесь мы сосредоточиться на идентификации состояний и разделения, а также добыча кинетической модели, где smFRET многоцветные незаменим. Когда «только» для определения структуры путем триангуляции, набор проще-двухцветный smFRET экспериментов с высоким соотношением сигнал шум может быть осуществляется12,19.
Мы используем частичное флюоресценция (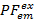 ) как прокси для передачи энергии между двумя флуорофоров7. PF рассчитывается от интенсивности флуоресценции аналогична эффективности ладу-двухцветный эксперимента:
) как прокси для передачи энергии между двумя флуорофоров7. PF рассчитывается от интенсивности флуоресценции аналогична эффективности ладу-двухцветный эксперимента:
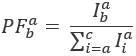
Где 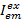 интенсивность выбросов канал ет после возбуждения с цветом ex, и c акцептор с длинной волны. Обнаружение каналов представляют собой ту же позицию в пример камеры, но записи различных спектральных диапазонах света флуоресцирования. Тот же идентификатор для возбуждения и выбросов используются в настоящем Протоколе (т.е., «синий», «зеленых» и «красных»).
интенсивность выбросов канал ет после возбуждения с цветом ex, и c акцептор с длинной волны. Обнаружение каналов представляют собой ту же позицию в пример камеры, но записи различных спектральных диапазонах света флуоресцирования. Тот же идентификатор для возбуждения и выбросов используются в настоящем Протоколе (т.е., «синий», «зеленых» и «красных»).
Из-за экспериментальной недостатки интенсивностью флюоресценции измеренных зависит не только на передачу энергии, но и на Флюорофор и установки свойств. Чтобы получить истинное энергетической эффективности передачи между двумя флуорофоров, измеряемых интенсивностей должны быть исправлены. Следующая процедура основана на ссылку9. Поправочные коэффициенты для явного утечки (lk, т.е. обнаружение фотонов от Флюорофор в канале, предназначенные для другого красителя) и очевидной гамма (ag, т.е. квантовый выход флуоресценции красителя и эффективность обнаружения канала) получаются из одной молекулы следы, которые показывают акцептора отбеливания событие.
Утечки доноров красителя в каждый канал возможно акцептора рассчитывается от всех точек данных в записанных флуоресценции следы где краска акцептора отбеленная, но доноров до сих пор флуоресцентные (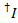 ):
):
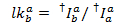
Медиана утечки гистограммы используется как фактор явно утечки. После коррекции для утечки очевидной гамма фактор определяется из того же набора трассировок. Она рассчитывается путем деления изменения флюоресценции в акцепторной канал изменения флюоресценции в канале доноров после отбеливания акцептора красителя:
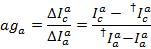
Где c снова является каналом обнаружения акцептор с длинной волны. Медиана распределения результирующей используется как очевидной поправочный коэффициент.
Исправленные интенсивностей в каждом канале получаются путем:
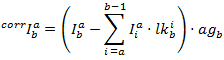
PF рассчитывается согласно:
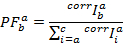
Различные группы населения могут быть разделены в многомерном пространстве, занимаемых PFs. Положение и ширину каждого государства определяется путем установки данных с многомерной функции Гаусса. Последующей оптимизации одной глобальной Хм, основанные на все следы PF обеспечивает количественное описание наблюдаемых кинетики. Даже небольшие изменения ставок обнаруживаются.
HMMs обеспечивают способ выведение модель государства из коллекции шумных следы. Система считается одним из набора дискретных, скрытые состояния в любой момент времени и фактические наблюдения (т.е. выбросов) является вероятностное функцией этой скрытой государственной20. В случае TIRFM smFRET данных выбросов вероятностей b,я за государство, я могут быть смоделированы путем непрерывного Гауссова плотность вероятности функций. В точках через равные интервалы времени дискретных переходы от одного до другого государства может произойти согласно переход вероятность того, что время инвариантная и зависит только от текущего состояния. Матрицы перехода A содержит эти вероятности перехода ij между всеми скрытые государствами. Начальное состояние распространения 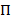 дает вероятностей положени специфически
дает вероятностей положени специфически 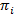 для первой точки время время трассировки. Методом максимального правдоподобия, эти параметры могут быть оптимизированы, чтобы лучше всего описать данные с вперед-назад и Баум-Уэлч алгоритмов20,21. Это дает оценок максимального правдоподобия (MLE). Наконец государство последовательность, которая скорее производится траектории наблюдений может быть выведено с Витерби алгоритм. В отличие от других анализов Хм smFRET данных24,,2526 мы не используем HMM как всего лишь «разглаживание» данных но экстракт кинетическая общегосударственной модели из набора данных без необходимости для установки времени задержки гистограммы27. HMM анализ делается с собственных скриптов с использованием Игорь Pro. Реализация кода основана на ссылку21. Мы предлагаем комплект программного обеспечения и образцовые данные на нашем сайте для того, чтобы следовать разделы 5 и 6 настоящего Протокола (https://www.singlemolecule.uni-freiburg.de/software/3d-fret). Полное программное обеспечение предоставляется по запросу.
для первой точки время время трассировки. Методом максимального правдоподобия, эти параметры могут быть оптимизированы, чтобы лучше всего описать данные с вперед-назад и Баум-Уэлч алгоритмов20,21. Это дает оценок максимального правдоподобия (MLE). Наконец государство последовательность, которая скорее производится траектории наблюдений может быть выведено с Витерби алгоритм. В отличие от других анализов Хм smFRET данных24,,2526 мы не используем HMM как всего лишь «разглаживание» данных но экстракт кинетическая общегосударственной модели из набора данных без необходимости для установки времени задержки гистограммы27. HMM анализ делается с собственных скриптов с использованием Игорь Pro. Реализация кода основана на ссылку21. Мы предлагаем комплект программного обеспечения и образцовые данные на нашем сайте для того, чтобы следовать разделы 5 и 6 настоящего Протокола (https://www.singlemolecule.uni-freiburg.de/software/3d-fret). Полное программное обеспечение предоставляется по запросу.
Времени точек данных с PF < -1 или PF > 2 в любой канал обнаружения назначаются минимальные выбросы вероятность для всех государств (10-200). Это предотвращает искусственных переходы в этих точках данных.
Параметры для вероятностей выбросов получаются из fit 3D PF гистограммы с гауссова функций, как описано в шаге 5.7. Эти параметры хранятся фиксированной во время оптимизации Хм.
В представленный подход начальное состояние распределение вектора и матрицы перехода используются глобально описать весь ансамбль следов. Они обновляются на основе всех N молекул из набора данных по ссылке27.
Параметры запуска для распространения начального состояния определяются из 2D прогнозы PF гистограммы (шаг 5.3) и вероятности перехода устанавливаются 0,05 за исключением вероятность остаться в том же состоянии, которые выбираются такие что вероятность оставить определенного состояния нормализуется к единству.
Метод профилирования вероятность используется дать доверительные интервалы (ди) для всех перехода ставки21,22, которые служат в качестве значимых оценок их неопределенности. Для вычисления границы CI для конкретной скорости, вероятность перехода интерес фиксируется значение, отличное от ОМП. Это дает тест модель λ’. Соотношение (LR) тест вероятности вероятности 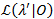 набора данных 0 выполняется согласно:
набора данных 0 выполняется согласно:
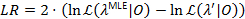
95% доверия, предназначенной для параметра достигается, когда LR превышает 3.841, 95% квантиль о x2-распределение с одной степенью свободы22,23.
Сила метода подтверждается с помощью Hsp90. Этот белок в изобилии встречается в бактерий и эукариот и является частью клеточного стресса ответ28. Это перспективные цели наркотиков в рака лечение29. Hsp90 является Антуану с один карман привязки нуклеотидов в N-концевой домен каждая субъединица30. Он может подвергнуться переходы между по крайней мере двух глобально собственный конформации, закрывается и один N-терминала открытым, V-образный конформации19,31,32. Димерной природы непосредственно поднимает вопрос о взаимосвязи между двумя сайтами привязки нуклеотидов в Hsp90.
В следующем, мы предоставляем пошаговые протокол для сбора и анализа данных эксперимента трехцветной smFRET дрожжи Hsp90 и нуклеотидов. Конформации зависимые привязки дневно обозначенные AMP-PNP (AMP-PNP *, не гидролизуется аналоговый АТФ) анализируется. Приложение описанная процедура позволяет исследование нуклеотида привязки и в то же время конформационные изменения Hsp90 и таким образом раскрывает кооперативность между двумя нуклеотидов привязки очагов Hsp90.
Protocol
Representative Results
Discussion
Мы представляем экспериментальная процедура получения трехцветных smFRET данных для сложных белков системы и пошаговое описание анализа этих измерений. Этот подход предоставляет уникальную возможность непосредственно оценить взаимосвязь между несколькими взаимодействия сайтов или к…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Эта работа финансируется немецкого фонда научных исследований (INST 39/969-1) и Европейский исследовательский совет через соглашение грантов ЕИС n. 681891.
Materials
| Setup | |||
| vibration-damped optical table | Newport, Irvine, CA, USA | RS2000 | |
| OBIS 473nm LX 75mW LASER | Coherent Inc, Santa Clara, CA, USA | 1185052 | |
| OBIS 532nm LS 50mW LASER | Coherent Inc, Santa Clara, CA, USA | 1261779 | |
| OBIS 594nm LS 60mW LASER | Coherent Inc, Santa Clara, CA, USA | 1233470 | |
| OBIS 637nm LX 140mW LASER | Coherent Inc, Santa Clara, CA, USA | 1196625 | |
| laser control unit | Coherent Inc, Santa Clara, CA, USA | 1234465 | Scientific Remote |
| aspheric telescope lenses | Thorlabs Inc, Newton, New Jersey, USA | d=25.4mm, f=50mm and f=100mm | |
| CF ex1 | AHF analysentechnik AG, Tübingen, Germany | ZET 473/10 | cleanup filter excitation |
| CF ex2 | AHF analysentechnik AG, Tübingen, Germany | ZET 532/10 | cleanup filter excitation |
| CF ex3 | AHF analysentechnik AG, Tübingen, Germany | ZET 594/10 | cleanup filter excitation |
| CF ex4 | Thorlabs Inc, Newton, New Jersey, USA | FL635-10 | cleanup filter excitation |
| DM ex1 | AHF analysentechnik AG, Tübingen, Germany | ZQ594RDC | dichroic mirror excitation |
| DM ex2 | AHF analysentechnik AG, Tübingen, Germany | 570DCXR | dichroic mirror excitation |
| DM ex3 | AHF analysentechnik AG, Tübingen, Germany | ZQ491RDC | dichroic mirror excitation |
| AOTFnC-Vis | AA Opto-Electronic, Orsay, France | ||
| λ/4 plate | Thorlabs Inc, Newton, New Jersey, USA | AQWP05M-600 | |
| CFI Apo TIRF 100x | Nikon Instruments Inc, Melville, NY, USA | high-NA objective | |
| piezo focus positioner MIPOS 250 CAP | piezosystem jena GmbH, Jena, Germany | Piezo Controller NV 40/1 CLE | |
| piezo stepper | Newport, Irvine, CA, USA | PZA12 | PZC200-KT NanoPZ Actuator Kit |
| achromatic aspheric lenses | Qioptiq Photonics GmbH & Co. KG, Göttingen, Germany | G322-304-000 | d=50mm, f=200mm |
| adjustable optical slit | Owis GmbH, Staufen i. Br., Germany | 27.160.1212 | max. aperture 12 x 12 mm |
| DM det1 | AHF analysentechnik AG, Tübingen, Germany | T 600 LPXR | dichroic mirror detection |
| DM det2 | AHF analysentechnik AG, Tübingen, Germany | H 560 LPXR superflat | dichroic mirror detection |
| DM det3 | AHF analysentechnik AG, Tübingen, Germany | HC BS R635 | dichroic mirror detection |
| BP det1 | AHF analysentechnik AG, Tübingen, Germany | 525/40 BrightLine HC | bandpass filter detection |
| BP det2 | AHF analysentechnik AG, Tübingen, Germany | 586/20 BrightLine HC | bandpass filter detection |
| BP det3 | AHF analysentechnik AG, Tübingen, Germany | 631/36 BrightLine HC | bandpass filter detection |
| BP det4 | AHF analysentechnik AG, Tübingen, Germany | 700/75 ET Bandpass | bandpass filter detection |
| optical shutters detection | Vincent Associates, Rochester, NY, USA | Uniblitz VS25S2T0 | |
| EMCCD iXon Ultra 897 | Andor Technology Ltd, Belfast, Northern Ireland | ||
| digital I/O card, PCIe-6535 | National Instruments, Austin, Texas, USA | ||
| syringe pump | Harvard Apparatus, Holliston, MA, USA | PHD22/2000 | |
| Name | Company | Catalog Number | Comments |
| Flow chamber | |||
| quartz slides | G. Finkenbeiner Inc, Waltham, MA, USA | Spectrosil2000, h=3mm | |
| TEGADERM film | 3M Deutschland GmbH, Neuss, Germany | 1626W | 10 x 12cm |
| spray adhesive | 3M Deutschland GmbH, Neuss, Germany | Photo Mount 050777 | |
| glycerol | Carl Zeiss AG, Oberkochen, Germany | Immersol G | |
| immersion oil | OLYMPUS EUROPA SE & CO. KG, Hamburg, Germany | IMMOIL-F30CC | |
| prism | Vogelsberger Quarzglastechnik GmbH, Hauzenberg, Germany | Suprasil1 | |
| aluminium prism holder | custom built | ||
| hollow setscrews | Thorlabs Inc, Newton, New Jersey, USA | with custom drilling | |
| Tygon S3 E-3603 tubing | neoLab Migge GmbH, Heidelberg, Germany | 2-4450 | ACF00001 |
| PTFE tubing | Bohlender GmbH, Grünsfeld, Germany | S1810-08 | |
| Name | Company | Catalog Number | Comments |
| Sample | |||
| yeast Hsp90 D61C, Q385C_biotin | UniProt ID P02829 | ||
| Maleimide derivatives of Atto488, Atto550 | ATTO-TEC GmbH, Siegen, Germany | ||
| AMP-PNP* | Jena Bioscience, Jena, Germany | γ-[(6-Aminohexyl)-imido]-AMP-PNP-Atto647N | |
| Fluospheres | Thermo Fisher Scientific, Waltham, MA, USA | F8764 | amine-modified, 0.2 μm, yellow-green fluorescent |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Andor Solis | Andor Technology Ltd, Belfast, Northern Ireland | version 4.30 | |
| LabVIEW | National Instruments, Austin, Texas, USA | version 2012, 32bit; misc. hardware control | |
| MDS control software | AA Opto-Electronic, Orsay, France | version 2.03a | |
| Coherent Connection | Coherent Inc, Santa Clara, CA, USA | version 3 | |
| Igor Pro | WaveMetrics Inc, Portland, OR, USA | version 6.37 |
References
- Nooren, I. M. A., Thornton, J. M. Diversity of protein-protein interactions. EMBO J. 22 (14), 3486-3492 (2003).
- Marsh, J. A., Teichmann, S. A. Structure, dynamics, assembly, and evolution of protein complexes. Annu Rev Biochem. 84, 551-575 (2015).
- Henzler-Wildman, K., Kern, D. Dynamic personalities of proteins. Nature. 450 (7172), 964-972 (2007).
- Hohng, S., Joo, C., Ha, T. Single-Molecule Three-Color FRET. Biophys J. 87 (2), 1328-1337 (2004).
- Person, B., Stein, I. H., Steinhauer, C., Vogelsang, J., Tinnefeld, P. Correlated movement and bending of nucleic acid structures visualized by multicolor single-molecule spectroscopy. ChemPhysChem. 10 (9-10), 1455-1460 (2009).
- Lee, J., Lee, S., Ragunathan, K., Joo, C., Ha, T., Hohng, S. Single-molecule four-color FRET. Angew Chem Int Ed. 49 (51), 9922-9925 (2010).
- Ratzke, C., Berkemeier, F., Hugel, T. Heat shock protein 90’s mechanochemical cycle is dominated by thermal fluctuations. Proc Natl Acad Sci U S A. 109 (1), 161-166 (2012).
- Ratzke, C., Hellenkamp, B., Hugel, T. Four-colour FRET reveals directionality in the Hsp90 multicomponent machinery. Nat Commun. 5, 4192 (2014).
- Götz, M., Wortmann, P., Schmid, S., Hugel, T. A Multicolor Single-Molecule FRET Approach to Study Protein Dynamics and Interactions Simultaneously. Methods Enzymol. 581, 487-516 (2016).
- Yengo, C. M., Berger, C. L. Fluorescence anisotropy and resonance energy transfer: Powerful tools for measuring real time protein dynamics in a physiological environment. Curr Opin Pharmacol. 10 (6), 731-737 (2010).
- Wortmann,P , ., Götz M, ., Hugel T , . Cooperative Nucleotide Binding in Hsp90 and Its Regulation by Aha1. Biophys J. 113, 1711-1718 (2017).
- Dörfler, T., Eilert, T., Röcker, C., Nagy, J., Michaelis, J. Structural Information from Single-molecule FRET Experiments Using the Fast Nano-positioning System. J Vis Exp. (120), e54782 (2017).
- Stephanopoulos, N., Francis, M. B. Choosing an effective protein bioconjugation strategy. Nature chemical biology. 7 (12), 876-884 (2011).
- Sánchez-Rico, C., Voith von Voithenberg, L., Warner, L., Lamb, D. C., Sattler, M. Effects of Fluorophore Attachment on Protein Conformation and Dynamics Studied by spFRET and NMR Spectroscopy. Chemistry (Weinheim an der Bergstrasse, Germany). , (2017).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nat Methods. 5 (6), 507-516 (2008).
- Lee, N. K., et al. Three-color alternating-laser excitation of single molecules: monitoring multiple interactions and distances. Biophys J. 92 (1), 303-312 (2007).
- Kapanidis, A. N., Lee, N. K., Laurence, T. A., Doose, S., Margeat, E., Weiss, S. Fluorescence-aided molecule sorting: analysis of structure and interactions by alternating-laser excitation of single molecules. Proc Natl Acad Sci U S A. 101 (24), 8936-8941 (2004).
- Hohlbein, J., Craggs, T. D., Cordes, T. Alternating-laser excitation: single-molecule FRET and beyond. Chem Soc Rev. 43 (4), 1156-1171 (2014).
- Hellenkamp, B., Wortmann, P., Kandzia, F., Zacharias, M., Hugel, T. Multidomain structure and correlated dynamics determined by self-consistent FRET networks. Nat Methods. 14, 174-180 (2017).
- Rabiner, L. R. A tutorial on hidden Markov models and selected applications in speech recognition. Proc IEEE. 77 (2), 257-286 (1989).
- Fink, G. A. . Markov Models for Pattern Recognition. , (2014).
- Giudici, P., Ryden, T., Vandekerkhove, P. Likelihood-Ratio Tests for Hidden Markov Models. Biometrics. 56 (3), 742-747 (2000).
- Visser, I., Raijmakers, M. E. J., Molenaar, P. C. M. Confidence intervals for hidden Markov model parameters. Br J Math Stat Psychol. 53 (2), 317-327 (2000).
- McKinney, S. A., Joo, C., Ha, T. Analysis of Single-Molecule FRET Trajectories Using Hidden Markov Modeling. Biophys J. 91 (5), 1941-1951 (2006).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L., Wiggins, C. H. Learning Rates and States from Biophysical Time Series: A Bayesian Approach to Model Selection and Single-Molecule FRET Data. Biophys J. 97 (12), 3196-3205 (2009).
- Greenfeld, M., Pavlichin, D. S., Mabuchi, H., Herschlag, D. Single Molecule Analysis Research Tool (SMART): an integrated approach for analyzing single molecule data. PLoS ONE. 7 (2), e30024 (2012).
- Schmid, S., Götz, M., Hugel, T. Single-Molecule Analysis beyond Dwell Times: Demonstration and Assessment in and out of Equilibrium. Biophys J. 111 (7), 1375-1384 (2016).
- Taipale, M., Jarosz, D. F., Lindquist, S. HSP90 at the hub of protein homeostasis: emerging mechanistic insights. Nat Rev Mol Cell Biol. 11 (7), 515-528 (2010).
- Trepel, J., Mollapour, M., Giaccone, G., Neckers, L. Targeting the dynamic HSP90 complex in cancer. Nat Rev Cancer. 10 (8), 537-549 (2010).
- Wayne, N., Bolon, D. N. Dimerization of Hsp90 is required for in vivo function. Design and analysis of monomers and dimers. J Biol Chem. 282 (48), 35386-35395 (2007).
- Ali, M. M. U., et al. Crystal structure of an Hsp90-nucleotide-p23/Sba1 closed chaperone complex. Nature. 440 (7087), 1013-1017 (2006).
- Southworth, D. R., Agard, D. A. Species-dependent ensembles of conserved conformational states define the Hsp90 chaperone ATPase cycle. Mol Cell. 32 (5), 631-640 (2008).
- Blanchard, S. C., Kim, H. D., Gonzalez, R. L., Puglisi, J. D., Chu, S. tRNA dynamics on the ribosome during translation. Proc Natl Acad Sci U S A. 101 (35), 12893-12898 (2004).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophys J. 94 (5), 1826-1835 (2008).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
- Rognoni, L., Stigler, J., Pelz, B., Ylänne, J., Rief, M. Dynamic force sensing of filamin revealed in single-molecule experiments. Proc Natl Acad Sci U S A. 109 (48), 19679-19684 (2012).
- Okumus, B., Wilson, T. J., Lilley, D. M. J., Ha, T. Vesicle encapsulation studies reveal that single molecule ribozyme heterogeneities are intrinsic. Biophys J. 87 (4), 2798-2806 (2004).
- Boukobza, E., Sonnenfeld, A., Haran, G. Immobilization in Surface-Tethered Lipid Vesicles as a New Tool for Single Biomolecule Spectroscopy. J Phys Chem B. 105 (48), 12165-12170 (2001).
- Levene, M. J., Korlach, J., Turner, S. W., Foquet, M., Craighead, H. G., Webb, W. W. Zero-mode waveguides for single-molecule analysis at high concentrations. Science. 299 (5607), 682-686 (2003).
- Panaretou, B., et al. ATP binding and hydrolysis are essential to the function of the Hsp90 molecular chaperone in vivo. EMBO J. 17 (16), 4829-4836 (1998).

