قياس التنفس عالي الدقة لتقييم الطاقة الحيوية في الخلايا والأنسجة باستخدام مقاييس التنفس القائمة على الغرفة والصفائح
Summary
أصبح تقييم الفسفرة التأكسدية باستخدام مقاييس التنفس عالية الدقة جزءا لا يتجزأ من التحليل الوظيفي للميتوكوندريا واستقلاب الطاقة الخلوية. هنا ، نقدم بروتوكولات لتحليل استقلاب الطاقة الخلوية باستخدام مقاييس التنفس عالية الدقة القائمة على الغرفة والصفائح الدقيقة ونناقش الفوائد الرئيسية لكل جهاز.
Abstract
يسمح قياس التنفس عالي الدقة (HRR) بمراقبة الفسفرة التأكسدية في الوقت الفعلي لتحليل حالات الطاقة الخلوية الفردية وتقييم مجمعات الجهاز التنفسي باستخدام بروتوكولات المعايرة بالتحليل الحجمي المتنوعة بين الركيزة وفك الاقتران (SUIT). هنا ، يتم توضيح استخدام جهازين لقياس التنفس عالي الدقة ، ويتم تقديم مجموعة أساسية من البروتوكولات المطبقة لتحليل الخلايا المستزرعة وألياف الهيكل العظمي وعضلة القلب والأنسجة الرخوة مثل الدماغ والكبد. يتم توفير بروتوكولات للخلايا والأنسجة المستزرعة لمقياس التنفس القائم على الغرفة والخلايا المستزرعة لمقياس التنفس القائم على الصفائح الدقيقة ، وكلاهما يشمل بروتوكولات التنفس القياسية. لأغراض المقارنة، يتم استخدام خلايا HEK293 المصممة من قبل كريسبر والتي تعاني من نقص في ترجمة الميتوكوندريا مما يسبب نقصا في الجهاز التنفسي المتعدد مع كلا الجهازين لإثبات العيوب الخلوية في التنفس. يسمح كل من مقياس التنفس بقياس شامل للتنفس الخلوي مع مزاياه التقنية وملاءمته اعتمادا على سؤال البحث والنموذج قيد الدراسة.
Introduction
تفي الميتوكوندريا بتوفير الطاقة الرئيسي وهي عضية مجزأة تساهم في عمليات الطاقة الحيوية والتمثيل الغذائي الخلوية الأساسية مثل ابتنائية النيوكليوتيدات والدهون والأحماض الأمينية والتكوين الحيوي لعنقود الحديد والكبريت وتتورط في إشارات مثل موت الخلايا المتحكم فيه1،2،3 . تساهم الطاقة الحيوية للميتوكوندريا من خلال الفسفرة التأكسدية في جميع العمليات الخلوية داخل الخلية تقريبا ، وبالتالي ، ترتبط اختلالات الميتوكوندريا ذات الأصل الأولي أو الثانوي بمجموعة واسعة من الحالات المرضية 4,5. خلل الميتوكوندريا لا ينطوي فقط على تغييرات في البنية أو كثافة الميتوكوندريا ولكن أيضا في جودة وتنظيم الجهاز التنفسي6. يشمل هذا العنصر النوعي التحكم في الركيزة ، وخصائص الاقتران ، والتعديلات اللاحقة للترجمة ، وديناميكيات cristae ، والمجمعات الفائقة التنفسية 7,8. لذلك ، فإن التحليل الدقيق للطاقة الحيوية الميتوكوندريا للنهج التجريبية والتشخيصية لتقييم استقلاب الطاقة للخلية مهم في الصحة والمرض.
الفسفرة التأكسدية للميتوكوندريا (OXPHOS) هي سلسلة من التفاعلات داخل الجهاز التنفسي أو نظام نقل الإلكترون (ETS) لتوليد الطاقة الخلوية من خلال الأدينوسين ثلاثي الفوسفات (ATP)9. تولد الخطوة متعددة الأنزيمات لتسخير الطاقة من تدفق الإلكترون عبر المجمعين الأول والثاني إلى المركب الرابع تدرج بروتون كهروكيميائي عبر غشاء الميتوكوندريا الداخلي ، يستخدم لاحقا لفسفرة ثنائي فوسفات الأدينوسين (ADP) إلى ATP عبر المركب V (F1FO ATP SYNTHASE) (الشكل 1A).
أولا ، يتم توليد حاملات ثنائية الإلكترونات خلال دورة ثلاثي الكربوكسيل (TCA) ، تحلل السكر ، وأكسدة البيروفات: نيكوتيناميد الأدينين ثنائي النوكليوتيد (NADH) وثنائي هيدروفلافين الأدينين ثنائي النوكليوتيد (FADH2). يتأكسد NADH في المركب I (نازعة هيدروجيناز NADH) ، حيث يتم نقل إلكترونين إلى الإنزيم المساعد Q (يتم تقليل الكينون إلى الكينول) ، بينما يتم ضخ البروتونات في الفضاء بين الأغشية (IMS). ثانيا ، المركب II (نازعة هيدروجيناز سكسينات) يؤكسد FADH2 ويغذي الإلكترونات إلى الإنزيم المساعد Q دون ضخ البروتونات. ثالثا ، في المركب الثالث (السيتوكروم ج أوكسيدوريدوكتاز) ، يتم نقل الإلكترونات من الإنزيم المساعد Q إلى السيتوكروم c بينما يتم ضخ البروتونات في IMS. رابعا ، ينقل السيتوكروم c الإلكترونات إلى المركب IV (Cytochrome c oxidase) ، وهو المركب الأخير لضخ البروتونات ، وحيث يعمل الأكسجين كمستقبل للإلكترون لاستيعاب البروتونات ، مما يشكل الماء في النهاية. هذا هو الأكسجين الذي تستهلكه الميتوكوندريا والذي يمكن قياسه بواسطة oxygraph. وأخيرا ، يتم استخدام البروتونات المتولدة من المركب I والمركب III و IV المعقد لتدوير V المعقد ، وبالتالي توليد ATP9.
الأهم من ذلك ، أن نقل الإلكترون لا يحدث فقط بطريقة خطية ، ويشار إليه بخلاف ذلك باسم سلسلة نقل الإلكترون. بدلا من ذلك ، يمكن نقل الإلكترونات إلى تجمع الإنزيم المساعد Q من خلال مسارات تنفسية متعددة وتسهيل تدفق الإلكترونات المتقاربة. على سبيل المثال ، يمكن أن تدخل ركائز NADH و Uccinate عبر المركب I و II المعقد ، على التوالي. يمكن التبرع بالإلكترونات الناتجة عن أكسدة الأحماض الدهنية عبر مركب فلافوبروتين الناقل للإلكترون. والواقع أن التحليل الشامل ل OXPHOS يتطلب نهجا شاملا مع ركائز الوقود المناسبة (الشكل 1 ألف).
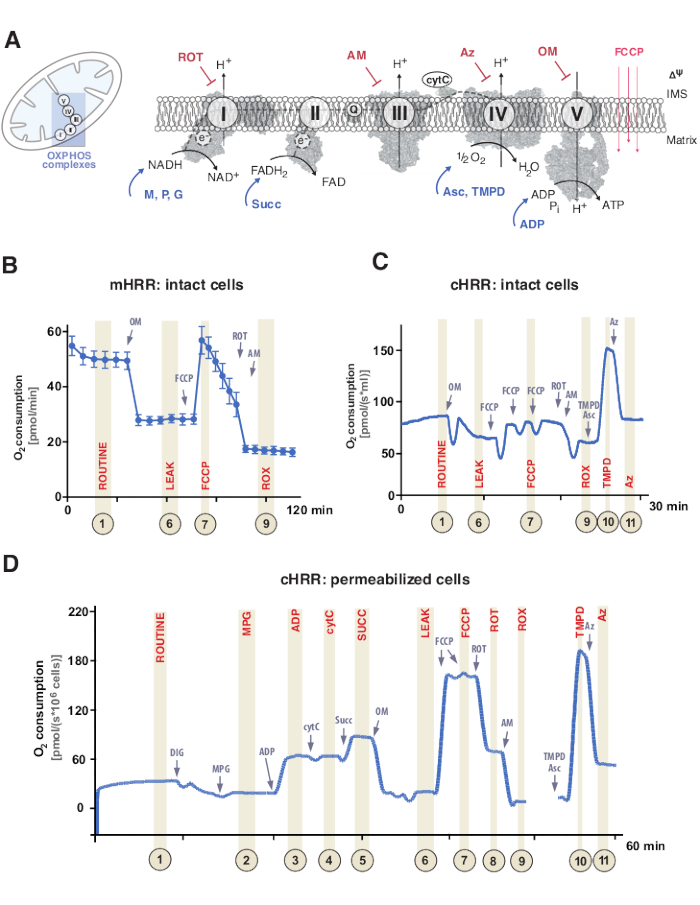
الشكل 1: الفسفرة التأكسدية للميتوكوندريا وبروتوكولات الركيزة والمثبطات المحددة. (أ) الميتوكوندريا ومخطط نظام نقل الإلكترون (CI-CIV) والميتوكوندريا F1F0 ATP synthase (CV). جميع الهياكل من PDB. الأرقام تصور فقط الركائز والمثبطات الموصوفة في هذه الدراسة). (ب) تتبع عينة من تدفق الأكسجين في خلايا HEK293 سليمة باستخدام بروتوكول قياسي في جهاز mHRR. (ج) تتبع عينة من تدفق الأكسجين في خلايا HEK293 سليمة باستخدام بروتوكول قياسي في جهاز cHRR. (د) تتبع عينة من تدفق الأكسجين في الخلايا الليفية البشرية المتخلل من متبرع سليم مع بروتوكول SUIT المعني. الاختصارات: 1 = التنفس الروتيني للخلايا السليمة. 2 = الدولة 2; 3 = الدولة 3 (طاء)؛ 4 = الحالة 3 (I) مع cytC ؛ 5 = الدولة 3 (I+II)؛ 6 = تسرب (OM); 7 = قدرة ETS; 8 = S (ROT) ؛ 9 = ROX; 10 = TMPD; 11 = Az. ROT = روتينون, AM = أنتيمايسين, ATP = أدينوسين ثلاثي الفوسفات, Az = أزيد, OM = أوليغومايسين, FCCP = سيانيد الكربونيل p-trifluoro-methoxyphenyl-hydrazone; Asc = أسكوربات، TMPD = N,N,N′,N′-رباعي ميثيل-P-فينيلينديامين، سوك = سكسينات، M = مالات، P = بيروفات، ADP = ثنائي فوسفات الأدينوزين، NAD = نيكوتيناميد الأدينين ثنائي النوكليوتيد، IMS = الفضاء بين الأغشية، FAD = فلافين الأدينين ثنائي النوكليوتيد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
أصبح تحليل قدرة الميتوكوندريا OXPHOS باستخدام HRR طريقة كيميائية حيوية مفيدة ذات قيمة تشخيصية ليس فقط لعيوب الميتوكوندريا الأولية 10,11 ولكن تمتد إلى جميع مجالات البيولوجيا الأخرى مثل السرطان والشيخوخة12. يسمح HRR بتحديد التنفس الخلوي عن طريق تحليل قدرة OXPHOS للميتوكوندريا ، والتي تعكس بشكل مباشر نقص مجمع الجهاز التنفسي الفردي أو المشترك للميتوكوندريا ، ويرتبط بشكل غير مباشر بالخلل الوظيفي الخلوي وتغيير استقلاب الطاقة9. من الناحية المنهجية ، يتم إجراء قياسات التنفس باستخدام الخلايا أو الأنسجة أو الميتوكوندريا المعزولة11،13،14 ، مع المواد المجمدة المناسبة جزئيا فقط15،16. يظهر أن الأنسجة المجمدة لديها ETS سليمة مع الحفاظ على استقرار فائق التعقيد15. وبالتالي ، على عكس وسيطات TCA التقليدية ، يتم تغذية الركائز المعنية مباشرة في ETS. ومع ذلك ، يتم فقدان الاقتران بين ETS و ATP التوليف حيث يتم اختراق سلامة الغشاء من خلال تلف التجميد (تكوين بلورة الجليد).
عادة ما تتم تجارب التنفس عند درجة حرارة فسيولوجية تبلغ 37 درجة مئوية للحرارة الداخلية في الخلايا أو الأنسجة غير المتخلل أو المتغلغل. في حين أن الأول يأخذ في الاعتبار السياق الأيضي الخلوي ، فإن الأخير يوفر المساهمة النشطة لمجمعات OXPHOS الفردية و ATPase من خلال إضافة ركائز محددة (ومثبطات). أدى تسلسل وتباين الركائز والمثبطات إلى تطوير مجموعة متنوعة من بروتوكولات SUIT17 والمقايسات 18 لمعالجة مختلف المسائل العلمية لوظيفة OXPHOS (تمت مراجعتها تحت12). يقيم البروتوكول الأساسي للتنفس الخلوي أربع حالات مختلفة: أ) التنفس الروتيني – التنفس في وسائط التنفس المعنية دون أي إضافة للركائز أو المثبطات التي تستهلك ركائز داخلية المنشأ. يمكن أن تكشف هذه الحالة عن عيوب OXPHOS العامة أو عيوب التنفس الناجمة عن الثانوية ، على سبيل المثال ، بسبب تغيير ملامح الأيض. بعد ذلك ، تكشف إضافة مثبط ATPase oligomycin عن نفاذية غشاء الميتوكوندريا الداخلي للبروتونات ، والتي تعرف بأنها ii) تنفس التسرب. يسمح المعايرة اللاحقة للبروتونوفور مثل سيانيد الكربونيل غير المقترن p-trifluoro-methoxyphenyl-hydrazone (FCCP) بتحديد الحالة التي تكون فيها قدرة ETS قصوى في وضع دائرة البروتون المفتوحة عبر الغشاء ، والتي تعرف بأنها iii) التنفس غير المقترن. الأهم من ذلك ، يمكن أن تحدث حالة غير مقترنة أيضا عن طريق التدخلات التجريبية من خلال الأضرار الميكانيكية المفرطة لأغشية الميتوكوندريا. على العكس من ذلك ، تشير الحالة غير المقترنة إلى فك الارتباط التنفسي بواسطة آلية جوهرية يتم التحكم فيها من الناحية الفسيولوجية. وأخيرا، فإن التثبيط الكامل ل ETS بإضافة مضاد المايسين المثبط الثالث المعقد ومثبط الروتينون المعقد I يحدد استهلاك الأكسجين المتبقي (ROX) من العمليات غير المستهلكة للأكسجين الميتوكوندريا (الشكل 1A-C).
تتكون الطاقة الحيوية للميتوكوندريا من خمس حالات تنفس متميزة19,20. الحالة 1 التنفس بدون أي ركائز إضافية أو ADP ، باستثناء ما هو متاح داخليا. بعد إضافة ADP ، ولكن لا يزال ، لا توجد ركائز ، يتم تحقيق التنفس الحالة 2. عند إضافة الركائز ، مما يسمح بنقل الإلكترون وتخليق ATP ، يتم الوصول إلى التنفس في الحالة 3. في هذه الحالة ، يمكن تحديد قدرة OXPHOS عند التركيزات المشبعة من ADP ، والفوسفات غير العضوي ، والأكسجين ، والركائز المرتبطة ب NADH والسكسينات. يمكن تعريف التنفس في الحالة 4 أو التنفس LEAK على أنه حالة بدون ADP أو سينثاز ATP مثبط كيميائيا مع وجود ركائز كافية. أخيرا ، عندما يتم استنفاد كل الأكسجين (نقص الأكسجين) في إعداد غرفة مغلقة ، يلاحظ تنفس الحالة 5.
توجد عدة طرق لتقييم حالات الطاقة الخلوية14 مع جهازين يهيمنان على التقييم الحالي في الوقت الفعلي ل OXPHOS من خلال تحليل استهلاك الأكسجين ، ويتم قياسه كوظيفة لانخفاض الأكسجين بمرور الوقت في نظام غرفة مغلقة مع قابلية تطبيق مختلفة تعتمد على النموذج التجريبي وسؤال البحث: مقياس التنفس عالي الدقة Oroboros 2k ومحلل التدفق خارج الخلية Seahorse XF. يسجل كلا الجهازين معدلات استهلاك الأكسجين كانخفاض في البيكومولات (pmol) من الأكسجين (O2) في الثانية كقيمة مطلقة داخل الغرفة أو بئر microplate. يتم الحصول على استهلاك الأكسجين المحدد لكل كتلة عن طريق تطبيع استهلاك الأكسجين المعني في وصفة عازلة محددة لكل عدد من الخلايا (الملايين) أو وزن الأنسجة (ملغ) أو كمية البروتين.
O2k (Oroboros Instruments) هو نظام مغلق من غرفتين مجهز بمستشعر أكسجين بولوغرافي (يختصر باسم مقياس التنفس عالي الدقة القائم على الغرفة: cHRR). تحتوي كل غرفة تجريبية على 2 مل من السائل الذي يتم الاحتفاظ به متجانسا بواسطة أجهزة التقليب المغناطيسية. يستخدم مستشعر الأكسجين القطبي نهجا أمبيرومتري لقياس الأكسجين: فهو يحتوي على كاثود الذهب ، وأنود كلوريد الفضة / الفضة ، وبين محلول KCI الذي يخلق خلية كهروكيميائية يتم تطبيق الجهد عليها (0.8 فولت). ينتشر الأكسجين من وسط الفحص من خلال غشاء بروبيلين الإيثيلين المفلور 25 ميكرومتر (O 2-permeable) ويخضع للتخفيض عند الكاثود ، مما ينتج بيروكسيد الهيدروجين. في الأنود ، تتأكسد الفضة بواسطة بيروكسيد الهيدروجين ، مما يولد تيارا كهربائيا. يرتبط هذا التيار الكهربائي (الأمبير) خطيا بضغط الأكسجين الجزئي. يتم استخدام الضغط الجزئي للأكسجين وعامل ذوبان الأكسجين في وسط الفحص لحساب تركيز الأكسجين. نظرا لأن الضغط الجزئي للأكسجين يعتمد على درجة الحرارة التجريبية والقياسات المستقطبة حساسة لدرجة الحرارة ، فإن التقلبات في درجة الحرارة تحتاج إلى تنظيم دقيق (±0.002 درجة مئوية) بواسطة كتلة تسخين بلتييه. يمكن التحكم في درجة الحرارة ضمن نطاق 4 درجات مئوية و 47 درجة مئوية.
محلل التدفق خارج الخلية Seahorse XF (Agilent) هو نظام قائم على الألواح بتنسيق صفيحة دقيقة من 24 أو 96 بئرا حيث تقوم ثلاثة أقطاب كهربائية فلورية بقياس استهلاك الأكسجين بمرور الوقت في كل بئر (يختصر باسم مقياس التنفس عالي الدقة القائم على الصفائح الدقيقة: mHRR). يتوفر أربعة منافذ كحد أقصى في خرطوشة الفحص للحقن التلقائي أثناء الفحص. يحتوي الفحص على دورات متعددة ، لكل منها ثلاث مراحل: 1) الخلط ، 2) الانتظار ، و 3) القياس. خلال مرحلة القياس ، يتم خفض مجسات الاستشعار في الصفيحة الدقيقة مما يخلق غرفة مغلقة مؤقتا تحتوي على حجم 7-10 ميكرولتر لقياس الضوء المنبعث. ينبعث هذا الضوء من الفلوروفورات المدمجة في البوليمر على طرف مجسات المستشعر ، والتي تستشعر O2 بناء على تبريد الفوسفور. تتناسب شدة إشارة التألق مع O2 وتتأثر بدرجة حرارة المستشعر ووسط الفحص. لذلك ، يتطلب تقدير الأكسجين الدقيق نهجا نسبيا مع خلفية جيدة دون أي عينة. تحدث استعادة تركيز الأكسجين أثناء مرحلة الخلط عندما يتحرك المستشعر لأعلى ولأسفل لخلط الحجم فوق الغرفة المؤقتة. تحسب كل دورة معدل استهلاك أكسجين واحد. يمكن التحكم في درجة الحرارة ضمن نطاق 16 درجة مئوية و 42 درجة مئوية.
HRR هو المعيار الذهبي لتقييم الطاقة الحيوية الخلوية في الأمراض الأولية والمرتبطة بالميتوكوندريا والتمثيل الغذائي الخلوي العام. في هذه الدراسة ، يتم توفير البروتوكولات الأساسية ل HRR لتقييم وظيفة OXPHOS في الخلايا والأنسجة.
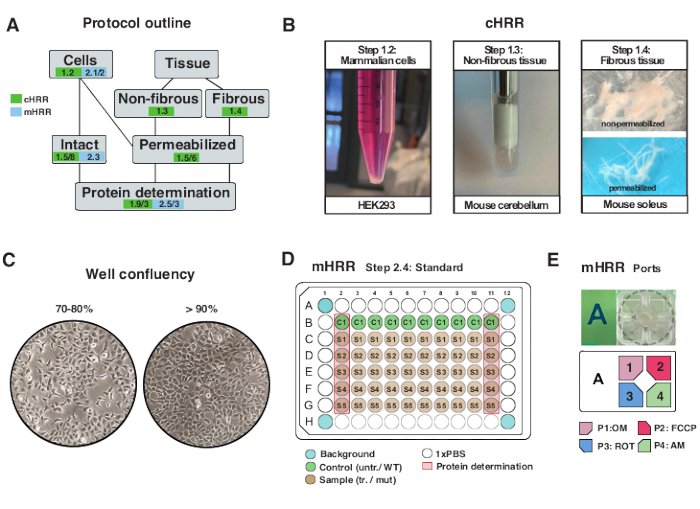
الشكل 2: سير العمل لتحضير الخلايا والأنسجة ل cHRR ، وإعداد الخلايا لقياس التنفس mHRR . (أ) مخطط البروتوكولات المقدمة. (ب) خلايا الثدييات (الخطوة 1.2): حبيبة HEK293 تساوي 3 × 106 خلايا (اللوحة اليسرى). الأنسجة غير الليفية (الخطوة 1.3): تحضير محللات المخيخ الفئرانية في 2 مل من بوتر تفلون (اللوحة الوسطى). نفاذية العضلات الهيكلية التي يسببها الصابونين (الخطوة 1.4) اللوحة اليمنى) لقياس التنفس cHRR. (ج) تخطيط بذر الصفائح الدقيقة القياسي (الخطوة 2.4) وفحص الالتقاء لتحليل الخلايا حقيقية النواة (HEK293) لقياس التنفس mHRR. (دال، هاء) مخطط تحميل منفذ الحقن لقياس التنفس mHRR (الخطوة 2.4). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
تقليديا ، تمت دراسة الطاقة الحيوية الميتوكوندريا باستخدام أقطاب الأكسجين من نوع كلارك. غير أن الافتقار إلى القرار والإنتاجية يبرر التقدم التكنولوجي. حتى الآن ، تم اعتماد O2k (المشار إليه باسم cHRR) و Seahorse XF96 Flux Analyzer (المشار إليه باسم mHRR) على نطاق واسع في مجال الطاقة الحيوية الخلوية. هنا ، نقدم م…
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا العمل بتمويل من أكاديمية فنلندا (C.B.J) ، ومؤسسة Magnus Ehrnroot (C.B.J) ، وزمالة الدكتوراه من كلية الدراسات العليا المتكاملة لعلوم الحياة (R.A).
Materials
| 2 mL Potter-Elvehjem Glass/PTFE Tissue Grinder/Homogenizer | Omni International | 07-358029 | |
| 95% O2, 5% CO2 medical gas mixture | Potter for tissue grinding | ||
| ADP | Sigma | A 4386 | |
| Antimycin A | Sigma | A 8674 | Chemical |
| Ascorbate | Merck | PHR1279-1G | Chemical, dissolve in ethanol |
| BSA (fatty accid free) | Sigma | A 6003 | Chemical |
| CaCO3 | Sigma | C 4830 | Chemical |
| Cytochrome c | Sigma | C 7752 | Chemical |
| Digitonin | Sigma | D 5628 | Chemical |
| Dithiothreitol | Sigma | D 0632 | Chemical, dissolve in DMSO |
| D-Sucrose | Roth | 4621.1 | Chemical |
| Dulbecco’s modified Eagle’s medium (High glucose) | Fisher Scientific | 41965-039 | Chemical |
| Dulbecco’s modified Eagle’s medium (No Glucose) | Fisher Scientific | A14430-01 | |
| EGTA | Sigma | E 4378 | |
| Etomoxir | Sigma | E1905 | Chemical |
| Falcon 15 ml Conical Centrifuge Tubes | Fisher Scientific | AM12500 | Chemical |
| Falcon 50 ml Conical Centrifuge Tubes | Fisher Scientific | AM12501 | |
| FCCP | Sigma | C 2920 | |
| Glucose | Sigma | G7021 | Chemical, dissolve in ethanol |
| Glutamate | Sigma | G 1626 | Chemical |
| GlutaMax (100x) (200 nM L-alanyl-L-glutamine dipeptide) | Fisher Scientific | 35050061 | Chemical |
| HEK293 cells | ATTC | CRL-1573 | |
| Hemocytometer | Fisher Scientific | 0267151B | Instrument for cell counting |
| Hepes | Sigma | H 7523 | Chemical |
| Imidazole | Fluka | 56750 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| L-carnitine | Sigma | C0283 | Chemical |
| Malate | Sigma | M 1000 | Chemical |
| MES hydrate | Sigma | M8250 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Na2ATP | Sigma | A 2383 | Chemical |
| Na2Phosphocreatine | Sigma | P 7936 | Chemical |
| Na-pyruvate (100 mM) (100x) | Fisher Scientific | 11360070 | |
| NEAA (Non-essential amino acids) 100x | Fisher Scientific | 11140035 | |
| Normal FBS (10x) | Fisher Scientific | 10500064 | |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| O2k-Titration Set | Oroboros Instruments | 20820-03 | Hamilton syringes for chemical injections |
| Oligomycin | Sigma | O 4876 | Chemical, dissolve in ethanol |
| Palmitoylcarnitine | Sigma | P 4509 | Chemical |
| Penicillin-Streptomycin | Fisher Scientific | 15140122 | |
| Pierce BCA Protein Assay Kit | Fisher Scientific | 23227 | |
| Pyruvate | Sigma | P 2256 | Chemical |
| RIPA-Buffer | Fisher Scientific | 89900 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Saponin | Sigma | S7900 | Chemical |
Seahorse XF DMEM assay medium pack, pH 7.4 |
Agilent, Santa Clara, CA |
103680-100 | |
| Seahorse XFe96 Extracellular Flux Analyzer | Agilent, Santa Clara, CA |
High-throughput respirometry instrument | |
| Seahorse XFe96 FluxPak | Agilent, Santa Clara, CA |
Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
|
| Small scissors | Fisher Scientific | 08-951-20 | |
| Sodium azide | Sigma | S2002 | Chemical |
| Succinate | Sigma | S 2378 | Chemical |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
| Trypan Blue solution | Merck | 72-57-1 | Chemical |
| Trypsin 0.25% EDTA | Fisher Scientific | 25200056 | |
| Two thin-edged forceps | Fisher Scientific | 12-000-122 | |
| Uridine stock (500x) | Sigma | U3750 | Chemical |
References
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Mehta, M. M., Weinberg, S. E., Chandel, N. S. Mitochondrial control of immunity. Beyond ATP. Nature Reviews Immunology. 17 (10), 608-620 (2017).
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle. New perspectives of mitochondrial physiology. International Journal of Biochemistry and Cell Biology. 41 (10), 1837-1845 (2009).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 1-23 (2016).
- Boushel, R., Gnaiger, E., Schjerling, P., Skovbro, M., Kraunsøe, R., Dela, F. Patients with type 2 diabetes have normal mitochondrial function in skeletal muscle. Diabetologia. 50 (4), 790-796 (2007).
- Cogliati, S., et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13, 1-11 (2015).
- Gnaiger, E. Mitochondrial pathways and Respiratory control. An introduction to OXPHOS analysis. Bioenergetics communications. 5th ed. , (2020).
- Jackson, C. B., et al. Mutations in SDHD lead to autosomal recessive encephalomyopathy and isolated mitochondrial complex II deficiency. Journal of Medical Genetics. 51 (3), 170-175 (2014).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- Doerrier, C., Garcia-Souza, L. F., Krumschnabel, G., Wohlfarter, Y., Mészáros, A. T., Gnaiger, E. High-resolution fluorespirometry and oxphos protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7 (6), 1068-1085 (2012).
- García-Roche, M., Casal, A., Carriquiry, M., Radi, R., Quijano, C., Cassina, A. Respiratory analysis of coupled mitochondria in cryopreserved liver biopsies. Redox Biology. 17, 207-212 (2018).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. The EMBO Journal. 39 (13), 1-18 (2020).
- Cell metabolism assay kits. Seahorse assay kits and media Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-lits-reagents-cell-assay-media (2021)
- Chance, B., Williams, G. R. A method for the localization of sites for oxidative phosphorylation. Nature. 176 (4475), 250-254 (1955).
- Gnaiger, E., et al. Mitochondrial respiratory states and rates. MitoFit Preprint Arch. , (2019).
- Gnaiger, E. O2k-procedures: SOP O2k quality control 1: Polarographic oxygen sensors and accuracy of calibration Section Page. Oroboros. 03 (18), 1-21 (2020).
- Robinson, B. H., Petrova-Benedict, R., Buncic, J. R., Wallace, D. C. Nonviability of cells with oxidative defects in galactose medium: A screening test for affected patient fibroblasts. Biochemical Medicine and Metabolic Biology. 48 (2), 122-126 (1992).
- King, M. P., Attardi, G. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Fasching, M., Gnaiger, E. O2k quality control 2: Instrumental oxygen background correction and accuracy of oxygen flux. Mitochondrial Physiology Network. 14 (06), 1-14 (2016).
- Gnaiger, E., Lassnig, B., Kuznetsov, A., Rieger, G., Margreiter, R. Excess capacity of cytochrome c oxidase. Journal of Experimental Biology. 1139, 1129-1139 (1998).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Fontana-Ayoub, M., Fasching, E., Gnaiger, Selected media and chemicals for respirometry with mitochondrial preparations. Mitochondrial Physiology Network. 02 (17), 1-9 (2014).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods in Enzymology. 542, 163-181 (2014).
- Nászai, A., Terhes, E., Kaszaki, J., Boros, M., Juhász, L. Ca(2+)N it be measured? Detection of extramitochondrial calcium movement with high-resolution fluorespirometry. Scientific Reports. 9 (1), 1-13 (2019).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: From diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), 234 (2019).
- Mercier-Letondal, P., Marton, C., Godet, Y., Galaine, J. Validation of a method evaluating T cell metabolic potential in compliance with ICH Q2 (R1). Journal of Translational Medicine. 19 (1), 1-15 (2021).
- Sauerbeck, A., et al. Analysis of regional brain mitochondrial bioenergetics and susceptibility to mitochondrial inhibition utilizing a microplate based system. Journal of Neuroscience Methods. 198 (1), 36-43 (2011).
- Jackman, M. R., Willis, W. T. Characteristics of mitochondria isolated from type I and type IIb skeletal muscle. American Journal of Physiology – Cell Physiology. 270 (2), 673-678 (1996).
- Ponsot, E., et al. Mitochondrial tissue specificity of substrates utilization in rat cardiac and skeletal muscles. Journal of Cellular Physiology. 203 (3), 479-486 (2005).
- Schönfeld, P., Reiser, G. Why does brain metabolism not favor burning of fatty acids to provide energy-Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow and Metabolism. 33 (10), 1493-1499 (2013).
- Calderon-Dominguez, M., Mir, J. F., Fucho, R., Weber, M., Serra, D., Herrero, L. Fatty acid metabolism and the basis of brown adipose tissue function. Adipocyte. 5 (2), 98-118 (2016).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode. Current Protocols in Toxicology. 2014, 1-16 (2014).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using Seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), 21746 (2011).
- Jordá, A., Zaragozá, R., Portolés, M., Báguena-Cervellera, R., Renau-Piqueras, J. Long-term high-protein diet induces biochemical and ultrastructural changes in rat liver mitochondria. Archives of Biochemistry and Biophysics. 265 (2), 241-248 (1988).
- Jackson, C. B., Gallati, S., Schaller, A. QPCR-based mitochondrial DNA quantification: Influence of template DNA fragmentation on accuracy. Biochemical and Biophysical Research Communications. 423 (3), 441-447 (2012).
- Hirsch, H. M. Tissue autoxidation inhibitors: II. The presence of inhibitor in intact cells; Assay of liver and hepatoma effect on radio-oxidations. 암 연구학. 16 (11), 1076-1082 (1956).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), 18317 (2011).
- Tanumihardja, E., Slaats, R. H., Van Der Meer, A. D., Passier, R., Olthuis, W., Van Den Berg, A. Measuring both pH and O2 with a single On-Chip sensor in cultures of human pluripotent stem cell-derived cardiomyocytes to track induced changes in cellular metabolism. ACS Sensors. 6 (1), 267-274 (2021).
- Harms, F., Stolker, R. J., Mik, E. Cutaneous respirometry as novel technique to monitor mitochondrial function: A feasibility study in healthy volunteers. PLoS ONE. 11 (7), 159544 (2016).
- Levitsky, Y., et al. Micro-respirometry of whole cells and isolated mitochondria. RSC Advances. 9 (57), 33257-33267 (2019).

