Oda ve Plaka Tabanlı Respirometreler Kullanarak Hücrelerdeki ve Dokulardaki Biyoenerjetik Değerleri Değerlendirmek için Yüksek Çözünürlüklü Respirometri
Summary
Yüksek çözünürlüklü respirometreler kullanılarak oksidatif fosforilasyonun değerlendirilmesi, mitokondri ve hücresel enerji metabolizmasının fonksiyonel analizinin ayrılmaz bir parçası haline gelmiştir. Burada, oda ve mikroplaka tabanlı yüksek çözünürlüklü respirometreler kullanılarak hücresel enerji metabolizmasının analizi için protokoller sunuyoruz ve her cihazın temel faydalarını tartışıyoruz.
Abstract
Yüksek çözünürlüklü respirometri (HRR), bireysel hücresel enerji durumlarının analizi ve çeşitlendirilmiş substrat-unkuplör-inhibitör titrasyonu (SUIT) protokolleri kullanılarak solunum komplekslerinin değerlendirilmesi için oksidatif fosforilasyonun gerçek zamanlı olarak izlenmesine olanak tanır. Burada, iki yüksek çözünürlüklü respirometri cihazının kullanımı gösterilmiştir ve kültürlenmiş hücrelerin, iskelet ve kalp kası liflerinin ve beyin ve karaciğer gibi yumuşak dokuların analizi için geçerli temel bir protokol koleksiyonu sunulmaktadır. Kültürlenmiş hücreler ve dokular için protokoller, her ikisi de standart solunum protokollerini kapsayan oda bazlı bir respirometre ve mikroplaka tabanlı bir respirometre için kültürlenmiş hücreler için sağlanmıştır. Karşılaştırmalı amaçlar için, çoklu solunum sistemi eksikliğine neden olan mitokondriyal translasyonda eksik olan CRISPR mühendisliği HEK293 hücreleri, solunumdaki hücresel kusurları göstermek için her iki cihazla birlikte kullanılır. Her iki respirometre de, incelenen araştırma sorusuna ve modeline bağlı olarak ilgili teknik yararları ve uygunlukları ile hücresel solunumun kapsamlı bir şekilde ölçülmesine izin verir.
Introduction
Mitokondri, enerjinin temel hükmünü yerine getirir ve nükleotitlerin, lipitlerin ve amino asitlerin anabolizması, demir-kükürt kümesi biyogenezi gibi temel hücresel biyoenerjetik ve metabolik süreçlere katkıda bulunan bölümlere ayrılmış bir organeldir ve kontrollü hücre ölümü gibi sinyalleşmeye dahil edilir 1,2,3 . Oksidatif fosforilasyon yoluyla mitokondriyal biyoenerjetik maddeler, hücre içindeki hemen hemen tüm hücresel süreçlere katkıda bulunur ve sonuç olarak, birincil veya ikincil kökenli mitokondriyal işlev bozuklukları, geniş bir hastalık koşulları spektrumu ile ilişkilidir 4,5. Mitokondriyal disfonksiyon sadece yapı veya mitokondriyal yoğunluktaki değişiklikleri değil, aynı zamanda solunum sisteminin kalitesinde ve düzenlenmesinde de değişiklikler içerir6. Bu kalitatif eleman substrat kontrolünü, kuplaj özelliklerini, post-translasyonel modifikasyonları, krista dinamiklerini ve solunum süperkomplekslerini kapsar 7,8. Bu nedenle, hücrenin enerji metabolizmasını değerlendirmek için deneysel ve tanısal yaklaşımlar için mitokondriyal biyoenerjetik ilaçların doğru analizi sağlık ve hastalıkta önemlidir.
Mitokondriyal oksidatif fosforilasyon (OXPHOS), adenozin trifosfat (ATP)9 yoluyla hücresel enerji üretimi için solunum sistemi veya elektron transfer sistemi (ETS) içindeki bir dizi reaksiyondur. I ve II kompleksleri boyunca elektron akışından karmaşık IV’e kadar enerjiyi kullanmak için çok enzimatik adım, iç mitokondriyal membran boyunca bir elektrokimyasal proton gradyanı üretir ve daha sonra adenozin difosfatın (ADP) karmaşık V (F1FO ATP sentaz) yoluyla ATP’ye fosforilasyonu için kullanılır (Şekil 1A).
İlk olarak, trikarboksilik döngü (TCA), glikoliz ve piruvat oksidasyonu sırasında iki elektron taşıyıcıları üretilir: nikotinamid adenin dinükleotid (NADH) ve dihidroflavin adenin dinükleotid (FADH2). NADH, kompleks I’de (NADH dehidrojenaz) oksitlenir, bu sırada iki elektron koenzim Q’ya aktarılır (kinon kinol’e indirgenir), protonlar membranlar arası boşluğa (IMS) pompalanır. İkincisi, kompleks II (Süksinat dehidrojenaz) FADH2’yi oksitler ve protonları pompalamadan elektronları koenzim Q’ya besler. Üçüncüsü, kompleks III’te (Sitokrom c oksidoredüktaz), koenzim Q’dan gelen elektronlar sitokrom c’ye aktarılırken, protonlar IMS’ye pompalanır. Dördüncüsü, sitokrom c, elektronları protonları pompalamak için son kompleks olan ve oksijenin protonları asimile etmek için bir elektron alıcısı olarak işlev gördüğü ve sonuçta su oluşturan kompleks IV’e (Sitokrom c oksidaz) aktarır. Mitokondrinin tükettiği ve bir oksigrafla ölçülebilen bu oksijendir. Son olarak, karmaşık I, karmaşık III ve karmaşık IV’ten üretilen protonlar, karmaşık V’yi döndürmek için kullanılır, böylece ATP9 üretilir.
Önemli olarak, elektron transferi sadece doğrusal bir şekilde gerçekleşmez, aksi takdirde elektron taşıma zinciri olarak gösterilir. Bunun yerine, elektronlar çoklu solunum yolları aracılığıyla koenzim Q havuzuna aktarılabilir ve yakınsak elektron akışını kolaylaştırabilir. Örneğin NADH-substratları ve süksinat, sırasıyla karmaşık I ve karmaşık II yoluyla girebilir. Yağ asidi oksidasyonundan elde edilen elektronlar, elektron transfer flavoprotein kompleksi aracılığıyla bağışlanabilir. Gerçekten de, OXPHOS’un kapsamlı bir analizi, uygun yakıt substratları ile bütünsel bir yaklaşım gerektirir (Şekil 1A).
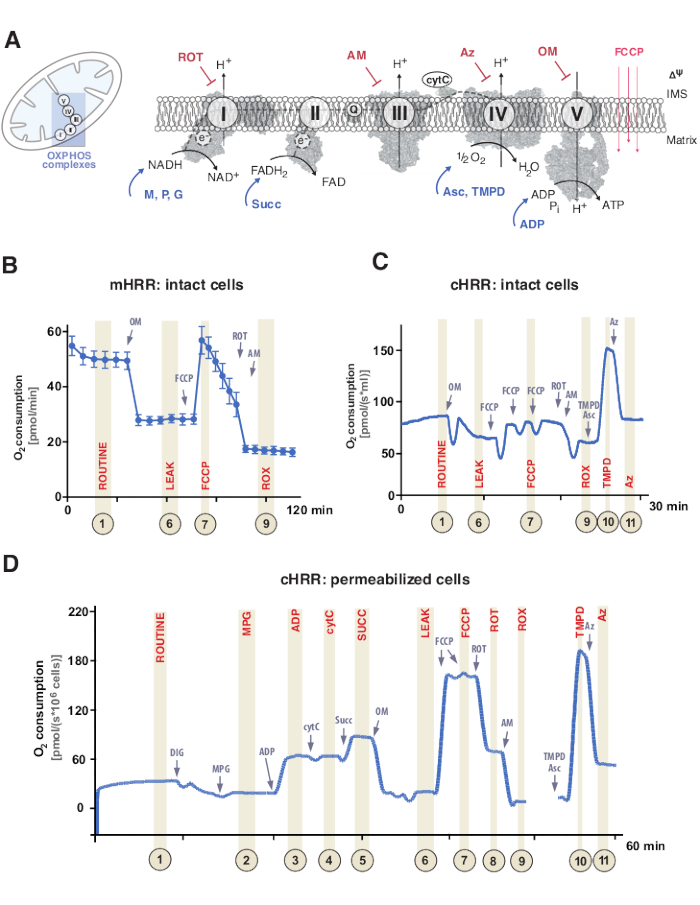
Şekil 1: Mitokondriyal oksidatif fosforilasyon ve spesifik substrat ve inhibitör protokolleri. (A) Mitokondri ve elektron transfer sisteminin şeması (CI-CIV) ve mitokondriyal F1F0 ATP sentaz (CV). Tüm yapılar PDB’dendir. Rakamlar sadece bu çalışmada açıklanan substratları ve inhibitörleri göstermektedir). (B) Bir mHRR cihazında standart protokol kullanarak bozulmamış HEK293 hücrelerinde oksijen akışının örnek izi. (C) Bir cHRR cihazında standart protokol kullanarak bozulmamış HEK293 hücrelerinde oksijen akışının örnek izi. (D) İlgili SUIT protokolüne sahip sağlıklı bir donörden geçirgenleştirilmiş insan fibroblastlarındaki oksijen akışının örnek izi. Kısaltmalar: 1 = Bozulmamış hücrelerin rutin solunumu; 2 = Devlet 2; 3 = Durum 3(I); 4 = cytC ile Durum 3(I); 5 = Durum 3 (I+II); 6 = Sızıntı (OM); 7 = ETS kapasitesi; 8 = S (ÇÜRÜKLÜK); 9 = ROX; 10 = TMPD; 11 = Az. ROT = Rotenon, = Antimisin, ATP = Adenozin trifosfat, Az = Azid, OM = Oligomisin, FCCP = Karbonil siyanür p-trifloro-metoksifenil-hidrazon; Asc = Askorbat, TMPD = N,N,N′,N′-tetrametil-p-fenilendiamin, Succ = Süksinat, M = Malat, P = Piruvat, ADP = Adenozin difosfat, NAD = Nikotinamid adenin dinükleotid, IMS = Membranlararası boşluk, FAD = Flavin adenin dinükleotid. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
HRR kullanılarak mitokondriyal OXPHOS kapasitesinin analizi, sadece primer mitokondriyal defektler10,11 için değil, kanser ve yaşlanma12 gibi biyolojinin diğer tüm alanlarına uzanan tanısal değeri olan enstrümantal bir biyokimyasal yöntem haline gelmiştir. HRR, bireysel veya kombine mitokondriyal solunum kompleksi eksikliğini doğrudan yansıtan ve dolaylı olarak hücresel işlev bozukluğu ve değişmiş enerji metabolizması9 ile ilişkili mitokondriyal OXPHOS kapasitesinin analizi ile hücresel solunumun belirlenmesine izin verir. Metodolojik olarak, solunum ölçümleri hücreler, doku veya izole mitokondri11,13,14 kullanılarak gerçekleştirilir, dondurulmuş materyal sadece kısmen uygun15,16 ile gerçekleştirilir. Dondurulmuş dokunun, süperkompleks stabilitesi korunmuş sağlam bir ETS’ye sahip olduğu gösterilmiştir15. Böylece, geleneksel TCA ara ürünlerinin aksine, ilgili substratlar doğrudan ETS’ye beslenir. Bununla birlikte, ETS ve ATP sentezi arasındaki bağlantı, membran bütünlüğü donma hasarı (buz kristali oluşumu) nedeniyle tehlikeye girdiğinden kaybolur.
Solunum deneyleri normalde geçirgenleşmemiş veya geçirgenleştirilmiş hücrelerde veya dokularda endotermler için 37 ° C’lik fizyolojik bir sıcaklıkta gerçekleşir. Birincisi sitozolik metabolik bağlamı göz önünde bulundururken, ikincisi, spesifik substratların (ve inhibitörlerin) eklenmesiyle bireysel OXPHOS komplekslerinin ve ATPaz’ın enerjik katkısını sağlar. Substratların ve inhibitörlerin dizilimi ve varyasyonu, OXPHOS fonksiyonunun çeşitli bilimsel sorularını ele almak için çeşitli SUIT protokolleri17 ve tahliller18’in geliştirilmesine yol açmıştır (12 altında gözden geçirilmiştir). Hücresel solunumun temel protokolü dört farklı durumu değerlendirir: i) rutin solunum – herhangi bir substrat veya inhibitör eklemeden ilgili solunum ortamındaki solunum, ancak endojen substratları tüketir. Bu durum, örneğin değiştirilmiş metabolit profillerinin neden olduğu genel OXPHOS veya ikincil kaynaklı solunum kusurlarını ortaya çıkarabilir. Daha sonra, ATPaz inhibitörü oligomisinin eklenmesi, iç mitokondriyal membranın protonlara geçirgenliğini ortaya çıkarır, ii) sızıntı solunumu olarak tanımlanır. Eşinsiz karbonil siyanür p-trifloro-metoksifenil-hidrazon (FCCP) gibi bir protonoforun müteakip titrasyonlanması, iii) ayrışmamış solunum olarak tanımlanan açık transmembranlı proton devre modunda ETS kapasitesinin maksimum olduğu durumun belirlenmesini sağlar. Önemli olarak, mitokondriyal membranlara aşırı mekanik hasar yoluyla deneysel müdahalelerle de ayrılmamış bir durum ortaya çıkabilir. Tersine, bağlanmamış durum, fizyolojik olarak kontrol edilen içsel bir mekanizma ile solunum ayrışmasını ifade eder. Son olarak, kompleks III inhibitörü antimisin ve kompleks I inhibitörü rotenonun eklenmesiyle ETS’nin tamamen inhibe edilmesi, mitokondriyal olmayan oksijen tüketen süreçlerden kalan oksijen tüketimini (ROX) belirler (Şekil 1A-C).
Mitokondriyal biyoenerjetik beş ayrı solunum durumundan oluşur19,20. Durum 1 solunum, endojen olarak mevcut olanlar dışında, herhangi bir ek substrat veya ADP içermez. ADP’nin eklenmesinden sonra, ancak yine de, hiçbir substrat yok, durum 2 solunumu elde edilir. Elektron transferine ve ATP sentezine izin veren substratlar eklendiğinde, durum 3 solunumuna ulaşılır. Bu durumda, OXPHOS kapasitesi ADP, inorganik fosfat, oksijen, NADH ve süksinat bağlantılı substratların doygunluk konsantrasyonlarında tanımlanabilir. Durum 4 solunumu veya LEAK solunumu, yeterli substratlara sahipken ADP’siz veya kimyasal olarak inhibe edilmiş ATP sentezleri olmayan bir durum olarak tanımlanabilir. Son olarak, kapalı bir oda ortamında tüm oksijen tükendiğinde (anoksik), durum 5 solunumu gözlenir.
Deneysel modele ve araştırma sorusuna bağlı olarak farklı uygulanabilirliğe sahip kapalı odacıklı bir sistemde zaman içinde oksijendeki azalmanın işlevi olarak ölçülen oksijen tüketiminin analizi yoluyla OXPHOS’un mevcut gerçek zamanlı değerlendirmesine hakim olan iki cihazla hücresel enerji durumlarını14 ile değerlendirmek için çeşitli yöntemler mevcuttur: Oroboros 2k yüksek çözünürlüklü respirometre ve Seahorse XF hücre dışı akı analizörü. Her iki cihaz da oksijen tüketim oranlarını, saniyede oksijen pikomollerinde (pmol) (O2) bir azalma olarak, oda veya mikroplaka kuyusu içinde mutlak bir değer olarak kaydeder. Kütle başına spesifik oksijen tüketimi, ilgili oksijen tüketiminin hücre sayısı (milyonlarca), doku ağırlığı (mg) veya protein miktarı başına belirli bir tampon tarifinde normalleştirilmesiyle elde edilir.
O2k (Oroboros Instruments), polarografik oksijen sensörü (oda tabanlı yüksek çözünürlüklü respirometre olarak kısaltılır: cHRR) ile donatılmış kapalı iki odacıklı bir sistemdir. Her deney odası, manyetik karıştırıcılar tarafından homojen tutulan 2 mL sıvı tutar. Polarografik oksijen sensörü, oksijeni ölçmek için amperometrik bir yaklaşım kullanır: altın bir katot, bir gümüş / gümüş klorür anot ve bir KCI çözeltisi arasında, üzerine bir voltajın (0.8 V) uygulandığı bir elektrokimyasal hücre oluşturur. Tahlil ortamından gelen oksijen, 25 μm florlu etilen propilen membrandan (O2-geçirgen) yayılır ve katotta indirgenerek hidrojen peroksit üretir. Anotta, gümüş hidrojen peroksit tarafından oksitlenir ve bir elektrik akımı üretir. Bu elektrik akımı (amper) doğrusal olarak kısmi oksijen basıncı ile ilişkilidir. Oksijen konsantrasyonunu hesaplamak için kısmi oksijen basıncı ve tahlil ortamının oksijen çözünürlük faktörü kullanılır. Oksijen kısmi basıncı deneysel sıcaklığa bağlı olduğundan ve polarografik ölçümler sıcaklığa duyarlı olduğundan, sıcaklıktaki dalgalanmalar bir Peltier ısıtma bloğu tarafından hassas (±0.002 ° C) düzenlemeye ihtiyaç duyar. Sıcaklık 4 °C ile 47 °C aralığında kontrol edilebilir.
Seahorse XF hücre dışı akı analizörü (Agilent), üç floresan elektrodunun her bir kuyucukta zaman içinde oksijen tüketimini ölçtüğü 24 veya 96 delikli mikroplaka formatına sahip plaka tabanlı bir sistemdir (mikroplaka tabanlı yüksek çözünürlüklü respirometre olarak kısaltılır: mHRR). Tahlil sırasında otomatik enjeksiyon için tahlil kartuşundaki maksimum dört port mevcuttur. Bir tahlil, her biri üç fazlı birden fazla döngü içerir: 1) karıştırma, 2) bekleme ve 3) ölçüm. Ölçüm aşamasında, sensör probları mikroplakaya indirilir ve yayılan ışığı ölçmek için 7-10 μL hacim içeren geçici olarak kapalı bir oda oluşturulur. Bu ışık, fosforesans söndürmeye dayalı olarakO2’yi algılayan sensör problarının ucundaki polimer gömülü floroforlar tarafından yayılır. Floresan sinyalinin yoğunluğuO2 ile orantılıdır ve sensörün ve tahlil ortamının sıcaklığından etkilenir. Bu nedenle, doğru oksijen tahmini, herhangi bir numune olmadan arka plan kuyusu ile göreceli bir yaklaşım gerektirir. Oksijen konsantrasyonunun geri kazanılması, karıştırma aşamasında, sensör geçici odanın üzerindeki hacmi karıştırmak için yukarı ve aşağı hareket ettiğinde gerçekleşir. Her döngü bir oksijen tüketim oranını hesaplar. Sıcaklık 16 °C ile 42 °C aralığında kontrol edilebilir.
HRR, primer ve mitokondri ile ilişkili hastalıklarda ve genel hücresel metabolizmada hücresel biyoenerjetik değerleri değerlendirmek için altın standarttır. Bu çalışmada, hücre ve dokularda OXPHOS fonksiyonunu değerlendirmek için HRR için temel protokoller sağlanmıştır.
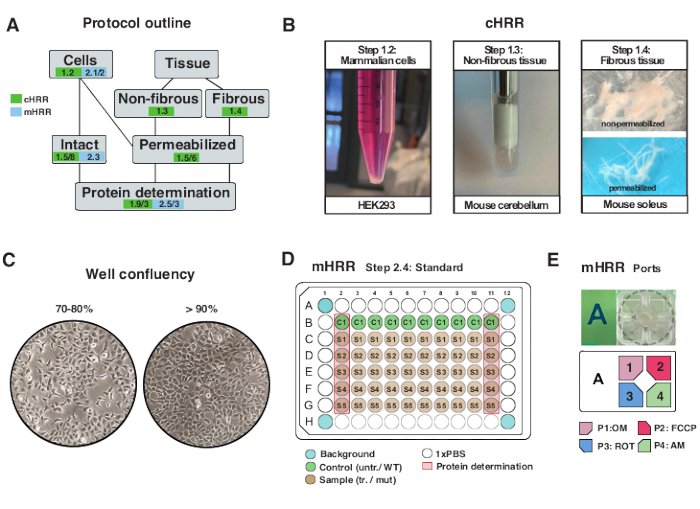
Şekil 2: cHRR için hücre ve doku preparatları için iş akışı ve mHRR respirometrisi için hücre hazırlığı . (A) Sağlanan protokollerin ana hatları. (B) Memeli hücreleri (adım 1.2): HEK293 pelet 3 x 106 hücreye eşittir (sol panel). Fibröz olmayan doku (adım 1.3): 2 mL Teflon çömlekçide (orta panel) murin beyincik lizatının hazırlanması. cHRR respirometrisi için saponun neden olduğu iskelet kası geçirgenliği (adım 1.4) sağ panel). (C) Standart mikroplaka tohumlama düzeni (adım 2.4) ve mHRR respirometrisi için ökaryotik hücrelerin (HEK293) analizi için akıcılık kontrolü. (D, E) mHRR respirometrisi için enjeksiyon port yükleme şeması (adım 2.4). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Geleneksel olarak, mitokondriyal biyoenerjetik Clark tipi oksijen elektrotları ile çalışılmıştır. Bununla birlikte, çözünürlük ve verim eksikliği, teknolojik ilerleme için garanti edildi. Bugüne kadar, O2k (cHRR olarak adlandırılır) ve Seahorse XF96 Akı Analizörü (mHRR olarak adlandırılır) hücresel biyoenerjetik alanında yaygın olarak benimsenmiştir. Burada, cHRR veya mHRR kullanarak mitokondriyal solunumun değerlendirilmesi yoluyla hücresel enerji metabolizmasının analizi için anlaşıl…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu çalışma, Finlandiya Akademisi (CBJ), Magnus Ehrnroot Vakfı (CBJ) ve Entegre Yaşam Bilimleri Enstitüsü (RA) Doktora bursu ile desteklenmiştir.
Materials
| 2 mL Potter-Elvehjem Glass/PTFE Tissue Grinder/Homogenizer | Omni International | 07-358029 | |
| 95% O2, 5% CO2 medical gas mixture | Potter for tissue grinding | ||
| ADP | Sigma | A 4386 | |
| Antimycin A | Sigma | A 8674 | Chemical |
| Ascorbate | Merck | PHR1279-1G | Chemical, dissolve in ethanol |
| BSA (fatty accid free) | Sigma | A 6003 | Chemical |
| CaCO3 | Sigma | C 4830 | Chemical |
| Cytochrome c | Sigma | C 7752 | Chemical |
| Digitonin | Sigma | D 5628 | Chemical |
| Dithiothreitol | Sigma | D 0632 | Chemical, dissolve in DMSO |
| D-Sucrose | Roth | 4621.1 | Chemical |
| Dulbecco’s modified Eagle’s medium (High glucose) | Fisher Scientific | 41965-039 | Chemical |
| Dulbecco’s modified Eagle’s medium (No Glucose) | Fisher Scientific | A14430-01 | |
| EGTA | Sigma | E 4378 | |
| Etomoxir | Sigma | E1905 | Chemical |
| Falcon 15 ml Conical Centrifuge Tubes | Fisher Scientific | AM12500 | Chemical |
| Falcon 50 ml Conical Centrifuge Tubes | Fisher Scientific | AM12501 | |
| FCCP | Sigma | C 2920 | |
| Glucose | Sigma | G7021 | Chemical, dissolve in ethanol |
| Glutamate | Sigma | G 1626 | Chemical |
| GlutaMax (100x) (200 nM L-alanyl-L-glutamine dipeptide) | Fisher Scientific | 35050061 | Chemical |
| HEK293 cells | ATTC | CRL-1573 | |
| Hemocytometer | Fisher Scientific | 0267151B | Instrument for cell counting |
| Hepes | Sigma | H 7523 | Chemical |
| Imidazole | Fluka | 56750 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| L-carnitine | Sigma | C0283 | Chemical |
| Malate | Sigma | M 1000 | Chemical |
| MES hydrate | Sigma | M8250 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Na2ATP | Sigma | A 2383 | Chemical |
| Na2Phosphocreatine | Sigma | P 7936 | Chemical |
| Na-pyruvate (100 mM) (100x) | Fisher Scientific | 11360070 | |
| NEAA (Non-essential amino acids) 100x | Fisher Scientific | 11140035 | |
| Normal FBS (10x) | Fisher Scientific | 10500064 | |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| O2k-Titration Set | Oroboros Instruments | 20820-03 | Hamilton syringes for chemical injections |
| Oligomycin | Sigma | O 4876 | Chemical, dissolve in ethanol |
| Palmitoylcarnitine | Sigma | P 4509 | Chemical |
| Penicillin-Streptomycin | Fisher Scientific | 15140122 | |
| Pierce BCA Protein Assay Kit | Fisher Scientific | 23227 | |
| Pyruvate | Sigma | P 2256 | Chemical |
| RIPA-Buffer | Fisher Scientific | 89900 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Saponin | Sigma | S7900 | Chemical |
Seahorse XF DMEM assay medium pack, pH 7.4 |
Agilent, Santa Clara, CA |
103680-100 | |
| Seahorse XFe96 Extracellular Flux Analyzer | Agilent, Santa Clara, CA |
High-throughput respirometry instrument | |
| Seahorse XFe96 FluxPak | Agilent, Santa Clara, CA |
Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
|
| Small scissors | Fisher Scientific | 08-951-20 | |
| Sodium azide | Sigma | S2002 | Chemical |
| Succinate | Sigma | S 2378 | Chemical |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
| Trypan Blue solution | Merck | 72-57-1 | Chemical |
| Trypsin 0.25% EDTA | Fisher Scientific | 25200056 | |
| Two thin-edged forceps | Fisher Scientific | 12-000-122 | |
| Uridine stock (500x) | Sigma | U3750 | Chemical |
References
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Mehta, M. M., Weinberg, S. E., Chandel, N. S. Mitochondrial control of immunity. Beyond ATP. Nature Reviews Immunology. 17 (10), 608-620 (2017).
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle. New perspectives of mitochondrial physiology. International Journal of Biochemistry and Cell Biology. 41 (10), 1837-1845 (2009).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 1-23 (2016).
- Boushel, R., Gnaiger, E., Schjerling, P., Skovbro, M., Kraunsøe, R., Dela, F. Patients with type 2 diabetes have normal mitochondrial function in skeletal muscle. Diabetologia. 50 (4), 790-796 (2007).
- Cogliati, S., et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13, 1-11 (2015).
- Gnaiger, E. Mitochondrial pathways and Respiratory control. An introduction to OXPHOS analysis. Bioenergetics communications. 5th ed. , (2020).
- Jackson, C. B., et al. Mutations in SDHD lead to autosomal recessive encephalomyopathy and isolated mitochondrial complex II deficiency. Journal of Medical Genetics. 51 (3), 170-175 (2014).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- Doerrier, C., Garcia-Souza, L. F., Krumschnabel, G., Wohlfarter, Y., Mészáros, A. T., Gnaiger, E. High-resolution fluorespirometry and oxphos protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7 (6), 1068-1085 (2012).
- García-Roche, M., Casal, A., Carriquiry, M., Radi, R., Quijano, C., Cassina, A. Respiratory analysis of coupled mitochondria in cryopreserved liver biopsies. Redox Biology. 17, 207-212 (2018).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. The EMBO Journal. 39 (13), 1-18 (2020).
- Cell metabolism assay kits. Seahorse assay kits and media Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-lits-reagents-cell-assay-media (2021)
- Chance, B., Williams, G. R. A method for the localization of sites for oxidative phosphorylation. Nature. 176 (4475), 250-254 (1955).
- Gnaiger, E., et al. Mitochondrial respiratory states and rates. MitoFit Preprint Arch. , (2019).
- Gnaiger, E. O2k-procedures: SOP O2k quality control 1: Polarographic oxygen sensors and accuracy of calibration Section Page. Oroboros. 03 (18), 1-21 (2020).
- Robinson, B. H., Petrova-Benedict, R., Buncic, J. R., Wallace, D. C. Nonviability of cells with oxidative defects in galactose medium: A screening test for affected patient fibroblasts. Biochemical Medicine and Metabolic Biology. 48 (2), 122-126 (1992).
- King, M. P., Attardi, G. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Fasching, M., Gnaiger, E. O2k quality control 2: Instrumental oxygen background correction and accuracy of oxygen flux. Mitochondrial Physiology Network. 14 (06), 1-14 (2016).
- Gnaiger, E., Lassnig, B., Kuznetsov, A., Rieger, G., Margreiter, R. Excess capacity of cytochrome c oxidase. Journal of Experimental Biology. 1139, 1129-1139 (1998).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Fontana-Ayoub, M., Fasching, E., Gnaiger, Selected media and chemicals for respirometry with mitochondrial preparations. Mitochondrial Physiology Network. 02 (17), 1-9 (2014).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods in Enzymology. 542, 163-181 (2014).
- Nászai, A., Terhes, E., Kaszaki, J., Boros, M., Juhász, L. Ca(2+)N it be measured? Detection of extramitochondrial calcium movement with high-resolution fluorespirometry. Scientific Reports. 9 (1), 1-13 (2019).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: From diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), 234 (2019).
- Mercier-Letondal, P., Marton, C., Godet, Y., Galaine, J. Validation of a method evaluating T cell metabolic potential in compliance with ICH Q2 (R1). Journal of Translational Medicine. 19 (1), 1-15 (2021).
- Sauerbeck, A., et al. Analysis of regional brain mitochondrial bioenergetics and susceptibility to mitochondrial inhibition utilizing a microplate based system. Journal of Neuroscience Methods. 198 (1), 36-43 (2011).
- Jackman, M. R., Willis, W. T. Characteristics of mitochondria isolated from type I and type IIb skeletal muscle. American Journal of Physiology – Cell Physiology. 270 (2), 673-678 (1996).
- Ponsot, E., et al. Mitochondrial tissue specificity of substrates utilization in rat cardiac and skeletal muscles. Journal of Cellular Physiology. 203 (3), 479-486 (2005).
- Schönfeld, P., Reiser, G. Why does brain metabolism not favor burning of fatty acids to provide energy-Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow and Metabolism. 33 (10), 1493-1499 (2013).
- Calderon-Dominguez, M., Mir, J. F., Fucho, R., Weber, M., Serra, D., Herrero, L. Fatty acid metabolism and the basis of brown adipose tissue function. Adipocyte. 5 (2), 98-118 (2016).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode. Current Protocols in Toxicology. 2014, 1-16 (2014).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using Seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), 21746 (2011).
- Jordá, A., Zaragozá, R., Portolés, M., Báguena-Cervellera, R., Renau-Piqueras, J. Long-term high-protein diet induces biochemical and ultrastructural changes in rat liver mitochondria. Archives of Biochemistry and Biophysics. 265 (2), 241-248 (1988).
- Jackson, C. B., Gallati, S., Schaller, A. QPCR-based mitochondrial DNA quantification: Influence of template DNA fragmentation on accuracy. Biochemical and Biophysical Research Communications. 423 (3), 441-447 (2012).
- Hirsch, H. M. Tissue autoxidation inhibitors: II. The presence of inhibitor in intact cells; Assay of liver and hepatoma effect on radio-oxidations. 암 연구학. 16 (11), 1076-1082 (1956).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), 18317 (2011).
- Tanumihardja, E., Slaats, R. H., Van Der Meer, A. D., Passier, R., Olthuis, W., Van Den Berg, A. Measuring both pH and O2 with a single On-Chip sensor in cultures of human pluripotent stem cell-derived cardiomyocytes to track induced changes in cellular metabolism. ACS Sensors. 6 (1), 267-274 (2021).
- Harms, F., Stolker, R. J., Mik, E. Cutaneous respirometry as novel technique to monitor mitochondrial function: A feasibility study in healthy volunteers. PLoS ONE. 11 (7), 159544 (2016).
- Levitsky, Y., et al. Micro-respirometry of whole cells and isolated mitochondria. RSC Advances. 9 (57), 33257-33267 (2019).

