Respirometria de alta resolução para avaliar bioenergésicos em células e tecidos usando respirômetros baseados em câmara e placas
Summary
Avaliar a fosforilação oxidativa usando respirômetros de alta resolução tornou-se parte integrante da análise funcional das mitocôndrias e do metabolismo de energia celular. Aqui, apresentamos protocolos para a análise do metabolismo de energia celular usando respirômetros de alta resolução baseados em câmara e microplatos e discutimos os principais benefícios de cada dispositivo.
Abstract
A respirometria de alta resolução (HRR) permite monitorar a fosforilação oxidativa em tempo real para análise de estados de energia celular individuais e avaliação de complexos respiratórios usando protocolos diversificados de titulação inibidora de substrato-uncoupler (SUIT). Aqui, demonstra-se o uso de dois dispositivos de respirometria de alta resolução, e uma coleção básica de protocolos aplicáveis para a análise de células cultivadas, fibras musculares esqueléticas e cardíacas, e tecidos moles como o cérebro e o fígado são apresentados. Protocolos para células e tecidos cultivados são fornecidos para um respirômetro baseado em câmara e células cultivadas para um respirômetro à base de microplato, ambos abrangendo protocolos de respiração padrão. Para fins comparativos, as células HEK293 projetadas pelo CRISPR deficientes na tradução mitocondrial que causam deficiência múltipla do sistema respiratório são usadas com ambos os dispositivos para demonstrar defeitos celulares na respiração. Ambos os respirômetros permitem uma medição abrangente da respiração celular com seus respectivos méritos técnicos e adequação dependente da questão da pesquisa e do modelo em estudo.
Introduction
Mitocôndrias cumprem a oferta-chave de energia e são uma organela compartimentalizada contribuindo para processos bioenergetics celulares essenciais e metabólicos, como anabolismo de nucleotídeos, lipídios e aminoácidos, biogênese do aglomerado de enxofre de ferro e estão implicados em sinalização como morte celular controlada 1,2,3 . A bioenergeticia mitocondrial através da fosforilação oxidativa contribui para quase todos os processos celulares dentro da célula e, consequentemente, disfunções mitocondriais de origem primária ou secundária estão associadas a um amplo espectro de condições da doença 4,5. A disfunção mitocondrial envolve não apenas alterações na estrutura ou densidade mitocondrial, mas também na qualidade e regulação do sistema respiratório6. Este elemento qualitativo abrange controle de substrato, características de acoplamento, modificações pós-translacionais, dinâmica cristae e supercomplexos respiratórios 7,8. Portanto, a análise precisa da bioenergetics mitocondrial para abordagens experimentais e diagnósticas para avaliar o metabolismo energético da célula é importante na saúde e na doença.
Fosforilação oxidativa mitocondrial (OXPHOS) é uma sequência de reações dentro do sistema respiratório ou sistema de transferência de elétrons (ETS) para a geração de energia celular através de triptosfato de adenosina (ATP)9. O passo multienzimático para aproveitar a energia do fluxo de elétrons através dos complexos I e II ao complexo IV gera um gradiente eletroquímico de prótons através da membrana mitocondrial interna, posteriormente utilizado para fosforilação de difosfato de adenosina (ADP) para ATP via complexo V (F1FO ATP synthase) (Figura 1A).
Primeiro, os portadores de dois elétrons são gerados durante o ciclo tricarboxílico (TCA), glicolise e oxidação piruvato: dinucleotídeo de adenina de nicotinamida (NADH) e dinucleotídeo de adenina dihidroflavina (FADH2). O NADH é oxidado no complexo I (NADH desidrogenase), durante o qual dois elétrons são transferidos para a coenzima Q (quinona é reduzida a quinol), enquanto prótons são bombeados para o espaço intermembrano (IMS). Em segundo lugar, o complexo II (Succinato desidrogenase) oxida FADH2 e alimenta os elétrons para coenzima Q sem bombear prótons. Em terceiro lugar, no complexo III (Cytochrome c oxidoreductase), elétrons da coenzima Q são transferidos para citocromo c enquanto prótons são bombeados para o IMS. Em quarto lugar, o citocromo c transfere os elétrons para o complexo IV (Cytochrome c oxidase), o complexo final para bombear prótons, e onde o oxigênio funciona como um aceitador de elétrons para assimilar prótons, formando água. É esse oxigênio que as mitocôndrias consomem que pode ser medido por um oxígrafo. Finalmente, os prótons gerados a partir do complexo I, complexo III e complexo IV são usados para rodar o complexo V, gerando ASSIM ATP9.
É importante ressaltar que a transferência de elétrons ocorre não apenas de forma linear, de outra forma denotada como a cadeia de transporte de elétrons. Em vez disso, os elétrons podem ser transferidos para a piscina coenzima Q através de múltiplas vias respiratórias e facilitar o fluxo de elétrons convergentes. Os substratos e succinatos do NADH, por exemplo, podem entrar por meio do complexo I e do complexo II, respectivamente. Elétrons da oxidação de ácidos graxos podem ser doados através do complexo de flavoproteína de transferência de elétrons. De fato, uma análise abrangente do OXPHOS requer uma abordagem holística com substratos de combustível apropriados (Figura 1A).
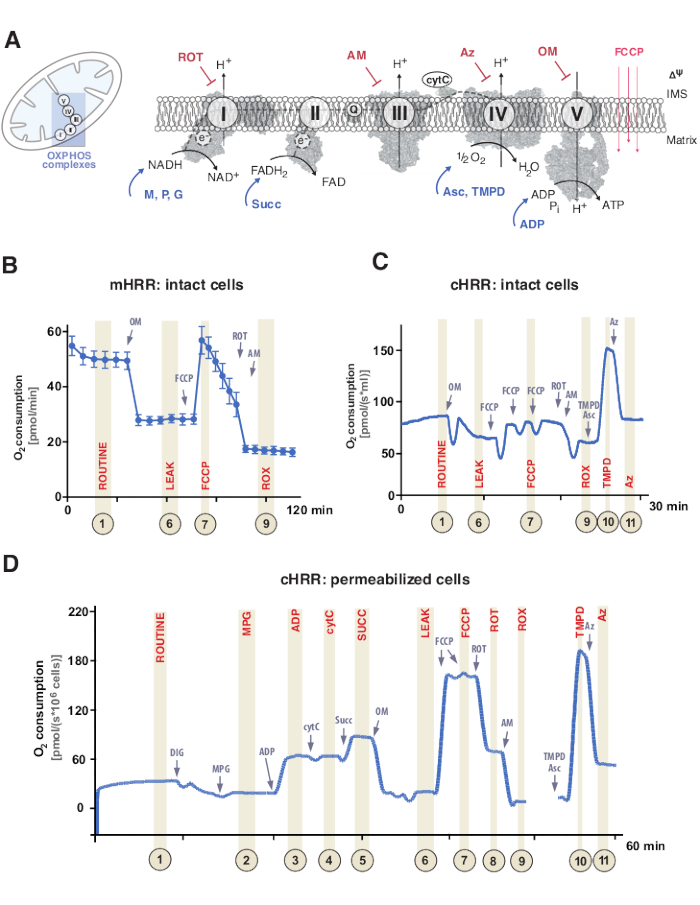
Figura 1: Fosforilação oxidativa mitocondrial e protocolos específicos de substrato e inibidor. (A) Mitoconddrion e esquema do sistema de transferência de elétrons (CI-CIV) e mitocondrial F1F0 ATP synthase (CV). Todas as estruturas são do PDB. As figuras retratam apenas substratos e inibidores descritos neste estudo). (B) Traços de amostra de fluxo de oxigênio em células HEK293 intactas usando protocolo padrão em um dispositivo mHRR. (C) Traços amostrais de fluxo de oxigênio em células HEK293 intactas usando protocolo padrão em um dispositivo cHRR. (D) Traços amostrais de fluxo de oxigênio em fibroblastos humanos permeabilizados de um doador saudável com o respectivo protocolo SUIT. Abreviaturas: 1 = Respiração rotineira de células intactas; 2 = Estado 2; 3 = Estado 3(I); 4 = Estado 3(I) com cítara; 5 = Estado 3 (I+II); 6 = Vazamento(OM); 7 = Capacidade de ETS; 8 = S(ROT); 9 = ROX; 10 = TMPD; 11 = Az. ROT = Rotenone, AM = Antimicina, ATP = Adenosina triphosfato, Az = Azide, OM = Oligomicina, FCCP = Cianeto carbonilizado p-trifluoro-metoxifenil-hidratante; Asc = Ascorbate, TMPD = N,N,N′,N’-tetramethyl-p-fenilelenediamina, Succ = Succinato, M = Malato, P = Piruado, ADP = Difosfato de Adenosina, NAD = Nicotinamida adenina dinucleotídeo, IMS = Espaço Intermembrano, FAD = Flavin adenina dinucleotídeo. Clique aqui para ver uma versão maior desta figura.
A análise da capacidade mitocondrial oxphos usando HRR tornou-se um método bioquímico instrumental de valor diagnóstico não apenas para defeitos mitocondriais primários10,11, mas estendendo-se a todos os outros domínios da biologia, como câncer e envelhecimento12. O HRR permite a determinação da respiração celular pela análise da capacidade mitocondrial de OXPHOS, que reflete diretamente deficiência do complexo respiratório mitocondrial individual ou combinado, e indiretamente está associada à disfunção celular e ao metabolismo energético alterado9. Metodologicamente, as medidas respiratórias são realizadas utilizando células, tecidos ou mitocôndrias isoladas 11,13,14, com material congelado apenas parcialmente adequado15,16. O tecido congelado é mostrado ter um ETS intacto com estabilidade de supercomplex mantido15. Assim, ao contrário dos intermediários tradicionais do TCA, os respectivos substratos são diretamente alimentados no ETS. No entanto, o acoplamento entre a síntese de ETS e ATP é perdido à medida que a integridade da membrana é comprometida por danos congelantes (formação de cristais de gelo).
Experimentos de respiração normalmente ocorrem a uma temperatura fisiológica de 37 °C para endotermias em células ou tecidos não permeabilizados ou permeabilizados. Enquanto o primeiro considera o contexto metabólico citosomático, este último fornece a contribuição energética dos complexos oxphos individuais e do ATPase através da adição de substratos específicos (e inibidores). A sequência e variação de substratos e inibidores levaram ao desenvolvimento de uma matriz diversificada de protocolos SUIT17 e ensaios18 para abordar várias questões científicas da função OXPHOS (revisadas abaixo de12). O protocolo básico de respiração celular avalia quatro estados diferentes: i) respiração de rotina – a respiração em uma respectiva mídia respiratória sem qualquer adição de substratos ou inibidores que consumam, mas substratos endógenos. Este estado pode revelar defeitos de respiração geralmente ou induzidos por secundários causados, por exemplo, por perfis metabólitos alterados. Em seguida, a adição do oligomicina inibidora de ATPase revela a permeabilidade da membrana mitocondrial interna aos prótons, definida como ii) respiração de vazamento. A titulação subsequente de um prótonophore como o desacontedor cianeto de cyanide carbonyl p-trifluoro-metoxiphenyl-hydrazone (FCCP) permite determinar o estado em que a capacidade de ETS é máxima em um modo de circuito de próton aberto transmembrano, definido como iii) respiração nãocopada. É importante ressaltar que um estado desacoplado também pode ocorrer por intervenções experimentais através de danos mecânicos excessivos às membranas mitocondriais. Por outro lado, o estado não acoplado refere-se ao desacoplamento respiratório por um mecanismo intrínseco que é fisiologicamente controlado. Finalmente, a inibição completa do ETS por adição do complexo inibidor III antimicina e do inibidor complexo I rotenona determina o consumo residual de oxigênio (ROX) de processos não mitocondriais de consumo de oxigênio (Figura 1A-C).
A bioenergetics mitocondrial consiste em cinco estados de respiração distintos19,20. A respiração do estado 1 é sem substratos adicionais ou ADP, exceto pelo que está disponível de forma endógena. Após a adição de ADP, mas ainda assim, sem substratos, a respiração estadual 2 é alcançada. Quando substratos são adicionados, permitindo transferência de elétrons e síntese ATP, a respiração do estado 3 é atingida. Neste estado, a capacidade oxphos pode ser definida em concentrações saturadas de ADP, fosfato inorgânico, oxigênio, nadh- e substratos ligados ao succinato. A respiração do estado 4 ou a respiração DE VAZAMENTO podem ser definidas como um estado sem ADP ou sintetizadores ATP quimicamente inibidos enquanto têm substratos suficientes. Por fim, quando todo o oxigênio é esgotado (anoxico) em um ambiente de câmara fechada, o estado 5 respiração é observado.
Existem vários métodos para avaliar os estados de energia celular14 com dois dispositivos dominando a avaliação atual em tempo real do OXPHOS através da análise do consumo de oxigênio, medido como função da diminuição do oxigênio ao longo do tempo em um sistema de câmara fechada com diferentes aplicabilidade dependentes do modelo experimental e da questão da pesquisa: o respirômetro oroboros de alta resolução e o analisador de fluxo extracelular Seahorse XF. Ambos os dispositivos registram as taxas de consumo de oxigênio como uma diminuição nos picomoles (pmol) de oxigênio (O2) por segundo como um valor absoluto dentro da câmara ou poço de microplato. O consumo específico de oxigênio por massa é obtido pela normalização do respectivo consumo de oxigênio em uma receita tampão específica por número de células (milhões), peso tecidual (mg) ou quantidade de proteína.
O O2k (Instrumentos Oroboros) é um sistema fechado de duas câmaras equipado com um sensor de oxigênio polarográfico (abreviado como respirômetro de alta resolução baseado em câmara: cHRR). Cada câmara experimental contém 2 mL de líquido que é mantido homogêneo por agitadores magnéticos. O sensor de oxigênio polarográfico utiliza uma abordagem amperométrica para medir o oxigênio: contém um cátodo de ouro, um ânodo de cloreto de prata/prata, e entre uma solução KCI criando uma célula eletroquímica sobre a qual uma tensão (0,8 V) é aplicada. O oxigênio do ensaio difere através de uma membrana fluorina de etileno fluorado de 25 μm (O 2-permeável) e sofre redução no cátodo, produzindo peróxido de hidrogênio. No ânodo, a prata é oxidada por peróxido de hidrogênio, gerando uma corrente elétrica. Esta corrente elétrica (ampere) está linearmente relacionada com a pressão parcial de oxigênio. A pressão parcial do oxigênio e o fator de solubilidade de oxigênio do meio de ensaio são usados para calcular a concentração de oxigênio. Uma vez que a pressão parcial do oxigênio depende da temperatura experimental e as medidas polarográficas são sensíveis à temperatura, as flutuações na temperatura precisam de regulação precisa (±0,002 °C) por um bloco de aquecimento Peltier. A temperatura pode ser controlada dentro de uma faixa de 4 °C e 47 °C.
O analisador de fluxo extracelular Seahorse XF (Agilent) é um sistema baseado em placas com formato de microplaca de 24 ou 96 poços no qual três eletrodos de fluorescência medem o consumo de oxigênio ao longo do tempo em cada poço (abreviado como respirômetro de alta resolução baseado em microplaca: mHRR). Um máximo de quatro portas no cartucho de ensaio estão disponíveis para injeção automatizada durante o ensaio. Um ensaio contém vários ciclos, cada um com três fases: 1) mistura, 2) espera e 3) medição. Durante a fase de medição, as sondas de sensores são reduzidas na microplacão criando uma câmara temporariamente fechada contendo volume de 7-10 μL para medir a luz emitida. Esta luz é emitida por fluoroforos embutidos em polímero na ponta das sondas do sensor, que sentem O2 com base na saciamento da fosforescência. A intensidade do sinal de fluorescência é proporcional a O2 e influenciada pela temperatura do sensor e do meio de ensaio. Portanto, a estimativa precisa de oxigênio requer uma abordagem relativa com um poço de fundo sem qualquer amostra. A restauração da concentração de oxigênio ocorre durante a fase de mistura quando o sensor se move para cima e para baixo para misturar o volume acima da câmara temporária. Cada ciclo calcula uma taxa de consumo de oxigênio. A temperatura pode ser controlada dentro de uma faixa de 16 °C e 42 °C.
O HRR é o padrão-ouro para avaliar bioenergetics celulares em doenças primárias e mitocôndrias associadas e metabolismo celular geral. Neste estudo, protocolos básicos para HRR são fornecidos para avaliar a função OXPHOS em células e tecidos.
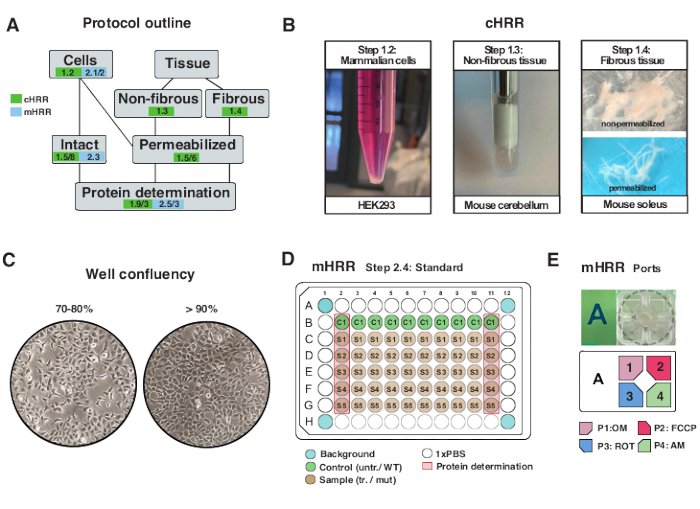
Figura 2: Fluxo de trabalho para preparações celulares e tecidos para rCR, e preparação celular para respirometria mHRR. (A) Esboço dos protocolos fornecidos. (B) Células mamíferas (passo 1.2): pelota HEK293 igual a 3 x 106 células (painel esquerdo). Tecido não fibroso (passo 1.3): Preparação de cerebelo murino em 2 mL Teflon potter (painel médio). Permeabilização do músculo esquelético induzida por sapona (etapa 1.4) painel direito) para respirometria de HRR. (C) Layout de semeamento de microplaca padrão (etapa 2.4) e verificação de confluência para a análise de células eucarióticas (HEK293) para respirometria mHRR. (D, E) Esquema de carregamento da porta de injeção para respirometria mHRR (etapa 2.4). Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Tradicionalmente, bioenergetics mitocondriais tem sido estudado com eletrodos de oxigênio do tipo Clark. A falta de resolução e throughput, no entanto, justificava o avanço tecnológico. Até o momento, o O2k (conhecido como cHRR) e o Seahorse XF96 Flux Analyzer (conhecido como mHRR) foram amplamente adotados no campo dos bioenergésicos celulares. Aqui, apresentamos uma coleção compreensível de protocolos para análise do metabolismo de energia celular através da avaliação da respiração mitocondrial usando c…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado por financiamento da Academia da Finlândia (C.B.J), da Fundação Magnus Ehrnroot (C.B.J), e de uma bolsa de doutorado da Integrated Life Sciences Graduate School (R.A.).
Materials
| 2 mL Potter-Elvehjem Glass/PTFE Tissue Grinder/Homogenizer | Omni International | 07-358029 | |
| 95% O2, 5% CO2 medical gas mixture | Potter for tissue grinding | ||
| ADP | Sigma | A 4386 | |
| Antimycin A | Sigma | A 8674 | Chemical |
| Ascorbate | Merck | PHR1279-1G | Chemical, dissolve in ethanol |
| BSA (fatty accid free) | Sigma | A 6003 | Chemical |
| CaCO3 | Sigma | C 4830 | Chemical |
| Cytochrome c | Sigma | C 7752 | Chemical |
| Digitonin | Sigma | D 5628 | Chemical |
| Dithiothreitol | Sigma | D 0632 | Chemical, dissolve in DMSO |
| D-Sucrose | Roth | 4621.1 | Chemical |
| Dulbecco’s modified Eagle’s medium (High glucose) | Fisher Scientific | 41965-039 | Chemical |
| Dulbecco’s modified Eagle’s medium (No Glucose) | Fisher Scientific | A14430-01 | |
| EGTA | Sigma | E 4378 | |
| Etomoxir | Sigma | E1905 | Chemical |
| Falcon 15 ml Conical Centrifuge Tubes | Fisher Scientific | AM12500 | Chemical |
| Falcon 50 ml Conical Centrifuge Tubes | Fisher Scientific | AM12501 | |
| FCCP | Sigma | C 2920 | |
| Glucose | Sigma | G7021 | Chemical, dissolve in ethanol |
| Glutamate | Sigma | G 1626 | Chemical |
| GlutaMax (100x) (200 nM L-alanyl-L-glutamine dipeptide) | Fisher Scientific | 35050061 | Chemical |
| HEK293 cells | ATTC | CRL-1573 | |
| Hemocytometer | Fisher Scientific | 0267151B | Instrument for cell counting |
| Hepes | Sigma | H 7523 | Chemical |
| Imidazole | Fluka | 56750 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| L-carnitine | Sigma | C0283 | Chemical |
| Malate | Sigma | M 1000 | Chemical |
| MES hydrate | Sigma | M8250 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Na2ATP | Sigma | A 2383 | Chemical |
| Na2Phosphocreatine | Sigma | P 7936 | Chemical |
| Na-pyruvate (100 mM) (100x) | Fisher Scientific | 11360070 | |
| NEAA (Non-essential amino acids) 100x | Fisher Scientific | 11140035 | |
| Normal FBS (10x) | Fisher Scientific | 10500064 | |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| O2k-Titration Set | Oroboros Instruments | 20820-03 | Hamilton syringes for chemical injections |
| Oligomycin | Sigma | O 4876 | Chemical, dissolve in ethanol |
| Palmitoylcarnitine | Sigma | P 4509 | Chemical |
| Penicillin-Streptomycin | Fisher Scientific | 15140122 | |
| Pierce BCA Protein Assay Kit | Fisher Scientific | 23227 | |
| Pyruvate | Sigma | P 2256 | Chemical |
| RIPA-Buffer | Fisher Scientific | 89900 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Saponin | Sigma | S7900 | Chemical |
Seahorse XF DMEM assay medium pack, pH 7.4 |
Agilent, Santa Clara, CA |
103680-100 | |
| Seahorse XFe96 Extracellular Flux Analyzer | Agilent, Santa Clara, CA |
High-throughput respirometry instrument | |
| Seahorse XFe96 FluxPak | Agilent, Santa Clara, CA |
Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
|
| Small scissors | Fisher Scientific | 08-951-20 | |
| Sodium azide | Sigma | S2002 | Chemical |
| Succinate | Sigma | S 2378 | Chemical |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
| Trypan Blue solution | Merck | 72-57-1 | Chemical |
| Trypsin 0.25% EDTA | Fisher Scientific | 25200056 | |
| Two thin-edged forceps | Fisher Scientific | 12-000-122 | |
| Uridine stock (500x) | Sigma | U3750 | Chemical |
References
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Mehta, M. M., Weinberg, S. E., Chandel, N. S. Mitochondrial control of immunity. Beyond ATP. Nature Reviews Immunology. 17 (10), 608-620 (2017).
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle. New perspectives of mitochondrial physiology. International Journal of Biochemistry and Cell Biology. 41 (10), 1837-1845 (2009).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 1-23 (2016).
- Boushel, R., Gnaiger, E., Schjerling, P., Skovbro, M., Kraunsøe, R., Dela, F. Patients with type 2 diabetes have normal mitochondrial function in skeletal muscle. Diabetologia. 50 (4), 790-796 (2007).
- Cogliati, S., et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13, 1-11 (2015).
- Gnaiger, E. Mitochondrial pathways and Respiratory control. An introduction to OXPHOS analysis. Bioenergetics communications. 5th ed. , (2020).
- Jackson, C. B., et al. Mutations in SDHD lead to autosomal recessive encephalomyopathy and isolated mitochondrial complex II deficiency. Journal of Medical Genetics. 51 (3), 170-175 (2014).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- Doerrier, C., Garcia-Souza, L. F., Krumschnabel, G., Wohlfarter, Y., Mészáros, A. T., Gnaiger, E. High-resolution fluorespirometry and oxphos protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7 (6), 1068-1085 (2012).
- García-Roche, M., Casal, A., Carriquiry, M., Radi, R., Quijano, C., Cassina, A. Respiratory analysis of coupled mitochondria in cryopreserved liver biopsies. Redox Biology. 17, 207-212 (2018).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. The EMBO Journal. 39 (13), 1-18 (2020).
- Cell metabolism assay kits. Seahorse assay kits and media Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-lits-reagents-cell-assay-media (2021)
- Chance, B., Williams, G. R. A method for the localization of sites for oxidative phosphorylation. Nature. 176 (4475), 250-254 (1955).
- Gnaiger, E., et al. Mitochondrial respiratory states and rates. MitoFit Preprint Arch. , (2019).
- Gnaiger, E. O2k-procedures: SOP O2k quality control 1: Polarographic oxygen sensors and accuracy of calibration Section Page. Oroboros. 03 (18), 1-21 (2020).
- Robinson, B. H., Petrova-Benedict, R., Buncic, J. R., Wallace, D. C. Nonviability of cells with oxidative defects in galactose medium: A screening test for affected patient fibroblasts. Biochemical Medicine and Metabolic Biology. 48 (2), 122-126 (1992).
- King, M. P., Attardi, G. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Fasching, M., Gnaiger, E. O2k quality control 2: Instrumental oxygen background correction and accuracy of oxygen flux. Mitochondrial Physiology Network. 14 (06), 1-14 (2016).
- Gnaiger, E., Lassnig, B., Kuznetsov, A., Rieger, G., Margreiter, R. Excess capacity of cytochrome c oxidase. Journal of Experimental Biology. 1139, 1129-1139 (1998).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Fontana-Ayoub, M., Fasching, E., Gnaiger, Selected media and chemicals for respirometry with mitochondrial preparations. Mitochondrial Physiology Network. 02 (17), 1-9 (2014).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods in Enzymology. 542, 163-181 (2014).
- Nászai, A., Terhes, E., Kaszaki, J., Boros, M., Juhász, L. Ca(2+)N it be measured? Detection of extramitochondrial calcium movement with high-resolution fluorespirometry. Scientific Reports. 9 (1), 1-13 (2019).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: From diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), 234 (2019).
- Mercier-Letondal, P., Marton, C., Godet, Y., Galaine, J. Validation of a method evaluating T cell metabolic potential in compliance with ICH Q2 (R1). Journal of Translational Medicine. 19 (1), 1-15 (2021).
- Sauerbeck, A., et al. Analysis of regional brain mitochondrial bioenergetics and susceptibility to mitochondrial inhibition utilizing a microplate based system. Journal of Neuroscience Methods. 198 (1), 36-43 (2011).
- Jackman, M. R., Willis, W. T. Characteristics of mitochondria isolated from type I and type IIb skeletal muscle. American Journal of Physiology – Cell Physiology. 270 (2), 673-678 (1996).
- Ponsot, E., et al. Mitochondrial tissue specificity of substrates utilization in rat cardiac and skeletal muscles. Journal of Cellular Physiology. 203 (3), 479-486 (2005).
- Schönfeld, P., Reiser, G. Why does brain metabolism not favor burning of fatty acids to provide energy-Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow and Metabolism. 33 (10), 1493-1499 (2013).
- Calderon-Dominguez, M., Mir, J. F., Fucho, R., Weber, M., Serra, D., Herrero, L. Fatty acid metabolism and the basis of brown adipose tissue function. Adipocyte. 5 (2), 98-118 (2016).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode. Current Protocols in Toxicology. 2014, 1-16 (2014).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using Seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), 21746 (2011).
- Jordá, A., Zaragozá, R., Portolés, M., Báguena-Cervellera, R., Renau-Piqueras, J. Long-term high-protein diet induces biochemical and ultrastructural changes in rat liver mitochondria. Archives of Biochemistry and Biophysics. 265 (2), 241-248 (1988).
- Jackson, C. B., Gallati, S., Schaller, A. QPCR-based mitochondrial DNA quantification: Influence of template DNA fragmentation on accuracy. Biochemical and Biophysical Research Communications. 423 (3), 441-447 (2012).
- Hirsch, H. M. Tissue autoxidation inhibitors: II. The presence of inhibitor in intact cells; Assay of liver and hepatoma effect on radio-oxidations. 암 연구학. 16 (11), 1076-1082 (1956).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), 18317 (2011).
- Tanumihardja, E., Slaats, R. H., Van Der Meer, A. D., Passier, R., Olthuis, W., Van Den Berg, A. Measuring both pH and O2 with a single On-Chip sensor in cultures of human pluripotent stem cell-derived cardiomyocytes to track induced changes in cellular metabolism. ACS Sensors. 6 (1), 267-274 (2021).
- Harms, F., Stolker, R. J., Mik, E. Cutaneous respirometry as novel technique to monitor mitochondrial function: A feasibility study in healthy volunteers. PLoS ONE. 11 (7), 159544 (2016).
- Levitsky, Y., et al. Micro-respirometry of whole cells and isolated mitochondria. RSC Advances. 9 (57), 33257-33267 (2019).

