Respirometry ברזולוציה גבוהה להערכת ביו-אנרגיה בתאים וברקמות באמצעות מדים מבוססי תאים ולוחות
Summary
הערכת זרחון חמצוני באמצעות מד נשימה ברזולוציה גבוהה הפכה לחלק בלתי נפרד מהניתוח הפונקציונלי של מיטוכונדריה ומטבוליזם של אנרגיה תאית. כאן אנו מציגים פרוטוקולים לניתוח חילוף החומרים של אנרגיה תאית באמצעות מדים מבוססי תאים ומיקרו-פלטות ברזולוציה גבוהה ודנים ביתרונות העיקריים של כל מכשיר.
Abstract
נשימה ברזולוציה גבוהה (HRR) מאפשרת ניטור של זרחון חמצוני בזמן אמת לניתוח מצבי אנרגיה תאיים בודדים ולהערכת קומפלקסים נשימתיים באמצעות פרוטוקולים מגוונים של טיטרציה מעכבי מצע-לא-מעכבי-קופלר (SUIT). כאן מודגם השימוש בשני מכשירי נשימה ברזולוציה גבוהה, ומוצג אוסף בסיסי של פרוטוקולים החלים על ניתוח תאים בתרבית, סיבי שרירי שלד ולב, ורקמות רכות כגון המוח והכבד. פרוטוקולים לתאים ורקמות בתרבית מסופקים עבור מד נשימה מבוסס תא ותאים בתרבית עבור מד נשימה מבוסס מיקרו-פלטה, שניהם מקיפים פרוטוקולי נשימה סטנדרטיים. למטרות השוואה, תאי HEK293 המהונדסים על ידי קריספר, החסרים בתרגום המיטוכונדריה הגורמים למחסור רב במערכת הנשימה, משמשים בשני המכשירים כדי להדגים פגמים תאיים בנשימה. שני ה-respirometers מאפשרים מדידה מקיפה של הנשימה התאית, כאשר היתרונות הטכניים וההתאמה שלהם תלויים בשאלת המחקר ובמודל הנחקר.
Introduction
המיטוכונדריה ממלאת את אספקת האנרגיה העיקרית ומהווה אברון ממודר התורם לתהליכים ביו-אנרגטיים ומטבוליים תאיים חיוניים כגון אנאבוליזם של נוקלאוטידים, ליפידים וחומצות אמינו, ביוגנזה של צבירי ברזל-גופרית והם מעורבים באיתות כגון מוות מבוקר של תאים 1,2,3 . ביו-אנרגיה מיטוכונדריאלית באמצעות זרחון חמצוני תורמת כמעט לכל התהליכים התאיים בתוך התא, וכתוצאה מכך, תפקודים מיטוכונדריאליים ממקור ראשוני או משני קשורים לספקטרום רחב של תנאי מחלה 4,5. תפקוד לקוי של המיטוכונדריה לא רק כרוך בשינויים במבנה או בצפיפות המיטוכונדרית אלא גם באיכות ובוויסות של מערכת הנשימה6. אלמנט איכותי זה מקיף בקרת מצע, מאפייני צימוד, שינויים לאחר התרגום, דינמיקה של כריסטה וסופר-קומפלקסים נשימתיים 7,8. לכן, ניתוח מדויק של ביו-אנרגיה מיטוכונדריאלית עבור גישות ניסיוניות ואבחון להערכת חילוף החומרים האנרגטי של התא חשוב בבריאות ובמחלות.
זרחון חמצוני מיטוכונדריאלי (OXPHOS) הוא רצף של תגובות בתוך מערכת הנשימה או מערכת העברת אלקטרונים (ETS) ליצירת אנרגיה תאית באמצעות אדנוזין טריפוספט (ATP)9. הצעד הרב-אנזימטי לרתום אנרגיה מזרימת אלקטרונים דרך קומפלקסים I ו-II ל-IV מורכב יוצר שיפוע פרוטונים אלקטרוכימי על פני הממברנה המיטוכונדרית הפנימית, המשמשת לאחר מכן לזרחון של אדנוזין דיפוספט (ADP) ל-ATP באמצעות V מורכב (F1 F 1FO ATP synthase) (איור 1A).
ראשית, נשאים של שני אלקטרונים נוצרים במהלך המחזור הטריקרבוקסילי (TCA), הגליקוליזה וחמצון הפירובט: ניקוטיןמיד אדנין דינוקלאוטיד (NADH) ודיהידרופלבין אדנין דינוקלאוטיד (FADH2). NADH מתחמצן בקומפלקס I (NADH dehydrogenase), שבמהלכו שני אלקטרונים מועברים לקו-אנזים Q (קינון מצטמצם לקינול), בעוד פרוטונים נשאבים לתוך החלל הבין-מימי (IMS). שנית, קומפלקס II (סוקסינט דהידרוגנאז) מחמצן את FADH2 ומזין את האלקטרונים לקו-אנזים Q מבלי לשאוב פרוטונים. שלישית, בקומפלקס III (Cytochrome c oxidoreductase), אלקטרונים מקו-אנזים Q מועברים לציטוכרום c בעוד פרוטונים נשאבים לתוך ה-IMS. רביעית, ציטוכרום c מעביר את האלקטרונים ל-IV מורכב (Cytochrome c oxidase), הקומפלקס הסופי לשאיבת פרוטונים, וכאשר חמצן מתפקד כמקבל אלקטרונים להטמעת פרוטונים, ובסופו של דבר יוצר מים. זהו חמצן זה כי המיטוכונדריה צורכת אשר ניתן למדוד על ידי אוקסיגרף. לבסוף, הפרוטונים הנוצרים מקומפלקס I, קומפלקס III ו- IV מורכב משמשים לסיבוב V מרוכב, ובכך יוצרים ATP9.
חשוב לציין, העברת אלקטרונים מתרחשת לא רק באופן ליניארי, המסומן אחרת כשרשרת הובלת האלקטרונים. במקום זאת, ניתן להעביר אלקטרונים למאגר הקו-אנזים Q דרך מספר מסלולי נשימה ולהקל על זרימת אלקטרונים מתכנסת. NADH-substrates ו succinate, למשל, יכולים להיכנס דרך קומפלקס I ו- II מורכב, בהתאמה. ניתן לתרום אלקטרונים מחמצון חומצות שומן באמצעות קומפלקס פלבופרוטאין המעביר אלקטרונים. ואכן, ניתוח מקיף של OXPHOS דורש גישה הוליסטית עם מצעי דלק מתאימים (איור 1A).
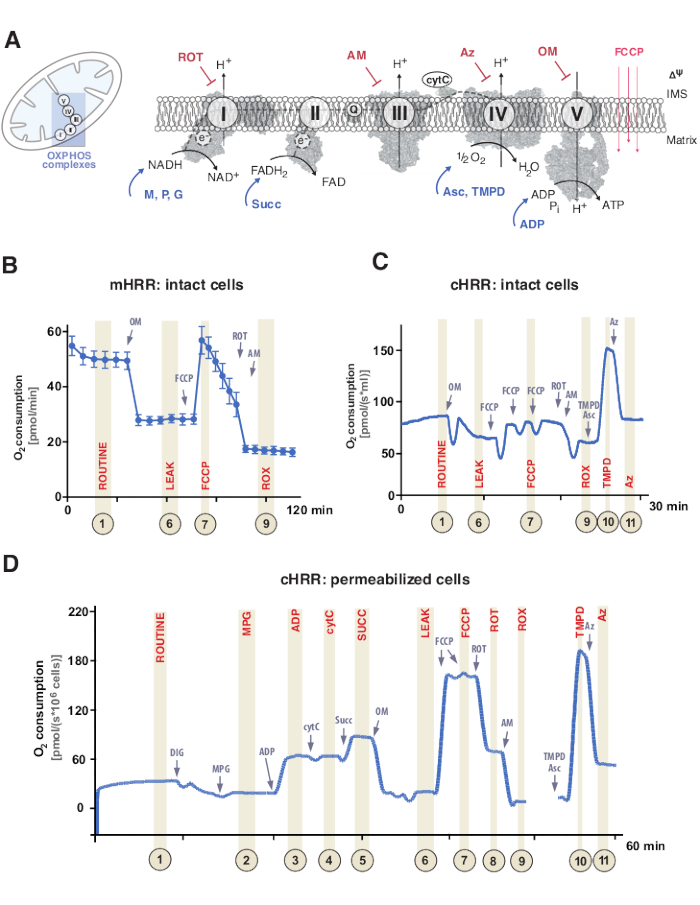
איור 1: זרחון חמצוני מיטוכונדריאלי ופרוטוקולים ספציפיים של מצע ומעכבים. כל המבנים הם מ- PDB. האיורים מתארים רק מצעים ומעכבים המתוארים במחקר זה). (B) עקבות דגימה של שטף חמצן בתאי HEK293 שלמים באמצעות פרוטוקול סטנדרטי במכשיר mHRR. (C) עקבות דגימה של שטף חמצן בתאי HEK293 שלמים באמצעות פרוטוקול סטנדרטי בהתקן cHRR. (D) עקבות דגימה של שטף חמצן בפיברובלסטים אנושיים מחלחלים מתורם בריא עם פרוטוקול SUIT המתאים. קיצורים: 1 = נשימה שגרתית של תאים שלמים; 2 = מדינה 2; 3 = מדינה 3(I); 4 = מדינה 3(I) עם cytC; 5 = מדינה 3 (I+II); 6 = דליפה(OM); 7 = קיבולת ETS; 8 = S(ROT); 9 = ROX; 10 = TMPD; 11 = Az. ROT = רוטנון, AM = אנטימיצין, ATP = אדנוזין טריפוספט, Az = Azide, OM = אוליגומיצין, FCCP = קרבוניל ציאניד p-טריפלואורו-מתוקסיפניל-הידרזון; Asc = Ascorbate, TMPD = N,N,N,N′,N′-tetramethyl-p-phenylenediamine, Succ = Succinate, M = מלאט, P = פירובט, ADP = אדנוזין דיפוספט, NAD = ניקוטינמיד אדנין דינוקלאוטיד, IMS = מרחב אינטרממברנה, FAD = פלווין אדנין דינוקלאוטיד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
ניתוח של יכולת OXPHOS מיטוכונדריאלית באמצעות HRR הפך לשיטה ביוכימית אינסטרומנטלית בעלת ערך אבחוני לא רק עבור פגמים מיטוכונדריאליים ראשוניים10,11 אלא מתרחב לכל תחומי הביולוגיה האחרים כגון סרטן והזדקנות12. HRR מאפשר לקבוע את הנשימה התאית על ידי ניתוח של יכולת OXPHOS המיטוכונדרית, אשר משקפת ישירות מחסור מורכב נשימתי מיטוכונדריאלי בודד או משולב, ובעקיפין קשורה לתפקוד לקוי של התאים ושינוי בחילוף החומרים של האנרגיה9. מבחינה מתודולוגית, מדידות נשימה מבוצעות באמצעות תאים, רקמה או מיטוכונדריה מבודדת 11,13,14, כאשר החומר הקפוא מתאים רק באופן חלקיל-15,16. רקמה קפואה הוכחה כבעלת ETS שלם עם יציבות סופר-קומפלקס15. לפיכך, בניגוד למתווכים מסורתיים של TCA, המצעים המתאימים מוזנים ישירות לתוך ה- ETS. עם זאת, הצימוד בין הסינתזה של ETS לסינתזה של ATP הולך לאיבוד כאשר שלמות הממברנה נפגעת באמצעות נזקי הקפאה (היווצרות גבישי קרח).
ניסויי הנשימה נערכים בדרך כלל בטמפרטורה פיזיולוגית של 37 מעלות צלזיוס עבור אנדותרמים בתאים או רקמה שאינם מחלחלים או חודרים. בעוד הראשון רואה את ההקשר המטבולי הציטוזולי, האחרון מספק את התרומה האנרגטית של קומפלקסים OXPHOS בודדים ואת ה- ATPase באמצעות הוספת מצעים ספציפיים (ומעכבים). הרצף והשונות של מצעים ומעכבים הובילו לפיתוח מערך מגוון של פרוטוקולי SUIT17 ומבחנים18 כדי לענות על שאלות מדעיות שונות של תפקוד OXPHOS (שנסקרו תחת12). הפרוטוקול הבסיסי של הנשימה התאית מעריך ארבעה מצבים שונים: א) נשימה שגרתית – הנשימה במדיית הנשימה המתאימה ללא כל תוספת של מצעים או מעכבים הצורכים מצעים אך אנדוגניים. מצב זה יכול לחשוף OXPHOS כללי או פגמי נשימה הנגרמים משנית הנגרמים, למשל, על ידי פרופילי מטבוליטים שהשתנו. לאחר מכן, התוספת של מעכב ATPase אוליגומיצין חושפת את החדירות של הממברנה המיטוכונדרית הפנימית לפרוטונים, המוגדרים כ- ii) נשימת דליפה. טיטרציה עוקבת של פרוטונופור כגון קרבוניל ציאניד p-trifluoro-מתוקסיפניל-הידרזון (FCCP) מאפשרת לקבוע את המצב שבו קיבולת ETS היא מקסימלית במצב מעגל פרוטון פתוח-טרנס-ממברני, המוגדר כ- iii) נשימה לא משותפת. חשוב לציין, מצב לא מגובש יכול להתרחש גם על ידי התערבויות ניסיוניות באמצעות נזק מכני מוגזם לממברנות המיטוכונדריה. לעומת זאת, המצב הלא מצומד מתייחס לאי-שיתוף פעולה נשימתי על ידי מנגנון פנימי הנשלט מבחינה פיזיולוגית. לבסוף, עיכוב מלא של ETS על ידי הוספת אנטימיצין מעכב III מורכב ומעכב I מורכב רוטנון קובע את צריכת החמצן השיורית (ROX) מתהליכים שאינם צורכים חמצן מיטוכונדריאלי (איור 1A-C).
ביו-אנרגיה מיטוכונדריאלית מורכבת מחמישה מצבי נשימה נפרדים19,20. הנשימה של מצב 1 היא ללא כל מצעים נוספים או ADP, למעט מה שזמין באופן אנדוגני. לאחר הוספת ADP, אך עדיין, אין מצעים, מושגת הנשימה של המדינה 2. כאשר מוסיפים מצעים, המאפשרים העברת אלקטרונים וסינתזת ATP, מגיעים למצב 3 הנשימה. במצב זה, ניתן להגדיר את יכולת ה-OXPHOS בריכוזים רוויים של ADP, פוספט אנאורגני, חמצן, NADH ומצעים הקשורים לסוקסינט. ניתן להגדיר את הנשימה של מצב 4 או נשימה של דליפה כמצב ללא ADP או סינתזות ATP מעוכבות כימית תוך שימוש במצעים מספיקים. לבסוף, כאשר כל החמצן מתרוקן (אנוקסי) בסביבה של תא סגור, נצפתה נשימה במצב 5.
קיימות מספר שיטות להערכת מצבי אנרגיה תאית14 עם שני מכשירים השולטים בהערכה הנוכחית בזמן אמת של OXPHOS באמצעות ניתוח של צריכת חמצן, הנמדדת כפונקציה של הירידה בחמצן לאורך זמן במערכת סגורה עם ישימות שונה התלויה במודל הניסוי ובשאלת המחקר: מד הנשימה ברזולוציה גבוהה של Oroboros 2k ומנתח השטף החוץ-תאי של סוסון הים XF. שני המכשירים מתעדים את שיעורי צריכת החמצן כירידה בפיקומולים (pmol) של חמצן (O2) לשנייה כערך מוחלט בתוך החדר או באר המיקרו-פלטה. צריכת החמצן הספציפית לכל מסה מתקבלת על ידי נורמליזציה של צריכת החמצן המתאימה במתכון חיץ ספציפי למספר תאים (מיליונים), משקל רקמה (מ”ג) או כמות חלבון.
O2k (מכשירי אורובורוס) היא מערכת סגורה בעלת שני תאים המצוידת בחיישן חמצן פולרוגרפי (מקוצר כ-respirometer מבוסס תא ברזולוציה גבוהה: cHRR). כל תא ניסוי מכיל 2 מ”ל של נוזל אשר נשמר הומוגני על ידי מערבלים מגנטיים. חיישן החמצן הפולארוגרפי משתמש בגישה אמפרומטרית למדידת החמצן: הוא מכיל קתודה מוזהבת, אנודה כסף/כסף כלוריד, ובין לבין תמיסת KCI היוצרת תא אלקטרוכימי שעליו מופעל מתח (0.8 וולט). חמצן ממדיום הבדיקה מתפזר דרך קרום אתילן פרופילן פלואור של 25 מיקרומטר (O2-חדיר) ועובר הפחתה בקתודה, ומייצר מי חמצן. באנודה, כסף מחומצן על ידי מי חמצן, ומייצר זרם חשמלי. זרם חשמלי זה (אמפר) קשור באופן ליניארי ללחץ החמצן החלקי. הלחץ החלקי של החמצן ומקדם מסיסות החמצן של מדיום הבדיקה משמשים לחישוב ריכוז החמצן. מכיוון שלחץ חלקי של חמצן תלוי בטמפרטורה ניסיונית ומדידות פולארוגרפיות רגישות לטמפרטורה, תנודות בטמפרטורה זקוקות לוויסות מדויק (±0.002 מעלות צלזיוס) על ידי בלוק חימום פלטייה. ניתן לשלוט בטמפרטורה בטווח של 4 °C (4 °F) ו- 47 °C (74 °F).
מנתח השטף החוץ-תאי של סוסון הים XF (Agilent) הוא מערכת מבוססת צלחת עם פורמט מיקרו-פלטה של 24 או 96 בארות שבה שלוש אלקטרודות פלואורסצנטיות מודדות את צריכת החמצן לאורך זמן בכל באר (מקוצרת כ-respirometer מבוסס מיקרו-פלטה ברזולוציה גבוהה: mHRR). לכל היותר ארבע יציאות במחסנית הבדיקה זמינות להזרקה אוטומטית במהלך הבדיקה. בדיקה מכילה מספר מחזורים, שלכל אחד מהם שלושה שלבים: 1) ערבוב, 2) המתנה ו-3) מדידה. במהלך שלב המדידה, בדיקות החיישן מורדות לתוך המיקרו-לוחית ויוצרות תא סגור באופן זמני המכיל נפח של 7-10 מיקרול’ למדידת האור הנפלט. אור זה נפלט על ידי פלואורופורים משובצי פולימר על קצה גשושיות החיישן, אשר חשים את O2 בהתבסס על מרווה זרחנית. עוצמת האות הפלואורסצנטי פרופורציונלית ל-O2 ומושפעת מטמפרטורת החיישן ומתווך הבדיקה. לכן, הערכת חמצן מדויקת דורשת גישה יחסית עם רקע היטב ללא כל דגימה. שחזור ריכוז החמצן מתרחש במהלך שלב הערבוב כאשר החיישן נע מעלה ומטה כדי לערבב את הנפח מעל התא הזמני. כל מחזור מחשב קצב צריכת חמצן אחד. ניתן לשלוט בטמפרטורה בטווח של 16 מעלות צלזיוס ו-42 מעלות צלזיוס.
HRR הוא תקן הזהב להערכת ביו-אנרגיה תאית במחלות ראשוניות הקשורות למיטוכונדריה ובחילוף חומרים תאי כללי. במחקר זה, פרוטוקולים בסיסיים עבור HRR מסופקים כדי להעריך את תפקוד OXPHOS בתאים וברקמות.
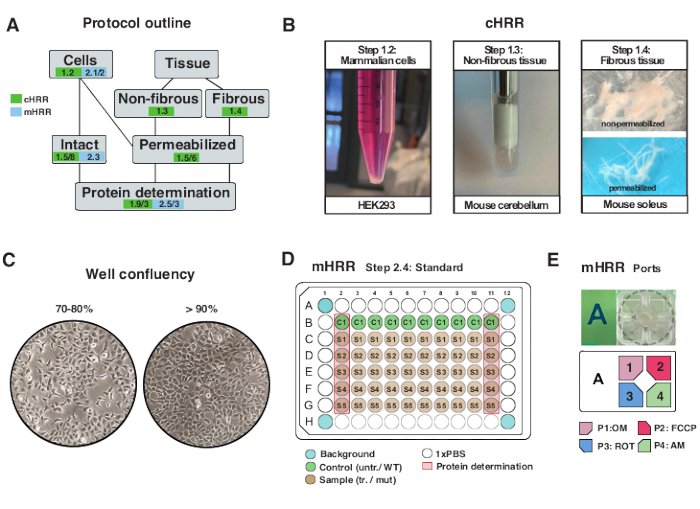
איור 2: זרימת עבודה להכנה של תאים ורקמות ל-cHRR, והכנת תאים לנשימה של mHRR. (A) חלוקה לרמות של פרוטוקולים שסופקו. (B) תאי יונקים (שלב 1.2): כדור HEK293 השווה ל-3 x 106 תאים (לוח שמאלי). רקמה לא סיבית (שלב 1.3): הכנת מורין המוח הקטן ליזט ב-2 מ”ל קדר טפלון (לוח אמצעי). חדירה של שרירי השלד המושרה על ידי ספונין (שלב 1.4) פאנל ימני) עבור respirometry cHRR. (C) פריסת זריעת מיקרו-פלטה סטנדרטית (שלב 2.4) ובדיקת מפגש לניתוח תאים אאוקריוטים (HEK293) עבור נשימה mHRR. (ד, ה) סכימה של טעינת יציאת הזרקה עבור respirometry mHRR (שלב 2.4). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
באופן מסורתי, ביו-אנרגיה מיטוכונדריאלית נחקרה עם אלקטרודות חמצן מסוג קלארק. עם זאת, היעדר פתרון ותפוקה מוצדקים להתקדמות טכנולוגית. עד כה, O2k (המכונה cHRR) ו- Seahorse XF96 Flux Analyzer (המכונה mHRR) אומצו באופן נרחב בתחום הביו-אנרגיה התאית. כאן, אנו מציגים אוסף מובן של פרוטוקולים לניתוח חילוף החומרים של האנר…
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי מימון מהאקדמיה של פינלנד (C.B.J), קרן מגנוס ארנרוט (C.B.J), ומלגת דוקטורט של בית הספר המשולב למדעי החיים (R.A.).
Materials
| 2 mL Potter-Elvehjem Glass/PTFE Tissue Grinder/Homogenizer | Omni International | 07-358029 | |
| 95% O2, 5% CO2 medical gas mixture | Potter for tissue grinding | ||
| ADP | Sigma | A 4386 | |
| Antimycin A | Sigma | A 8674 | Chemical |
| Ascorbate | Merck | PHR1279-1G | Chemical, dissolve in ethanol |
| BSA (fatty accid free) | Sigma | A 6003 | Chemical |
| CaCO3 | Sigma | C 4830 | Chemical |
| Cytochrome c | Sigma | C 7752 | Chemical |
| Digitonin | Sigma | D 5628 | Chemical |
| Dithiothreitol | Sigma | D 0632 | Chemical, dissolve in DMSO |
| D-Sucrose | Roth | 4621.1 | Chemical |
| Dulbecco’s modified Eagle’s medium (High glucose) | Fisher Scientific | 41965-039 | Chemical |
| Dulbecco’s modified Eagle’s medium (No Glucose) | Fisher Scientific | A14430-01 | |
| EGTA | Sigma | E 4378 | |
| Etomoxir | Sigma | E1905 | Chemical |
| Falcon 15 ml Conical Centrifuge Tubes | Fisher Scientific | AM12500 | Chemical |
| Falcon 50 ml Conical Centrifuge Tubes | Fisher Scientific | AM12501 | |
| FCCP | Sigma | C 2920 | |
| Glucose | Sigma | G7021 | Chemical, dissolve in ethanol |
| Glutamate | Sigma | G 1626 | Chemical |
| GlutaMax (100x) (200 nM L-alanyl-L-glutamine dipeptide) | Fisher Scientific | 35050061 | Chemical |
| HEK293 cells | ATTC | CRL-1573 | |
| Hemocytometer | Fisher Scientific | 0267151B | Instrument for cell counting |
| Hepes | Sigma | H 7523 | Chemical |
| Imidazole | Fluka | 56750 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| L-carnitine | Sigma | C0283 | Chemical |
| Malate | Sigma | M 1000 | Chemical |
| MES hydrate | Sigma | M8250 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Na2ATP | Sigma | A 2383 | Chemical |
| Na2Phosphocreatine | Sigma | P 7936 | Chemical |
| Na-pyruvate (100 mM) (100x) | Fisher Scientific | 11360070 | |
| NEAA (Non-essential amino acids) 100x | Fisher Scientific | 11140035 | |
| Normal FBS (10x) | Fisher Scientific | 10500064 | |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| O2k-Titration Set | Oroboros Instruments | 20820-03 | Hamilton syringes for chemical injections |
| Oligomycin | Sigma | O 4876 | Chemical, dissolve in ethanol |
| Palmitoylcarnitine | Sigma | P 4509 | Chemical |
| Penicillin-Streptomycin | Fisher Scientific | 15140122 | |
| Pierce BCA Protein Assay Kit | Fisher Scientific | 23227 | |
| Pyruvate | Sigma | P 2256 | Chemical |
| RIPA-Buffer | Fisher Scientific | 89900 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Saponin | Sigma | S7900 | Chemical |
Seahorse XF DMEM assay medium pack, pH 7.4 |
Agilent, Santa Clara, CA |
103680-100 | |
| Seahorse XFe96 Extracellular Flux Analyzer | Agilent, Santa Clara, CA |
High-throughput respirometry instrument | |
| Seahorse XFe96 FluxPak | Agilent, Santa Clara, CA |
Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
|
| Small scissors | Fisher Scientific | 08-951-20 | |
| Sodium azide | Sigma | S2002 | Chemical |
| Succinate | Sigma | S 2378 | Chemical |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
| Trypan Blue solution | Merck | 72-57-1 | Chemical |
| Trypsin 0.25% EDTA | Fisher Scientific | 25200056 | |
| Two thin-edged forceps | Fisher Scientific | 12-000-122 | |
| Uridine stock (500x) | Sigma | U3750 | Chemical |
References
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Mehta, M. M., Weinberg, S. E., Chandel, N. S. Mitochondrial control of immunity. Beyond ATP. Nature Reviews Immunology. 17 (10), 608-620 (2017).
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle. New perspectives of mitochondrial physiology. International Journal of Biochemistry and Cell Biology. 41 (10), 1837-1845 (2009).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 1-23 (2016).
- Boushel, R., Gnaiger, E., Schjerling, P., Skovbro, M., Kraunsøe, R., Dela, F. Patients with type 2 diabetes have normal mitochondrial function in skeletal muscle. Diabetologia. 50 (4), 790-796 (2007).
- Cogliati, S., et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13, 1-11 (2015).
- Gnaiger, E. Mitochondrial pathways and Respiratory control. An introduction to OXPHOS analysis. Bioenergetics communications. 5th ed. , (2020).
- Jackson, C. B., et al. Mutations in SDHD lead to autosomal recessive encephalomyopathy and isolated mitochondrial complex II deficiency. Journal of Medical Genetics. 51 (3), 170-175 (2014).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- Doerrier, C., Garcia-Souza, L. F., Krumschnabel, G., Wohlfarter, Y., Mészáros, A. T., Gnaiger, E. High-resolution fluorespirometry and oxphos protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7 (6), 1068-1085 (2012).
- García-Roche, M., Casal, A., Carriquiry, M., Radi, R., Quijano, C., Cassina, A. Respiratory analysis of coupled mitochondria in cryopreserved liver biopsies. Redox Biology. 17, 207-212 (2018).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. The EMBO Journal. 39 (13), 1-18 (2020).
- Cell metabolism assay kits. Seahorse assay kits and media Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-lits-reagents-cell-assay-media (2021)
- Chance, B., Williams, G. R. A method for the localization of sites for oxidative phosphorylation. Nature. 176 (4475), 250-254 (1955).
- Gnaiger, E., et al. Mitochondrial respiratory states and rates. MitoFit Preprint Arch. , (2019).
- Gnaiger, E. O2k-procedures: SOP O2k quality control 1: Polarographic oxygen sensors and accuracy of calibration Section Page. Oroboros. 03 (18), 1-21 (2020).
- Robinson, B. H., Petrova-Benedict, R., Buncic, J. R., Wallace, D. C. Nonviability of cells with oxidative defects in galactose medium: A screening test for affected patient fibroblasts. Biochemical Medicine and Metabolic Biology. 48 (2), 122-126 (1992).
- King, M. P., Attardi, G. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Fasching, M., Gnaiger, E. O2k quality control 2: Instrumental oxygen background correction and accuracy of oxygen flux. Mitochondrial Physiology Network. 14 (06), 1-14 (2016).
- Gnaiger, E., Lassnig, B., Kuznetsov, A., Rieger, G., Margreiter, R. Excess capacity of cytochrome c oxidase. Journal of Experimental Biology. 1139, 1129-1139 (1998).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Fontana-Ayoub, M., Fasching, E., Gnaiger, Selected media and chemicals for respirometry with mitochondrial preparations. Mitochondrial Physiology Network. 02 (17), 1-9 (2014).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods in Enzymology. 542, 163-181 (2014).
- Nászai, A., Terhes, E., Kaszaki, J., Boros, M., Juhász, L. Ca(2+)N it be measured? Detection of extramitochondrial calcium movement with high-resolution fluorespirometry. Scientific Reports. 9 (1), 1-13 (2019).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: From diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), 234 (2019).
- Mercier-Letondal, P., Marton, C., Godet, Y., Galaine, J. Validation of a method evaluating T cell metabolic potential in compliance with ICH Q2 (R1). Journal of Translational Medicine. 19 (1), 1-15 (2021).
- Sauerbeck, A., et al. Analysis of regional brain mitochondrial bioenergetics and susceptibility to mitochondrial inhibition utilizing a microplate based system. Journal of Neuroscience Methods. 198 (1), 36-43 (2011).
- Jackman, M. R., Willis, W. T. Characteristics of mitochondria isolated from type I and type IIb skeletal muscle. American Journal of Physiology – Cell Physiology. 270 (2), 673-678 (1996).
- Ponsot, E., et al. Mitochondrial tissue specificity of substrates utilization in rat cardiac and skeletal muscles. Journal of Cellular Physiology. 203 (3), 479-486 (2005).
- Schönfeld, P., Reiser, G. Why does brain metabolism not favor burning of fatty acids to provide energy-Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow and Metabolism. 33 (10), 1493-1499 (2013).
- Calderon-Dominguez, M., Mir, J. F., Fucho, R., Weber, M., Serra, D., Herrero, L. Fatty acid metabolism and the basis of brown adipose tissue function. Adipocyte. 5 (2), 98-118 (2016).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode. Current Protocols in Toxicology. 2014, 1-16 (2014).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using Seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), 21746 (2011).
- Jordá, A., Zaragozá, R., Portolés, M., Báguena-Cervellera, R., Renau-Piqueras, J. Long-term high-protein diet induces biochemical and ultrastructural changes in rat liver mitochondria. Archives of Biochemistry and Biophysics. 265 (2), 241-248 (1988).
- Jackson, C. B., Gallati, S., Schaller, A. QPCR-based mitochondrial DNA quantification: Influence of template DNA fragmentation on accuracy. Biochemical and Biophysical Research Communications. 423 (3), 441-447 (2012).
- Hirsch, H. M. Tissue autoxidation inhibitors: II. The presence of inhibitor in intact cells; Assay of liver and hepatoma effect on radio-oxidations. 암 연구학. 16 (11), 1076-1082 (1956).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), 18317 (2011).
- Tanumihardja, E., Slaats, R. H., Van Der Meer, A. D., Passier, R., Olthuis, W., Van Den Berg, A. Measuring both pH and O2 with a single On-Chip sensor in cultures of human pluripotent stem cell-derived cardiomyocytes to track induced changes in cellular metabolism. ACS Sensors. 6 (1), 267-274 (2021).
- Harms, F., Stolker, R. J., Mik, E. Cutaneous respirometry as novel technique to monitor mitochondrial function: A feasibility study in healthy volunteers. PLoS ONE. 11 (7), 159544 (2016).
- Levitsky, Y., et al. Micro-respirometry of whole cells and isolated mitochondria. RSC Advances. 9 (57), 33257-33267 (2019).

