Hochauflösende Respirometrie zur Beurteilung der Bioenergetik in Zellen und Geweben mittels kammer- und plattenbasierter Respirometer
Summary
Die Beurteilung der oxidativen Phosphorylierung mit hochauflösenden Respirometern ist zu einem integralen Bestandteil der Funktionsanalyse von Mitochondrien und zellulärem Energiestoffwechsel geworden. Hier stellen wir Protokolle für die Analyse des zellulären Energiestoffwechsels mit kammer- und mikroplattenbasierten hochauflösenden Respirometern vor und diskutieren die wichtigsten Vorteile jedes Geräts.
Abstract
Die hochauflösende Respirometrie (HRR) ermöglicht die Überwachung der oxidativen Phosphorylierung in Echtzeit zur Analyse einzelner zellulärer Energiezustände und zur Beurteilung von Atmungskomplexen unter Verwendung diversifizierter Substrat-Entkoppler-Inhibitor-Titrationsprotokolle (SUIT). Hier wird die Verwendung von zwei hochauflösenden Atemschutzgeräten demonstriert und eine grundlegende Sammlung von Protokollen vorgestellt, die für die Analyse von kultivierten Zellen, Skelett- und Herzmuskelfasern sowie Weichteilen wie Gehirn und Leber anwendbar sind. Protokolle für kultivierte Zellen und Gewebe werden für ein kammerbasiertes Respirometer und kultivierte Zellen für ein mikroplattenbasiertes Respirometer bereitgestellt, die beide Standard-Atmungsprotokolle umfassen. Zu Vergleichszwecken werden CRISPR-entwickelte HEK293-Zellen, die einen Mangel an mitochondrialer Translation aufweisen und zu einem Mangel an multiplen Atemwegen führen, mit beiden Geräten verwendet, um zelluläre Defekte in der Atmung nachzuweisen. Beide Respirometer ermöglichen eine umfassende Messung der Zellatmung mit ihren jeweiligen technischen Vorzügen und ihrer Eignung in Abhängigkeit von der untersuchten Forschungsfrage und dem untersuchten Modell.
Introduction
Mitochondrien erfüllen die Schlüsselenergieversorgung und sind eine unterteilte Organelle, die zu essentiellen zellulären bioenergetischen und metabolischen Prozessen wie Anabolismus von Nukleotiden, Lipiden und Aminosäuren, Eisen-Schwefel-Cluster-Biogenese beiträgt und an der Signalgebung beteiligt ist, wie z.B. kontrollierter Zelltod 1,2,3 . Mitochondriale Bioenergetik durch oxidative Phosphorylierung trägt zu fast allen zellulären Prozessen innerhalb der Zelle bei, und folglich sind mitochondriale Dysfunktionen primären oder sekundären Ursprungs mit einem breiten Spektrum von Krankheitszuständen verbunden 4,5. Mitochondriale Dysfunktion beinhaltet nicht nur Veränderungen in der Struktur oder der mitochondrialen Dichte, sondern auch in der Qualität und Regulierung des Atmungssystems6. Dieses qualitative Element umfasst Substratkontrolle, Kopplungseigenschaften, posttranslationale Modifikationen, Cristae-Dynamik und respiratorische Superkomplexe 7,8. Daher ist eine genaue Analyse der mitochondrialen Bioenergetik für experimentelle und diagnostische Ansätze zur Beurteilung des Energiestoffwechsels der Zelle wichtig für Gesundheit und Krankheit.
Die mitochondriale oxidative Phosphorylierung (OXPHOS) ist eine Abfolge von Reaktionen innerhalb des Atmungssystems oder Elektronentransfersystems (ETS) zur Erzeugung von Zellenergie durch Adenosintriphosphat (ATP)9. Der multienzymatische Schritt zur Nutzung der Energie vom Elektronenfluss durch die Komplexe I und II bis zum Komplex IV erzeugt einen elektrochemischen Protonengradienten über die innere mitochondriale Membran, der anschließend für die Phosphorylierung von Adenosindiphosphat (ADP) zu ATP über den Komplex V (F1FO ATP-Synthase) verwendet wird (Abbildung 1A).
Zunächst werden während des Tricarbonsäurezyklus (TCA), der Glykolyse und der Pyruvatoxidation Zwei-Elektronen-Träger erzeugt: Nicotinamidadenindinukleotid (NADH) und Dihydroflavinadenindinukleotid (FADH2). NADH wird am Komplex I (NADH-Dehydrogenase) oxidiert, bei dem zwei Elektronen auf Coenzym Q übertragen werden (Chinon wird zu Chinol reduziert), während Protonen in den Intermembranraum (IMS) gepumpt werden. Zweitens oxidiert Komplex II (Succinat-Dehydrogenase) FADH2 und speist die Elektronen dem Coenzym Q zu, ohne Protonen zu pumpen. Drittens werden im Komplex III (Cytochrom-c-Oxidoreduktase) Elektronen aus Coenzym Q auf Cytochrom c übertragen, während Protonen in das IMS gepumpt werden. Viertens überträgt Cytochrom c die Elektronen auf den Komplex IV (Cytochrom-c-Oxidase), den letzten Komplex, um Protonen zu pumpen, und wo Sauerstoff als Elektronenakzeptor fungiert, um Protonen zu assimilieren und schließlich Wasser zu bilden. Es ist dieser Sauerstoff, den die Mitochondrien verbrauchen, der mit einem Oxygraphen gemessen werden kann. Schließlich werden die Protonen, die aus Komplex I, Komplex III und Komplex IV erzeugt werden, verwendet, um Komplex V zu rotieren, wodurch ATP9 erzeugt wird.
Wichtig ist, dass der Elektronentransfer nicht nur linear erfolgt, sondern auch als Elektronentransportkette bezeichnet wird. Stattdessen können Elektronen über mehrere Atmungswege in den Coenzym-Q-Pool übertragen werden und erleichtern den konvergenten Elektronenfluss. NADH-Substrate und Succinat können beispielsweise über Komplex I bzw. Komplex II eintreten. Elektronen aus der Fettsäureoxidation können über den elektronenübertragenden Flavoproteinkomplex gespendet werden. Tatsächlich erfordert eine umfassende Analyse von OXPHOS einen ganzheitlichen Ansatz mit geeigneten Kraftstoffsubstraten (Abbildung 1A).
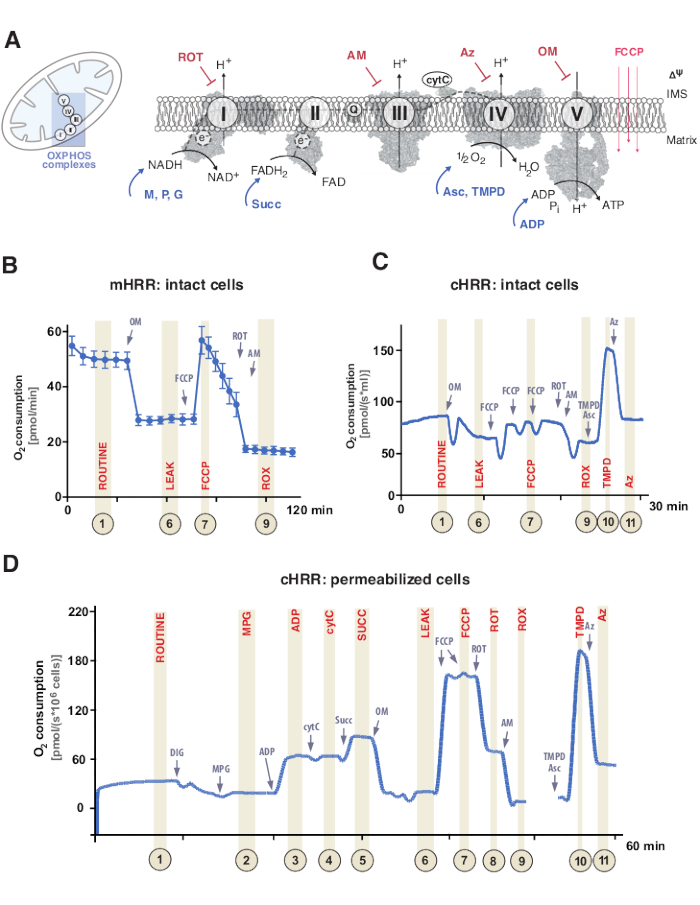
Abbildung 1: Mitochondriale oxidative Phosphorylierung und spezifische Substrat- und Inhibitorprotokolle. (A) Mitochondrium und Schema des Elektronentransfersystems (CI-CIV) und der mitochondrialen F1F0 ATP-Synthase (CV). Alle Strukturen sind von PDB. Die Abbildungen zeigen nur Substrate und Inhibitoren, die in dieser Studie beschrieben werden). (B) Probenspur des Sauerstoffflusses in intakten HEK293-Zellen unter Verwendung des Standardprotokolls in einem mHRR-Gerät. (C) Probenspur des Sauerstoffflusses in intakten HEK293-Zellen unter Verwendung des Standardprotokolls in einem cHRR-Gerät. (D) Probenspur des Sauerstoffflusses in permeabilisierten menschlichen Fibroblasten von einem gesunden Spender mit entsprechendem SUIT-Protokoll. Abkürzungen: 1 = Routinemäßige Atmung intakter Zellen; 2 = Zustand 2; 3 = Zustand 3(I); 4 = Zustand 3(I) mit cytC; 5 = Zustand 3 (I+II); 6 = Leck (OM); 7 = ETS-Kapazität; 8 = S(ROT); 9 = ROX; 10 = TMPD; 11 = Az. ROT = Rotenon, AM = Antimycin, ATP = Adenosintriphosphat, Az = Azid, OM = Oligomycin, FCCP = Carbonylcyanid p-trifluor-methoxyphenyl-hydrazon; Asc = Ascorbat, TMPD = N,N,N′,N′-Tetramethyl-p-phenylendiamin, Succ = Succinat, M = Malat, P = Pyruvat, ADP = Adenosindiphosphat, NAD = Nicotinamidadenindinukleotid, IMS = Intermembranraum, FAD = Flavinadenindinukleotid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die Analyse der mitochondrialen OXPHOS-Kapazität unter Verwendung von HRR ist zu einer instrumentellen biochemischen Methode von diagnostischem Wert geworden, nicht nur für primäre mitochondriale Defekte 10,11, sondern auch für alle anderen Bereiche der Biologie wie Krebs und Alterung 12. HRR ermöglicht die Bestimmung der Zellatmung durch die Analyse der mitochondrialen OXPHOS-Kapazität, die den individuellen oder kombinierten Mangel an mitochondrialen Atemwegskomplexen direkt widerspiegelt und indirekt mit zellulärer Dysfunktion und verändertem Energiestoffwechsel assoziiert ist9. Methodisch werden Atmungsmessungen mit Zellen, Gewebe oder isolierten Mitochondrien 11,13,14 durchgeführt, wobei gefrorenes Material nur teilweise geeignet ist 15,16. Es wird gezeigt, dass gefrorenes Gewebe ein intaktes ETS mit beibehaltener superkomplexer Stabilitätaufweist 15. So werden im Gegensatz zu herkömmlichen TCA-Zwischenprodukten entsprechende Substrate direkt in das ETS eingespeist. Die Kopplung zwischen der ETS- und ATP-Synthese geht jedoch verloren, da die Membranintegrität durch Frostschäden (Eiskristallbildung) beeinträchtigt wird.
Respirationsexperimente finden normalerweise bei einer physiologischen Temperatur von 37 °C für Endotherme in nicht permeabilisierten oder permeabilisierten Zellen oder Geweben statt. Während erstere den zytosolischen Stoffwechselkontext betrachtet, liefert letztere den energetischen Beitrag einzelner OXPHOS-Komplexe und der ATPase durch die Zugabe spezifischer Substrate (und Inhibitoren). Die Sequenz und Variation von Substraten und Inhibitoren hat zur Entwicklung einer Vielzahl von SUIT-Protokollen17 und Assays18 geführt, um verschiedene wissenschaftliche Fragen der OXPHOS-Funktion zu beantworten (überprüft unter12). Das Basisprotokoll der Zellatmung bewertet vier verschiedene Zustände: i) Routineatmung – die Atmung in einem jeweiligen Atmungsmedium ohne Zugabe von Substraten oder Inhibitoren, die aber endogene Substrate verbrauchen. Dieser Zustand kann allgemeine OXPHOS- oder sekundär induzierte Atmungsdefekte aufdecken, die beispielsweise durch veränderte Metabolitenprofile verursacht werden. Als nächstes zeigt die Zugabe des ATPase-Inhibitors Oligomycin die Permeabilität der inneren mitochondrialen Membran für Protonen, definiert als ii) Leckrespiration. Die anschließende Titration eines Protonophors wie des Entkopplers Carbonylcyanid p-trifluor-methoxyphenyl-hydrazon (FCCP) ermöglicht es, den Zustand zu bestimmen, in dem die ETS-Kapazität in einem offenen Transmembran-Protonenschaltungsmodus, definiert als iii) entkoppelte Atmung, maximal ist. Wichtig ist, dass ein entkoppelter Zustand auch durch experimentelle Eingriffe durch übermäßige mechanische Schädigung der mitochondrialen Membranen auftreten kann. Umgekehrt bezieht sich der nicht gekoppelte Zustand auf die respiratorische Entkopplung durch einen intrinsischen Mechanismus, der physiologisch kontrolliert wird. Schließlich bestimmt die vollständige Hemmung des ETS durch Zugabe des Komplex-III-Inhibitors Antimycin und des Komplex-I-Inhibitors Rotenon den Restsauerstoffverbrauch (ROX) aus nicht-mitochondrialen sauerstoffverbrauchenden Prozessen (Abbildung 1A-C).
Die mitochondriale Bioenergetik besteht aus fünf verschiedenen Atmungszuständen19,20. Zustand 1 Atmung ist ohne zusätzliche Substrate oder ADP, außer für das, was endogen verfügbar ist. Nach der Zugabe von ADP, aber immer noch keine Substrate, wird Zustand 2 Atmung erreicht. Wenn Substrate hinzugefügt werden, die Elektronentransfer und ATP-Synthese ermöglichen, wird die Atmung im Zustand 3 erreicht. In diesem Zustand kann die OXPHOS-Kapazität bei gesättigten Konzentrationen von ADP, anorganischem Phosphat, Sauerstoff, NADH- und Succinat-verknüpften Substraten definiert werden. Zustands-4-Atmung oder LEAK-Atmung kann als ein Zustand ohne ADP oder chemisch gehemmte ATP-Synthasen bei ausreichenden Substraten definiert werden. Schließlich, wenn der gesamte Sauerstoff in einer geschlossenen Kammer erschöpft (anoxisch) ist, wird die Atmung von Zustand 5 beobachtet.
Es gibt mehrere Methoden, um zelluläre Energiezustände14 zu bewerten, wobei zwei Geräte die aktuelle Echtzeitbewertung von OXPHOS durch Analyse des Sauerstoffverbrauchs dominieren, gemessen als Funktion der Abnahme des Sauerstoffs im Laufe der Zeit in einem geschlossenen Kammersystem mit unterschiedlicher Anwendbarkeit, abhängig vom experimentellen Modell und der Forschungsfrage: dem hochauflösenden Respirometer Oroboros 2k und dem extrazellulären Flussanalysator Seahorse XF. Beide Geräte erfassen die Sauerstoffverbrauchsraten als Abnahme der Picomolen (pmol) von Sauerstoff (O2) pro Sekunde als absoluten Wert innerhalb der Kammer oder Mikrotiterplattenvertiefung. Der spezifische Sauerstoffverbrauch pro Masse wird durch Normalisierung des jeweiligen Sauerstoffverbrauchs in einem bestimmten Pufferrezept pro Anzahl von Zellen (Millionen), Gewebegewicht (mg) oder Proteinmenge erhalten.
Das O2k (Oroboros Instruments) ist ein geschlossenes Zweikammersystem, das mit einem polarographischen Sauerstoffsensor (abgekürzt als kammerbasiertes hochauflösendes Respirometer: cHRR) ausgestattet ist. Jede Versuchskammer fasst 2 ml Flüssigkeit, die durch Magnetrührer homogen gehalten wird. Der polarographische Sauerstoffsensor verwendet einen amperometrischen Ansatz, um den Sauerstoff zu messen: Er enthält eine Goldkathode, eine Silber/Silberchlorid-Anode und dazwischen eine KCI-Lösung, die eine elektrochemische Zelle erzeugt, an die eine Spannung (0,8 V) angelegt wird. Sauerstoff aus dem Assay-Medium diffundiert durch eine 25 μm fluorierte Ethylen-Propylen-Membran (O2-permeable) und wird an der Kathode reduziert, wodurch Wasserstoffperoxid entsteht. An der Anode wird Silber durch Wasserstoffperoxid oxidiert und erzeugt einen elektrischen Strom. Dieser elektrische Strom (Ampere) steht in einem linearen Verhältnis zum Sauerstoffpartialdruck. Der Partialdruck von Sauerstoff und der Sauerstofflöslichkeitsfaktor des Assaymediums werden verwendet, um die Sauerstoffkonzentration zu berechnen. Da der Sauerstoffpartialdruck von der Versuchstemperatur abhängig ist und polarographische Messungen temperaturempfindlich sind, müssen Temperaturschwankungen durch einen Peltier-Heizblock präzise (±0,002 °C) geregelt werden. Die Temperatur kann in einem Bereich von 4 °C und 47 °C geregelt werden.
Der Seahorse XF extracellular flux analyzer (Agilent) ist ein plattenbasiertes System mit 24- oder 96-Well-Mikroplattenformat, bei dem drei Fluoreszenzelektroden den Sauerstoffverbrauch im Laufe der Zeit in jedem Well messen (abgekürzt als microplate-based high-resolution respirometer: mHRR). Für die automatisierte Injektion während des Assays stehen maximal vier Ports in der Assay-Kartusche zur Verfügung. Ein Assay enthält mehrere Zyklen mit jeweils drei Phasen: 1) Mischen, 2) Warten und 3) Messung. Während der Messphase werden Sensorsonden in die Mikroplatte abgesenkt, wodurch eine vorübergehend geschlossene Kammer mit 7-10 μL Volumen zur Messung des emittierten Lichts entsteht. Dieses Licht wird von polymereingebetteten Fluorophoren an der Spitze der Sensorsonden emittiert, dieO2 basierend auf Phosphoreszenzlöschung erfassen. Die Intensität des Fluoreszenzsignals ist proportional zuO2 und wird durch die Temperatur des Sensors und des Assay-Mediums beeinflusst. Daher erfordert eine genaue Sauerstoffschätzung einen relativen Ansatz mit einer Hintergrundbohrung ohne Probe. Die Wiederherstellung der Sauerstoffkonzentration erfolgt während der Mischphase, wenn sich der Sensor nach oben und unten bewegt, um das Volumen über der temporären Kammer zu mischen. Jeder Zyklus berechnet eine Sauerstoffverbrauchsrate. Die Temperatur kann in einem Bereich von 16 °C und 42 °C geregelt werden.
HRR ist der Goldstandard zur Beurteilung der zellulären Bioenergetik bei primären und Mitochondrien-assoziierten Erkrankungen und des allgemeinen Zellstoffwechsels. In dieser Studie werden grundlegende Protokolle für HRR bereitgestellt, um die OXPHOS-Funktion in Zellen und Geweben zu beurteilen.
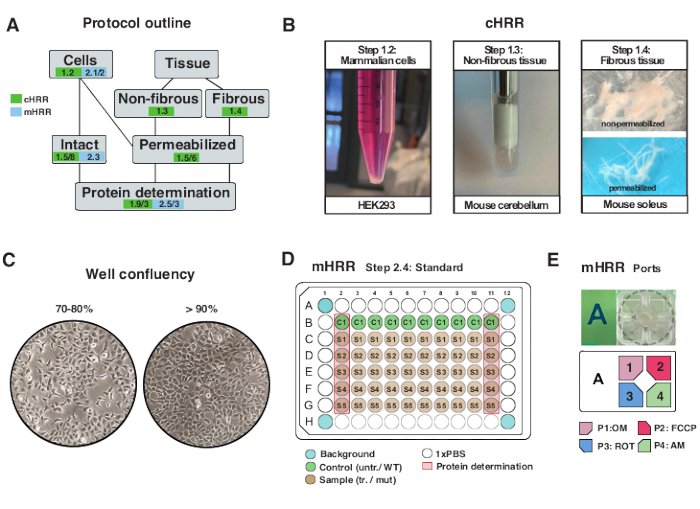
Abbildung 2: Arbeitsablauf für Zell- und Gewebepräparate für cHRR und Zellpräparation für die mHRR-Respirometrie. (A) Überblick über die bereitgestellten Protokolle. (B) Säugetierzellen (Schritt 1.2): HEK293-Pellet entspricht 3 x 106 Zellen (linkes Feld). Nicht faseriges Gewebe (Schritt 1.3): Herstellung von murinem Kleinhirnlysat in 2 ml Teflon-Töpfer (mittlere Tafel). Saponin-induzierte Permeabilisierung der Skelettmuskulatur (Schritt 1.4) rechtes Panel) für die cHRR-Respirometrie. (C) Standard-Mikrotiterplatten-Seeding-Layout (Schritt 2.4) und Konfluenzprüfung für die Analyse eukaryotischer Zellen (HEK293) für die mHRR-Respirometrie. (D, E) Schema der Injektionsöffnungsbeladung für die mHRR-Respirometrie (Schritt 2.4). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Traditionell wurde die mitochondriale Bioenergetik mit Clark-artigen Sauerstoffelektroden untersucht. Ein Mangel an Auflösung und Durchsatz rechtfertigte jedoch den technologischen Fortschritt. Bis heute sind der O2k (als cHRR bezeichnet) und der Seahorse XF96 Flux Analyzer (als mHRR bezeichnet) im Bereich der zellulären Bioenergetik weit verbreitet. Hier präsentieren wir eine verständliche Sammlung von Protokollen für die Analyse des zellulären Energiestoffwechsels durch Bewertung der mitochondrialen Atmung mit cH…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde durch Mittel der Akademie von Finnland (C.B.J), der Magnus Ehrnroot Foundation (C.B.J.) und eines Doktorandenstipendiums der Integrated Life Sciences Graduate School (R.A.) unterstützt.
Materials
| 2 mL Potter-Elvehjem Glass/PTFE Tissue Grinder/Homogenizer | Omni International | 07-358029 | |
| 95% O2, 5% CO2 medical gas mixture | Potter for tissue grinding | ||
| ADP | Sigma | A 4386 | |
| Antimycin A | Sigma | A 8674 | Chemical |
| Ascorbate | Merck | PHR1279-1G | Chemical, dissolve in ethanol |
| BSA (fatty accid free) | Sigma | A 6003 | Chemical |
| CaCO3 | Sigma | C 4830 | Chemical |
| Cytochrome c | Sigma | C 7752 | Chemical |
| Digitonin | Sigma | D 5628 | Chemical |
| Dithiothreitol | Sigma | D 0632 | Chemical, dissolve in DMSO |
| D-Sucrose | Roth | 4621.1 | Chemical |
| Dulbecco’s modified Eagle’s medium (High glucose) | Fisher Scientific | 41965-039 | Chemical |
| Dulbecco’s modified Eagle’s medium (No Glucose) | Fisher Scientific | A14430-01 | |
| EGTA | Sigma | E 4378 | |
| Etomoxir | Sigma | E1905 | Chemical |
| Falcon 15 ml Conical Centrifuge Tubes | Fisher Scientific | AM12500 | Chemical |
| Falcon 50 ml Conical Centrifuge Tubes | Fisher Scientific | AM12501 | |
| FCCP | Sigma | C 2920 | |
| Glucose | Sigma | G7021 | Chemical, dissolve in ethanol |
| Glutamate | Sigma | G 1626 | Chemical |
| GlutaMax (100x) (200 nM L-alanyl-L-glutamine dipeptide) | Fisher Scientific | 35050061 | Chemical |
| HEK293 cells | ATTC | CRL-1573 | |
| Hemocytometer | Fisher Scientific | 0267151B | Instrument for cell counting |
| Hepes | Sigma | H 7523 | Chemical |
| Imidazole | Fluka | 56750 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| L-carnitine | Sigma | C0283 | Chemical |
| Malate | Sigma | M 1000 | Chemical |
| MES hydrate | Sigma | M8250 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Na2ATP | Sigma | A 2383 | Chemical |
| Na2Phosphocreatine | Sigma | P 7936 | Chemical |
| Na-pyruvate (100 mM) (100x) | Fisher Scientific | 11360070 | |
| NEAA (Non-essential amino acids) 100x | Fisher Scientific | 11140035 | |
| Normal FBS (10x) | Fisher Scientific | 10500064 | |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| O2k-Titration Set | Oroboros Instruments | 20820-03 | Hamilton syringes for chemical injections |
| Oligomycin | Sigma | O 4876 | Chemical, dissolve in ethanol |
| Palmitoylcarnitine | Sigma | P 4509 | Chemical |
| Penicillin-Streptomycin | Fisher Scientific | 15140122 | |
| Pierce BCA Protein Assay Kit | Fisher Scientific | 23227 | |
| Pyruvate | Sigma | P 2256 | Chemical |
| RIPA-Buffer | Fisher Scientific | 89900 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Saponin | Sigma | S7900 | Chemical |
Seahorse XF DMEM assay medium pack, pH 7.4 |
Agilent, Santa Clara, CA |
103680-100 | |
| Seahorse XFe96 Extracellular Flux Analyzer | Agilent, Santa Clara, CA |
High-throughput respirometry instrument | |
| Seahorse XFe96 FluxPak | Agilent, Santa Clara, CA |
Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
|
| Small scissors | Fisher Scientific | 08-951-20 | |
| Sodium azide | Sigma | S2002 | Chemical |
| Succinate | Sigma | S 2378 | Chemical |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
| Trypan Blue solution | Merck | 72-57-1 | Chemical |
| Trypsin 0.25% EDTA | Fisher Scientific | 25200056 | |
| Two thin-edged forceps | Fisher Scientific | 12-000-122 | |
| Uridine stock (500x) | Sigma | U3750 | Chemical |
References
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Mehta, M. M., Weinberg, S. E., Chandel, N. S. Mitochondrial control of immunity. Beyond ATP. Nature Reviews Immunology. 17 (10), 608-620 (2017).
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle. New perspectives of mitochondrial physiology. International Journal of Biochemistry and Cell Biology. 41 (10), 1837-1845 (2009).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 1-23 (2016).
- Boushel, R., Gnaiger, E., Schjerling, P., Skovbro, M., Kraunsøe, R., Dela, F. Patients with type 2 diabetes have normal mitochondrial function in skeletal muscle. Diabetologia. 50 (4), 790-796 (2007).
- Cogliati, S., et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13, 1-11 (2015).
- Gnaiger, E. Mitochondrial pathways and Respiratory control. An introduction to OXPHOS analysis. Bioenergetics communications. 5th ed. , (2020).
- Jackson, C. B., et al. Mutations in SDHD lead to autosomal recessive encephalomyopathy and isolated mitochondrial complex II deficiency. Journal of Medical Genetics. 51 (3), 170-175 (2014).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- Doerrier, C., Garcia-Souza, L. F., Krumschnabel, G., Wohlfarter, Y., Mészáros, A. T., Gnaiger, E. High-resolution fluorespirometry and oxphos protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7 (6), 1068-1085 (2012).
- García-Roche, M., Casal, A., Carriquiry, M., Radi, R., Quijano, C., Cassina, A. Respiratory analysis of coupled mitochondria in cryopreserved liver biopsies. Redox Biology. 17, 207-212 (2018).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. The EMBO Journal. 39 (13), 1-18 (2020).
- Cell metabolism assay kits. Seahorse assay kits and media Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-lits-reagents-cell-assay-media (2021)
- Chance, B., Williams, G. R. A method for the localization of sites for oxidative phosphorylation. Nature. 176 (4475), 250-254 (1955).
- Gnaiger, E., et al. Mitochondrial respiratory states and rates. MitoFit Preprint Arch. , (2019).
- Gnaiger, E. O2k-procedures: SOP O2k quality control 1: Polarographic oxygen sensors and accuracy of calibration Section Page. Oroboros. 03 (18), 1-21 (2020).
- Robinson, B. H., Petrova-Benedict, R., Buncic, J. R., Wallace, D. C. Nonviability of cells with oxidative defects in galactose medium: A screening test for affected patient fibroblasts. Biochemical Medicine and Metabolic Biology. 48 (2), 122-126 (1992).
- King, M. P., Attardi, G. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Fasching, M., Gnaiger, E. O2k quality control 2: Instrumental oxygen background correction and accuracy of oxygen flux. Mitochondrial Physiology Network. 14 (06), 1-14 (2016).
- Gnaiger, E., Lassnig, B., Kuznetsov, A., Rieger, G., Margreiter, R. Excess capacity of cytochrome c oxidase. Journal of Experimental Biology. 1139, 1129-1139 (1998).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Fontana-Ayoub, M., Fasching, E., Gnaiger, Selected media and chemicals for respirometry with mitochondrial preparations. Mitochondrial Physiology Network. 02 (17), 1-9 (2014).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods in Enzymology. 542, 163-181 (2014).
- Nászai, A., Terhes, E., Kaszaki, J., Boros, M., Juhász, L. Ca(2+)N it be measured? Detection of extramitochondrial calcium movement with high-resolution fluorespirometry. Scientific Reports. 9 (1), 1-13 (2019).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: From diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), 234 (2019).
- Mercier-Letondal, P., Marton, C., Godet, Y., Galaine, J. Validation of a method evaluating T cell metabolic potential in compliance with ICH Q2 (R1). Journal of Translational Medicine. 19 (1), 1-15 (2021).
- Sauerbeck, A., et al. Analysis of regional brain mitochondrial bioenergetics and susceptibility to mitochondrial inhibition utilizing a microplate based system. Journal of Neuroscience Methods. 198 (1), 36-43 (2011).
- Jackman, M. R., Willis, W. T. Characteristics of mitochondria isolated from type I and type IIb skeletal muscle. American Journal of Physiology – Cell Physiology. 270 (2), 673-678 (1996).
- Ponsot, E., et al. Mitochondrial tissue specificity of substrates utilization in rat cardiac and skeletal muscles. Journal of Cellular Physiology. 203 (3), 479-486 (2005).
- Schönfeld, P., Reiser, G. Why does brain metabolism not favor burning of fatty acids to provide energy-Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow and Metabolism. 33 (10), 1493-1499 (2013).
- Calderon-Dominguez, M., Mir, J. F., Fucho, R., Weber, M., Serra, D., Herrero, L. Fatty acid metabolism and the basis of brown adipose tissue function. Adipocyte. 5 (2), 98-118 (2016).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode. Current Protocols in Toxicology. 2014, 1-16 (2014).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using Seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), 21746 (2011).
- Jordá, A., Zaragozá, R., Portolés, M., Báguena-Cervellera, R., Renau-Piqueras, J. Long-term high-protein diet induces biochemical and ultrastructural changes in rat liver mitochondria. Archives of Biochemistry and Biophysics. 265 (2), 241-248 (1988).
- Jackson, C. B., Gallati, S., Schaller, A. QPCR-based mitochondrial DNA quantification: Influence of template DNA fragmentation on accuracy. Biochemical and Biophysical Research Communications. 423 (3), 441-447 (2012).
- Hirsch, H. M. Tissue autoxidation inhibitors: II. The presence of inhibitor in intact cells; Assay of liver and hepatoma effect on radio-oxidations. 암 연구학. 16 (11), 1076-1082 (1956).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), 18317 (2011).
- Tanumihardja, E., Slaats, R. H., Van Der Meer, A. D., Passier, R., Olthuis, W., Van Den Berg, A. Measuring both pH and O2 with a single On-Chip sensor in cultures of human pluripotent stem cell-derived cardiomyocytes to track induced changes in cellular metabolism. ACS Sensors. 6 (1), 267-274 (2021).
- Harms, F., Stolker, R. J., Mik, E. Cutaneous respirometry as novel technique to monitor mitochondrial function: A feasibility study in healthy volunteers. PLoS ONE. 11 (7), 159544 (2016).
- Levitsky, Y., et al. Micro-respirometry of whole cells and isolated mitochondria. RSC Advances. 9 (57), 33257-33267 (2019).

