في التعبير البيضة من الرنا الميكروي في بطني الدماغ المتوسط الفرخ
Summary
التعبير خارج الرحم هو أسلوب واحد لتوضيح دور microRNAs في نمو الدماغ. ومع ذلك، واستهداف مناطق محددة باستخدام التثقيب الكهربائي في البيضة هو التحدي. هنا، وتبين لنا وسيلة فعالة لمناطق الدماغ المتوسط بطني وظهري electroporate انتقائي.
Abstract
الرنا غير الترميز لاعبين إضافية في تنظيم التعبير الجيني. المستهدفة في التثقيب الكهربائي البيضة من المجالات المحددة يوفر أداة فريدة للسيطرة المكاني والزماني للخارج الرحم التعبير الرنا الميكروي. ومع ذلك، وهياكل الدماغ مثل المخ الأوسط بطني بطني هي صعبة نوعا ما للوصول إلى أي تلاعب. هنا، علينا أن نظهر وسيلة فعالة ل electroporate ميرنا في الدماغ المتوسط البطني باستخدام أقطاب البلاتين رقيقة. يقدم هذا الأسلوب وسيلة يمكن الاعتماد عليها لبالنقل مناطق معينة من المخ الأوسط وأداة مفيدة لفي الدراسات المجراة.
Introduction
الاعتراف الرنا صغيرة غير الترميز كلاعبين إضافية للتعبير الجين أطلقت التعقيد جديدة لتنظيم الجيني البرمجة / الجينات. أنواع مختلفة من الرنا غير الترميز لها أهمية وظيفية في الخلايا العصبية، بما في ذلك الصغيرة غير الترميز الرنا 1-4. MicroRNAs (مير أو ميرنا) على سبيل المثال تظهر ملامح التعبير متميزة وتغيير في العقول النامية 5. المستهدفة في التثقيب الكهربائي البيضة من افراخ الدجاج يوفر فرصة فريدة للسيطرة الزمانية والمكانية في التعبير الجيني وإسكات خلال التنمية.
هذا الفيديو يوضح الخطوات المختلفة لأداء التعبير خارج الرحم من ميرس في مناطق معينة من الدماغ المتوسط الفرخ في البيضة باستخدام التثقيب الكهربائي 6-10. لضمان وجود تأثير طويل الأمد لهذه الرناوات الصغيرة غير الترميز في الخلايا، تم استنساخ تسلسل الحمض النووي من ميرس في ناقلات أحادية أو ثنائية cistronic. لفي التثقيب الكهربائي البيضة، مير تحتوي على الخامسيتم حقن ector في الأنبوب العصبي الدماغ المتوسط من خلال تعريض الجنين بعد إجراء نافذة صغيرة في قشرة البيضة. لبالنقل مناطق معينة من الدماغ المتوسط بالإضافة صغيرة (الأنود) وناقص (الكاثود) وتوضع أقطاب البلاتين في مواقف معينة. لترنسفكأيشن الدماغ المتوسط البطني، يتم وضع القطب الموجب تحت الدماغ المتوسط بطني اليسار والكاثود فوق النصف الأيمن من الدماغ المتوسط قبل تطبيق الحالي. يتم إغلاق فتحة في قشر البيض مع الشريط ويتم تحضين الأجنة لطالما المطلوبة لأي تحليل. هذا الأسلوب وقد وصفت في الأصل من قبل موراماتسو وآخرون. 6 وتحسينها من خلال Momose وآخرون. 8 لترنسفكأيشن منطقة معينة.
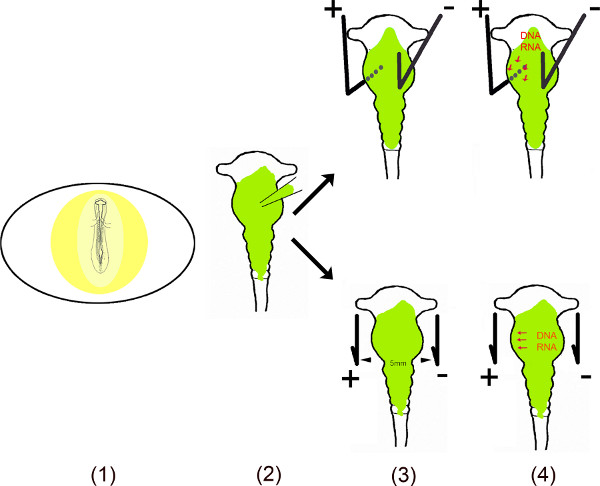
نظرة عامة التخطيطي.
- يتعرض الجنين في البيضة من خلال خفض نافذة صغيرة في اله قشر البيض.
- يتم حقن ناقلات المنحل (ق) في الدماغ المتوسط باستخدام الشعيرات الدموية الدقيقة.
- قطبين – وضعت بالتوازي أو تحت وفوق الجنين – توليد حقل كهربائي نابض.
- الحقل الكهربائي يخلق زمنيا المسام في غشاء الخلية، والتي تسهل الدخول إلى الخلية بواسطة الحمض النووي المشحونة سلبا (أو RNA) تنجذب إلى القطب الموجب 11،12.
Protocol
Representative Results
Discussion
يوضح هذا الفيديو وسيلة فعالة لبالنقل البلازميد إلى خلايا عصبية ظهارية من مناطق معينة من الدماغ المتوسط الفرخ. يمكن النبضات الكهربائية ذات الجهد المنخفض مستطيلة إدخال الحمض النووي في خلايا الأنبوب العصبي الفرخ في البيضة 6،16. ومع ذلك، غالبا ما يتم عر?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
نحن نعترف K. Mikic، الذين ساهموا في المرحلة الأولى من هذا الفيلم وM. نيكولسكو للصورة مير. وأيد جيم هوبر من قبل الزمالة من IZKF من Universtitätsklinikum توبنغن، A. ألوين بريم اناند من قبل البرنامج ثروة من Universtitätsklinikum توبنغن.
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
References
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

