腹チック中脳マイクロRNAの発現OVO中
Summary
異所性発現は、脳の発達におけるマイクロRNAの役割を解明する一つの技術である。しかし、OVOエレクトロポレーションに使用して特定の領域を標的とすることは困難である。ここでは、選択的に腹側と背側中脳領域を電気穿孔するための効率的な方法を示しています。
Abstract
非コードRNAは、遺伝子発現を調節する追加のプレーヤーである。特定分野のOVOエレクトロポレーションで対象となるには、異所性マイクロRNA発現の空間的および時間的制御のためのユニークなツールを提供しています。しかし、腹側中脳のような腹脳構造は、任意の操作のために到達することはかなり困難である。ここでは、薄い白金電極を用いて、腹側中脳へのmiRNAを電気穿孔するための効率的な方法を示しています。この方法では、中脳とのin vivo研究のための有用なツールの特定の領域をトランスフェクトするために信頼性の高い方法を提供しています。
Introduction
遺伝子発現のための追加的な選手のような小さな非コードRNAの認識は、ゲノムのプログラミング/遺伝子調節に新しい複雑さを立ち上げました。非コードRNAの異なる種は、小さな非コードRNA 1-4を含む神経細胞における機能的重要性を有する。例えばマイクロRNA(MIRまたはmiRNA)は、脳5の開発にはっきりと変化する発現プロファイルを示している。ニワトリ胚のOVOエレクトロポレーションで対象とすることは、開発中の遺伝子発現と抑制の時間的·空間的制御のためのユニークな機会を提供します。
このビデオでは、エレクトロポレーション6月10日 OVOで使用したニワトリ脳の特定の領域にmiRの異所性発現を実施する様々なステップを示しています。細胞におけるこれらの小さな非コードRNAの長期持続効果を確実にするために、miRのDNA配列は、モノ – 又はバイシストロニックベクターにクローニングした。 OVOエレクトロポレーション中の場合は、のmiRは、Vを含む注入器は、卵の殻に小さな窓を作った後に胚を曝露することにより、中脳、神経管に注入される。中脳の小さなプラス(アノード)とマイナス(カソード)の特定の領域をトランスフェクトするために白金電極は、特定の位置に配置されている。腹側中脳トランスフェクションのために、アノードは、左腹側中脳と電流を適用する前に、中脳の右半分上記カソードの下に配置されている。卵殻の開口部をテープで閉じられ、胚であれば、どのような分析に必要とされるようにインキュベートする。この方法は、もともと村松ら 6で説明した特定領域のトランスフェクションのため百瀬ら 8向上した。
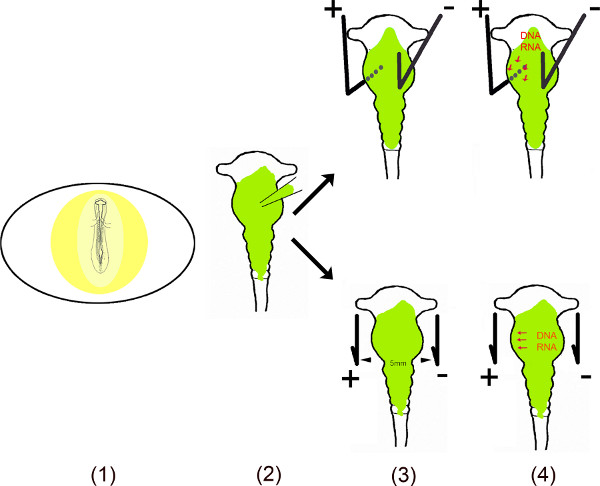
回路図の概要。
- 卵内の胚は、目に小さなウィンドウを切断することによって公開されているE卵殻。
- 溶解したベクター(単数または複数)は、マイクロキャピラリーを用いて中脳に注入される。
- 2つの電極は – 並列配置された、または胚の下で、上 – パルス電界を発生させる。
- 電界は、時間的に陽極11,12に引き付け負に荷電したDNA(またはRNA)による細胞への侵入を促進する細胞膜に孔を作成する。
Protocol
Representative Results
Discussion
このビデオでは、ニワトリ脳の特定の領域の神経上皮細胞にプラスミドをトランスフェクトする効果的な方法を示しています。低電圧の長方形の電気パルスは、OVO 6,16 内のひよこ神経管の細胞にDNAを導入することができます。しかし、DNAのターゲティングの精度は、多くの場合、比較的大きな電極(Φ= 0.5mm)を通って上昇幅の電界によって妨げられる。私たちは、百瀬<e…
Disclosures
The authors have nothing to disclose.
Acknowledgements
我々は、miR画像のためのこの映画とM. Nicolescuの初期段階に貢献したK. Mikicを認めている。 C.フーバーはUniverstitätsklinikumテュービンゲンのFORTUNEプログラムによるUniverstitätsklinikumテュービンゲンIZKF、A.アルウィンプレムアナンドの交わりによってサポートされていました。
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
References
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

