In ovo Expression von microRNA in ventralen Mittelhirn-Küken
Summary
Ektopische Expression ist eine Technik, um die microRNAs Rolle in der Entwicklung des Gehirns aufzuklären. , Für bestimmte Bereiche mit in ovo Elektroporation ist jedoch eine Herausforderung. Hier zeigen wir einen effizienten Weg, um selektiv elektroporieren ventrale und dorsale Mittelhirn Regionen.
Abstract
Nicht-kodierende RNAs sind weitere Spieler in der Regulation der Genexpression. In ovo Elektroporation von bestimmten Bereichen Gezielte bietet ein einzigartiges Werkzeug für die räumliche und zeitliche Kontrolle der Eileiter microRNA Expression. Allerdings sind ventralen Hirnstrukturen wie ventralen Mittelhirn ziemlich schwierig, für alle Manipulationen zu erreichen. Hier zeigen wir, eine effiziente Möglichkeit zum ventralen Mittelhirn miRNA in elektroporieren mit dünnen Platinelektroden. Dieses Verfahren bietet einen zuverlässigen Weg, um bestimmte Bereiche des Mittelhirns und nützliches Werkzeug für In-vivo-Studien zu transfizieren.
Introduction
Die Anerkennung der kleine nicht-kodierende RNAs als zusätzliche Spieler für die Genexpression eine neue Komplexität, um genomische Programmierung / Genregulation. Verschiedene Arten von nicht-kodierenden RNAs funktionelle Bedeutung in neuronalen Zellen, einschließlich der kleinen nicht-kodierenden RNAs 1-4. MicroRNAs (miR-oder miRNA) zeigen beispielsweise verschiedene und wechselnde Expressionsprofile in die Entwicklung des Gehirns 5. In ovo Elektroporation von Hühnerembryonen Gezielte bietet eine einzigartige Gelegenheit für zeitliche und räumliche Steuerung der Genexpression und der Silencing während der Entwicklung.
Dieses Video zeigt die verschiedenen Schritte der Durchführung ektopische Expression von miRs in bestimmten Bereichen des Mittelhirns mit Küken in ovo Elektroporation 10.06. Um eine dauerhafte Wirkung dieser kleinen nicht-kodierenden RNAs in den Zellen zu gewährleisten, wurden die DNA-Sequenz miRs in mono-oder bi-cistronischen Vektoren kloniert. Für die in-ovo Elektroporation, miR enthält vector in das Mittelhirn Neuralrohr, indem die Embryos nach einem kleinen Fenster in der Eierschale injiziert. Bestimmte Bereiche des Mittelhirns kleine Plus (Anode) und minus (Kathode) zu transfizieren Platinelektroden werden an bestimmten Positionen angeordnet. Zur ventralen Mittelhirn Transfektion wird die Anode unter dem ventralen Mittelhirn linken und der Kathode über der rechten Hälfte des Mittelhirns vor dem Anlegen eines Stroms angeordnet. Die Öffnung in der Eierschale ist mit Klebeband geschlossen und Embryonen werden, solange für jede Analyse erforderlich inkubiert. Dieses Verfahren wurde ursprünglich von Muramatsu et al. 6 beschrieben und Momose et al. 8 zum spezifischen Bereich der Transfektion verbessert.
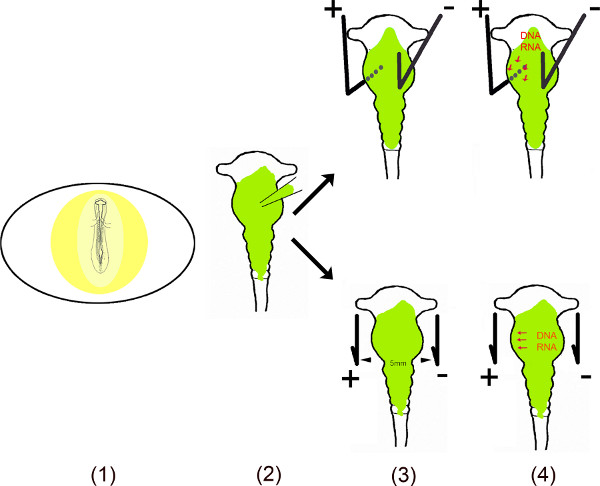
Schematische Übersicht.
- Der Embryo im Ei wird durch Schneiden ein kleines Fenster in th ausgesetzte Eierschale.
- Das gelöste Vektor (en) in das Mittelhirn unter Verwendung einer Mikrokapillare injiziert.
- Zwei Elektroden – parallel oder unter und über dem Embryo gelegt – erzeugen einen gepulsten elektrischen Feld.
- Das elektrische Feld zeitlich erzeugt Poren in der Zellmembran, die den Eintritt in die Zelle durch die negativ geladene DNA (oder RNA) zu erleichtern zogen Anode 11,12.
Protocol
Representative Results
Discussion
Dieses Video zeigt eine effektive Methode, um das Plasmid in die Neuroepithelzellen von bestimmten Bereichen des Mittelhirns Küken transfizieren. Rechteckige elektrische Impulse von Niederspannungs können DNA in Zellen der Küken Neuralrohr in ovo 6,16 einzuführen. Jedoch ist die Genauigkeit der DNA-Targeting oft durch die breiten elektrischen Feldes, das durch den relativ großen Elektroden (Φ = 0,5 mm) steigt behindert. Wir haben versucht, dieses Problem durch Verwendung von Elektroden im Durch…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wir erkennen K. Mikic, der auf die Anfangsphase des Films und M. Nicolescu für die miR-Bild beigetragen. C. Huber wurde von einer Gemeinschaft des IZKF der Universtitätsklinikum Tübingen, A. Alwin Prem Anand von der Fortune-Programm der Universtitätsklinikum Tübingen unterstützt.
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
References
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

