En Expression in ovo de microARN en ventral del polluelo Midbrain
Summary
La expresión ectópica es una técnica para dilucidar el papel microRNAs en el desarrollo del cerebro. Sin embargo, la focalización en áreas específicas mediante electroporación in ovo es un reto. Aquí, se muestra una forma eficiente a las regiones del cerebro medio ventral y dorsal selectiva electroporar.
Abstract
RNAs no codificantes son jugadores adicionales en la regulación de la expresión génica. Dirigida en la electroporación in ovo de áreas específicas proporciona una herramienta única para el control espacial y temporal de la expresión de microARN ectópico. Sin embargo, las estructuras del cerebro como ventrales del cerebro medio ventral son más bien difíciles de alcanzar para cualquier manipulaciones. Este sentido, demuestran una forma eficiente de electroporar miRNA en el mesencéfalo ventral usando electrodos de platino delgada. Este método ofrece una forma fiable para transfectar las áreas específicas del cerebro medio y una herramienta útil para los estudios in vivo.
Introduction
El reconocimiento de los ARN no codificantes pequeños como reproductores adicionales para la expresión de genes lanzó una nueva complejidad a la regulación genómica de programación / gen. Las diferentes especies de RNAs no codificantes tienen importancia funcional en las células neuronales, incluidos los pequeños no codificante RNAs 1-4. Los microARN (miR o miARN), por ejemplo, muestran distintos perfiles de expresión y los cambios en los cerebros en desarrollo 5. Dirigida en la electroporación in ovo de embriones de pollo ofrece una oportunidad única para el control temporal y espacial de la expresión génica y el silenciamiento durante el desarrollo.
Este video muestra las diferentes etapas de realizar la expresión ectópica de MIR en áreas específicas del cerebro medio pollito utilizando electroporación in ovo 6-10. Para garantizar un efecto de larga duración de estos pequeños RNAs no codificantes en las células, la secuencia de ADN del MIR fueron clonados en vectores de mono o bi-cistrónicos. Porque en la electroporación in ovo, MIR contiene vEctor se inyecta en el tubo neural del cerebro medio exponiendo el embrión después de hacer una pequeña ventana en la cáscara del huevo. Para transfectar áreas específicas del cerebro medio, más pequeño (ánodo) y negativo (cátodo) electrodos de platino se colocan en posiciones específicas. Para la transfección cerebro medio ventral, el ánodo se coloca debajo de la mesencéfalo ventral izquierda y el cátodo encima de la mitad derecha del cerebro medio antes de la aplicación de una corriente. La abertura en la cáscara del huevo se cierra con cinta y los embriones se incuban durante todo el tiempo necesario para cualquier análisis. Este método fue descrito originalmente por Muramatsu et al. 6 y mejorado por Momose et al. 8 para la transfección área específica.
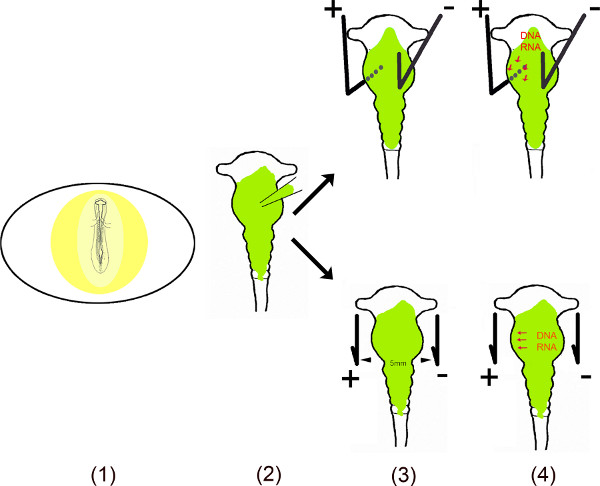
Resumen Esquemático.
- El embrión en el huevo es expuesto por el corte de una pequeña ventana en the cáscara de huevo.
- El vector (s) disuelta se inyecta en el cerebro medio usando un capilar micro.
- Dos electrodos – colocados en paralelo o por debajo y por encima del embrión – generan un campo eléctrico pulsante.
- El campo eléctrico crea temporalmente poros en la membrana celular, que facilitan la entrada en la célula por el ADN cargado negativamente (o ARN) atraído hacia el ánodo 11,12.
Protocol
Representative Results
Discussion
Este video muestra un método eficaz para transfectar plásmido en las células neuroepiteliales de áreas específicas del cerebro medio pollito. Pulsos eléctricos rectangulares de baja tensión pueden introducir ADN en las células del tubo neural de pollo in ovo 6,16. Sin embargo, la exactitud de la focalización de ADN a menudo se ve obstaculizada por el campo eléctrico de ancho, que se eleva a través de los electrodos relativamente grandes (Φ = 0,5 mm). Hemos tratado de hacer frente a ese pr…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Reconocemos K. Mikic, que contribuyó a la fase inicial de esta película y M. Nicolescu para la imagen MIR. C. Huber fue apoyado por una beca de la IZKF del Universtitätsklinikum Tübingen, A. Alwin Prem Anand por el programa de la fortuna del Universtitätsklinikum Tübingen.
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
References
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

