التمهيدي لالمناعية على نسيج Cryosectioned دماغ الفئران: مثال تلطيخ لالدبقية الصغيرة والخلايا العصبية
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
المناعية هو أسلوب يستخدم على نطاق واسع للكشف عن وجود، والموقع، والوفرة النسبية للمستضدات في الموقع. يصف هذا البروتوكول المستوى التمهيدي الكواشف والمعدات والتقنيات اللازمة لاستكمال تلطيخ المناعى أنسجة الدماغ القوارض، وذلك باستخدام علامات لالخلايا الدبقية الصغيرة والعناصر العصبية كمثال على ذلك. على وجه التحديد، فإن هذه الورقة هي بروتوكول خطوة بخطوة لرؤية فلوري من الخلايا الدبقية الصغيرة والخلايا العصبية عن طريق المناعية للIba1 وعموم العصبية، على التوالي. مضان مزدوج وضع العلامات مفيد بشكل خاص للتوطين بروتينات متعددة داخل نفس العينة، وتوفير الفرصة لمراقبة بدقة التفاعلات بين أنواع الخلايا، والمستقبلات، بروابط، و / أو المصفوفة خارج الخلية في علاقتها ببعضها البعض وكذلك البروتين المشارك توطين داخل خلية واحدة. على عكس تقنيات التصوير الأخرى، مضان المناعية كثافة تلطيخ قد ينخفض فيمن أسابيع إلى أشهر التالية تلطيخ، ما لم تتخذ الاحتياطات المناسبة. على الرغم من هذا القيد، في العديد من التطبيقات ويفضل مضان مزدوج وضع العلامات على بدائل مثل tetrahydrochloride 3،3'-diaminobenzidine (DAB) أو الفوسفاتيز القلوية (AP)، ومضان هو المزيد من الوقت الفعال ويسمح للتمايز أكثر دقة بين دولتين أو أكثر علامات. وتشمل المناقشة نصائح استكشاف الأخطاء وإصلاحها والمشورة لتعزيز النجاح.
Introduction
المناعية هي عملية للكشف عن المستضدات (أي البروتينات) في أقسام الأنسجة باستخدام الأجسام المضادة الأولية التي تربط خصيصا لمولدات المضادات من الفائدة. كان رائدا المناعية التي كتبها JR ماراك في عام 1934 عندما قرر أن الأجسام المضادة يمكن أن توطين مستضدات مع خصوصية كبيرة 1. ابتداء من عام 1942، ونشرت بعض من أولى الدراسات في المختبر باستخدام الأجسام المضادة فلوري لتصور المناعية 2،3، وبعد ذلك لأول مرة في الجسم الحي الدراسة النسيجية تم نشره 4. خلال عام 1960، بعد ثلاثة عقود من إنشائها أساليب المناعى، بدأت الأجسام المضادة انزيم مترافق لاستخدامها الكواشف الثانوية. تم في وقت واحد وبشكل مستقل وضعت هذه الأساليب في فرنسا والولايات المتحدة 5،6. اليوم، مجموعة واسعة من الأجسام المضادة تقدم احتمالات لا نهاية لها للدراسات المناعية 7.
"> ويتمثل الهدف العام من هذه المراسلات هو توفير مقدمة موجزة إلى تلطيخ المناعى، وليس المقصود أن يكون استعراضا شاملا وكاملا لهذه التقنية في الأسلوب المبين، وتعرض تقنيات المناعى لمدة المستضدات (علامات على الخلايا الدبقية الصغيرة و. الخلايا العصبية) لتلطيخ من امتصاص العرق perfused ل، السكروز cryoprotected، cryosectioned الدماغ الفئران. تلطيخ المناعى يبدأ حجب المستضد غير محددة ملزمة للحد من تلوين الخلفية. بعد ذلك، الحضانة مع الأجسام المضادة الأولية تسمح للربط لمستضد معين في الأنسجة. وبعد الأجسام المضادة الأولية، الأجسام المضادة آخر، وصف الأجسام المضادة الثانوية، يتم تطبيقها على ربط الأجسام المضادة الأولية إلى إشارة التصور مترافق 8. والضد الثانوية يستهدف المناعي G (مفتش) مجال معين إلى الأنواع التي أثيرت الأجسام المضادة الأولية. يضخم الجسم المضاد الثانوي إشارة من الأجسام المضادة الأولية منذ المناطق فاب رانه الثانوي ربط الأجسام المضادة لمواقع متعددة في المجال مفتش من الأجسام المضادة الأولية. إما الإنزيمات أو جزيئات فلوري مترافق إلى ج مناطق F من الأجسام المضادة الثانوية تمكن التصور. على سبيل المثال، أرنب الأجسام المضادة الأولية مكافحة Iba1 هو أرنب جزيء مفتش محددة لIba1. عندما يتم تطبيق حمار المضادة للأرنب مفتش بمثابة الضد الثانوية، انها لن تعترف وربط مناطق متعددة من الأرانب مكافحة Iba1 مفتش (انظر الشكل 1). الأجسام المضادة حمار يمكن تصور بطرق مختلفة. وتركز هذه المراسلات على الكشف عن fluorophore مترافق الأجسام المضادة الثانوية، الذي يعترف الأجسام المضادة الأولية، لتصور بواسطة المجهر الفلورسنت. في المناعية الفلورسنت، وصمة عار النووية مثل هويشت أو دابي يمكن استخدامها لتصور كل نواة.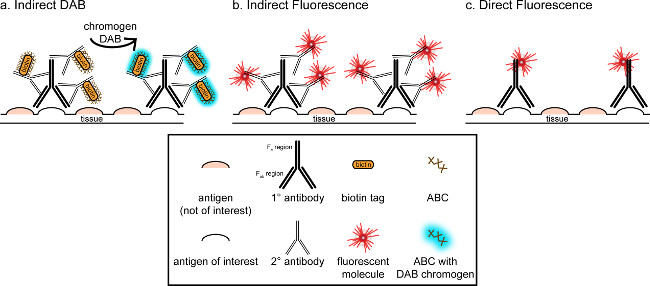
الشكل 1: شوبتمثيل ematic من مقابل المباشر تقنيات وضع العلامات الأجسام المضادة غير المباشر. الأجسام المضادة ربط المستضد من الفائدة ويمكن تضخيمها من قبل الأجسام المضادة الثانوية التي أثيرت ضد أنواع من الأجسام المضادة الأولية. هذه التقنية يمكن القيام بها باستخدام مجمع أفيدين البيوتين (ABC) لتضخيم وDAB التصور (A) أو الأجسام المضادة الثانوية فلوري مترافق مباشرة (B). بدلا من ذلك، الأجسام المضادة الأولية يمكن مترافق مباشرة مع العديد من العلامات المختلفة، بما في ذلك البيوتين أو fluorophore (C). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
طريقة بديلة لرؤية تلطيخ المناعى يستخدم 3،3'-diaminobenzidine tetrahydrochloride (DAB؛ انظر الشكلين 1 و 2). هذا يختلف عن مضان باستخدام البيروكسيديز أوالغلوثانيون الحصان الفجل (HRP) الأجسام المضادة الثانوية مترافق، التي تنص على انزيم تحويل DAB إلى راسب التي مرئيا تحت مشرق المجهري الميدان. في الحالات التي تكون فيها مستضد واحد هو من مصلحة أو مطلوب تلطيخ أن تكون طويلة الأمد، قد يكون DAB أكثر ملاءمة من تلطيخ الفلورسنت. ومع ذلك، لا مناسبة تماما DAB تلطيخ للتمايز بين علامات متعددة، لا سيما إذا كان اثنان من المستضدات النووية المثيرة للاهتمام. للحصول على معلومات عن المواد DAB وتعديلات بروتوكول، راجع الجدول 1. بالتناوب، نيترو الأزرق كلوريد نتروبلو / 5-برومو-4-كلورو-3-indolyl الفوسفات (NBT / BCIP) يمكن استخدامها لتصور والفوسفاتيز القلوية (ا ف ب) مترافق الثانوية الأجسام المضادة.
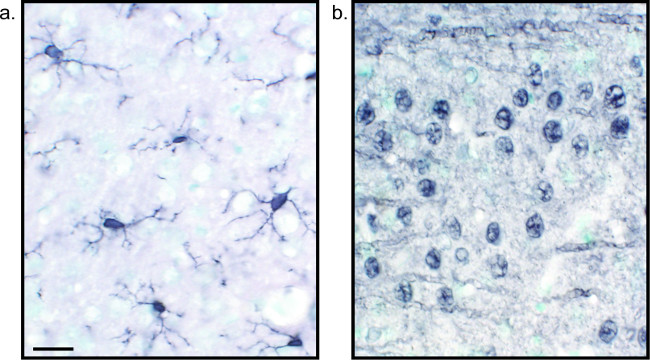
الشكل 2: صور الممثل DAB الفئران أقسام محسنة النيكل أنسجة المخ واحدة وصفت حد ذاتها دماغ الفئرانctions التي وصفت مع محسنة النيكل DAB لIba1 (A) وعموم العصبية (B) يسمح للتحليل طويل الأمد من الخلايا الدبقية الصغيرة أو الخلايا العصبية وحدها. مقياس شريط 20 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
يجب على المرء أن ينظر في وفرة المقدرة للمستضد المصالح داخل الأنسجة التي يجري تحليلها. وسائل غير مباشرة (كما هو موضح أعلاه) هي مفيدة للأهداف مع وفرة منخفضة. عندما مستضد من الفائدة في وفرة عالية، ويمكن تطبيقها الأساليب المباشرة. طرق المباشرة تنطوي على الأجسام المضادة الأولية التي مترافق مباشرة إلى إشارة التصور، وبالتالي لا يلزم الضد الثانوية. هذه الطريقة يبسط عملية التلوين، ولكن يلغي التضخيم من قبل وسائل غير مباشرة تحقيقها. باستخدام الأجسام المضادة الأولية مترافق مباشرة كما يلغي عبر التفاعل من الأجسام المضادة الثانويةعند النقر المزدوج وضع العلامات.
هذا التواصل تفاصيل بروتوكول لمضاعفة وضع العلامات مع Iba1 وعموم العصبية (التفاصيل في الجدول 1). Iba1 بقع الخلايا الدبقية الصغيرة في العديد من الدول التنشيط، بما في ذلك متشعب، فرط متشعب، تنشيط، أميبية، وقضيب. البقع عموم العصبية محاور الخلايا العصبية، التشعبات، وسوما. منذ Iba1 البقع معظم الخلايا الدبقية الصغيرة والأهداف عموم العصبية في الخلايا العصبية، وهذا مزيج من البقع مفيد في الحصول على فهم واسع من التفاعلات الخلايا الدبقية الصغيرة الخلايا العصبية.
باختصار، يعتمد تلطيخ المناعى على الاختيار الدقيق للأجسام. كما يصبح السؤال البحثي أكثر تحديدا، قد يكون المطلوب الأجسام المضادة التي أثيرت لمستضدات بديلة. استهداف دولة تفعيل دبقية محددة، يمكن للمرء أن يختار استخدام CD45 CD68 أو الأجسام المضادة، بدلا من Iba1. وعلاوة على ذلك، في العمل مع الفئران، F4 / 80 قد توفر النتائج اللازمة. وبالمثل، عناصر الخلايا العصبية يمكن أن تستهدف على وجه التحديد مع الأجسام المضادة راISED ضد النواة، المشبك (قبل أو ما بعد)، المحور، ومخروط النمو. بالإضافة إلى ذلك، هناك علامات أخرى والتي تفرق عمر الخلايا العصبية (انقر نقرا مزدوجا كورتين، NeuN)، وتجديد الخلايا العصبية (GAP-43).
Protocol
Representative Results
Discussion
وكان الهدف العام من هذه الاتصالات لإدخال إجراءات المناعية للقارئ. لهذا، مثال مزدوج وضع العلامات مع Iba1 ومولدات المضادات عموم العصبية لمراقبة الخلايا الدبقية الصغيرة والخلايا العصبية في امتصاص العرق perfused ل، تم استخدام السكروز الدماغ cryoprotected، الفئران cryosectioned.
<p class="…Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
References
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l’Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira’s basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).

