Primer para inmunohistoquímica en el tejido cryosectioned cerebro de rata: Ejemplo de tinción de microglía y neuronas
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
La inmunohistoquímica es una técnica ampliamente utilizada para detectar la presencia, localización, y la abundancia relativa de antígenos in situ. Este protocolo de nivel introductorio describe los reactivos, equipos y técnicas requeridas para completar la tinción inmunohistoquímica de tejido de cerebro de roedores, el uso de marcadores para microglia y elementos neuronales como un ejemplo. En concreto, este trabajo es un protocolo de paso a paso para la visualización fluorescente de la microglia y neuronas a través de inmunohistoquímica para Iba1 y Pan-neuronal, respectivamente. Fluorescencia doble etiquetado es particularmente útil para la localización de múltiples proteínas dentro de la misma muestra, proporcionando la oportunidad de observar con precisión las interacciones entre tipos de células, receptores, ligandos, y / o la matriz extracelular en relación el uno al otro, así como co-proteína localización dentro de una sola célula. A diferencia de otras técnicas de visualización, intensidad de la tinción inmunohistoquímica de fluorescencia puede disminuir enlas semanas a meses después de la tinción, si no se toman las precauciones adecuadas. A pesar de esta limitación, en muchas aplicaciones se prefiere la fluorescencia doble etiquetado sobre alternativas tales como tetrahidrocloruro de 3,3'-diaminobencidina (DAB) o fosfatasa alcalina (AP), como fluorescencia es más eficiente en el tiempo y permite la diferenciación más precisa entre dos o más marcadores. La discusión incluye sugerencias para solucionar problemas y consejos para promover el éxito.
Introduction
La inmunohistoquímica es un proceso para la detección de antígenos (es decir, proteínas) en secciones de tejido mediante el uso de anticuerpos primarios que se unen específicamente a los antígenos de interés. La inmunohistoquímica fue iniciado por JR Marrack en 1934 cuando se determinó que los anticuerpos podrían localizar antígenos con gran especificidad 1. A partir de 1942, algunos de los primeros estudios in vitro usando anticuerpos fluorescentes para visualizar inmunohistoquímica se publicaron 2,3, después de lo cual el primer estudio in vivo en histoquímica fue publicado 4. Durante la década de 1960, tres décadas después de la creación de métodos de inmunohistoquímica, anticuerpos conjugados a enzima comenzaron a ser utilizados como reactivos secundarios. Estos métodos se han desarrollado de forma simultánea e independientemente en Francia y los EE.UU. 5,6. Hoy en día, una amplia gama de anticuerpos ofrece un sinfín de posibilidades para los estudios de inmunohistoquímica 7.
"> El objetivo general de esta correspondencia es proporcionar una breve introducción en la tinción inmunohistoquímica, no pretende ser una revisión completa y exhaustiva de esta técnica en el método descrito, técnicas inmunohistoquímicas para dos antígenos son presentados (marcadores de la microglía y. neuronas) para la tinción de paraformaldehído perfundido, sacarosa cryoprotected, cerebro de rata cryosectioned. La tinción inmunohistoquímica comienza con el bloqueo de la unión no específica de antígeno para reducir la tinción de fondo. A continuación, la incubación con el anticuerpo primario permite por la unión a un antígeno específico en el tejido. Siguiendo el anticuerpo primario, otro anticuerpo, denominado anticuerpo secundario, se aplica a enlazar el anticuerpo primario a una señal de visualización conjugado 8. El anticuerpo secundario se dirige a la inmunoglobulina G (IgG) de dominio específico a las especies en las que se planteó el anticuerpo primario. El anticuerpo secundario amplifica la señal del anticuerpo primario desde las regiones Fab de tque se unen anticuerpo secundario a múltiples sitios en el dominio IgG del anticuerpo primario. Cualquiera de enzimas o moléculas fluorescentes conjugados con las regiones C de F del anticuerpo secundario permitir la visualización. Por ejemplo, un conejo anti-Iba1 anticuerpo primario es una molécula de IgG de conejo específico para Iba1. Cuando se aplica burro anti-IgG de conejo como anticuerpo secundario, se reconocer y unirse a múltiples regiones del anti-IgG de conejo Iba1 (ver Figura 1). El anticuerpo de burro puede ser visualizado por diversos métodos. Esta correspondencia se centra en la detección de un fluoróforo conjugado con el anticuerpo secundario, que reconoce el anticuerpo primario, para la visualización por microscopía fluorescente. En inmunohistoquímica fluorescente, un tinte nuclear, tales como Hoechst o DAPI se puede utilizar para visualizar todos los núcleos.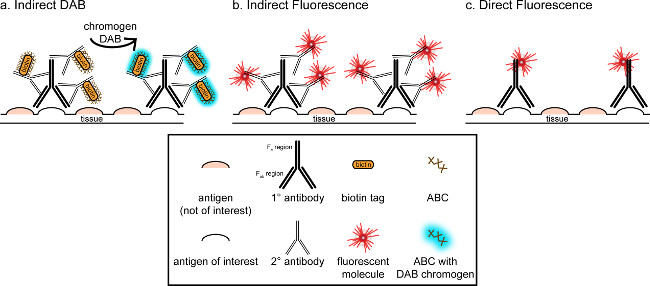
Figura 1: Schrepresentación Ematic de vs. directa técnicas de marcaje de anticuerpos indirecto. Los anticuerpos se unen al antígeno de interés y puede ser amplificada por anticuerpos secundarios dirigidos contra las especies de los anticuerpos primarios. Esta técnica se puede realizar utilizando complejo avidina-biotina (ABC) para la amplificación y DAB para la visualización (A), o un anticuerpo secundario fluorescente directamente conjugado (B). Alternativamente, los anticuerpos primarios se pueden conjugar directamente con muchas etiquetas diferentes, incluyendo biotina o un fluoróforo (C). Por favor, haga clic aquí para ver una versión más grande de esta figura.
Un método alternativo para la visualización de la tinción inmunohistoquímica utiliza 3,3'-diaminobenzidina tetrahidrocloruro (DAB; véanse las Figuras 1 y 2). Esto difiere de fluorescencia mediante el uso de un biotinilado operoxidasa de rábano picante (HRP) anticuerpo secundario conjugado, que proporciona una enzima para convertir DAB a un precipitado que es visible bajo microscopía de campo brillante. En los casos en que un solo antígeno es de interés o se requiere tinción a ser de larga duración, DAB puede ser más apropiado que la tinción fluorescente. Sin embargo, la tinción DAB no está bien adaptado para la diferenciación entre múltiples marcadores, especialmente si dos antígenos nucleares son de interés. Para obtener información sobre materiales DAB y modificaciones del protocolo, consulte la Tabla 1. Alternativamente, cloruro de nitro azul tetrazolio / 5-Bromo-4-cloro-3-indolil fosfato (NBT / BCIP) se puede utilizar para visualizar una fosfatasa alcalina (AP) secundario conjugado anticuerpo.
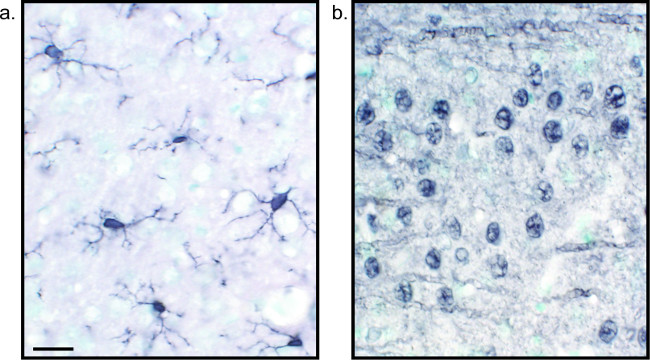
Figura 2:. Imágenes representativas de secciones de tejido cerebral de níquel-DAB mejorada de marcaje único rata rata cerebro del SEcciones que se etiquetan con DAB-níquel mejorada para Iba1 (A) y Pan-neuronal (B) permitir el análisis de larga duración de la microglia o neuronas solas. Barra de escala 20 micras. Haga clic aquí para ver una versión más grande de esta figura.
Hay que tener en cuenta la abundancia estimada del antígeno de interés dentro del tejido que se está analizando. Los métodos indirectos (como se describe más arriba) son útiles para los objetivos con baja abundancia. Cuando el antígeno de interés se encuentra en gran abundancia, los métodos directos se pueden aplicar. Los métodos directos implican un anticuerpo primario que se conjuga directamente a una señal de visualización, y por lo tanto no se requiere ningún anticuerpo secundario. Este método simplifica el proceso de tinción, pero elimina la amplificación logrado por métodos indirectos. El uso de un anticuerpo primario conjugado directamente también elimina la reactividad cruzada de anticuerpos secundariosal hacer doble etiquetado.
Esta comunicación se detalla el protocolo de doble etiquetado con Iba1 y Pan-neuronales (detalles en la Tabla 1). Iba1 manchas microglia en muchos estados de activación, incluyendo ramificada, hiper-ramificados, que se activa, ameboide, y la varilla. Manchas Pan-neuronales neuronal axones, dendritas, y soma. Desde Iba1 tiñe la mayoría de la microglía y metas Pan-neuronales la neurona, esta combinación de manchas es útil en la obtención de una amplia comprensión de las interacciones microglia neuronas.
En suma, la tinción inmunohistoquímica se basa en la cuidadosa selección de anticuerpos. Como la pregunta de investigación se hace más específica, los anticuerpos producidos contra antígenos alternativos pueden ser deseables. Para conseguir un estado de activación microglial específica, se puede optar por utilizar anticuerpos CD45 o CD68, en lugar de Iba1. Además, en el trabajo con ratones, F4 / 80 puede proporcionar los resultados necesarios. Del mismo modo, los elementos neuronales pueden ser dirigidos específicamente con anticuerpos razada contra el núcleo, sinapsis (pre o post), axón, y el cono de crecimiento. Además, hay otros marcadores que diferencian la edad de la neurona (doble Cortin, NeuN), y la regeneración neuronal (GAP-43).
Protocol
Representative Results
Discussion
El objetivo general de esta comunicación fue la introducción de procedimientos de inmunohistoquímica para el lector. Para ello, el ejemplo de doble etiquetado con Iba1 y antígenos Pan-neuronales para observar microglia y neuronas en paraformaldehído perfundido, se utilizó sacarosa cerebro cryoprotected, rata cryosectioned.
Esta técnica se puede adaptar para servir a los propósitos sin fin. Una serie de diferentes antígenos en una variedad de tipos de tejidos tales como, pero sin lim…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
References
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l’Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira’s basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).

