Mikroglia ve nöronlar için örnek Boyama: Cryosectioned Rat Beyin Dokusu Üzerine İmmünohistokimya için Astar
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
İmmünohistokimya yerinde antijenlerin varlığı, konumu ve göreceli bolluk tespiti için yaygın olarak kullanılan bir tekniktir. Bu giriş seviyesi protokol mikroglia ve bir örnek olarak nöronal elemanlar için işaretlerini kullanarak, reaktifler, ekipman, ve kemirgen beyin dokusunun immünohistokimyasal boyama tamamlamak için gerekli teknikler anlatılmaktadır. Özellikle, bu kağıt sırasıyla Iba1 ve Pan-nöronal için immünohistokimya yoluyla mikroglia ve nöronların floresan görselleştirme için bir adım-adım protokoldür. Floresans çift etiketleme doğru hücre tipleri, reseptörler, ligand arasındaki etkileşimi gözlemlemek için bir fırsat sağlamaktadır, aynı numune içinde birden fazla protein lokalizasyonu için özellikle yararlı olduğu ve / veya bir başka yanı sıra protein ko- göre hücre dışı matris Tek bir hücrenin içinde yerelleştirme. Diğer görselleştirme teknikleri aksine, floresan immünohistokimyası boyama yoğunluğu azalabilirUygun önlemler alınmazsa, lekelenmeye önümüzdeki aylarda hafta. Floresan kez daha etkilidir ve iki ya da daha fazlası arasında daha kesin bir ayrım yapmaya imkan tanımaktadır Bu sınırlama rağmen, pek çok uygulamada floresans çift etiketleme, örneğin 3,3'-diaminobenzidin tetrahidroklorid (DAB) veya alkalin fosfataz (AP) gibi alternatifler tercih edilir belirteçler. Tartışma sorun giderme ipuçları ve başarıyı teşvik etmek için tavsiyeler içerir.
Introduction
İmmünohistokimya ilgi antijenlere spesifik olarak bağlanan primer antikorlar kullanılarak, doku kesitlerinde antijenleri (örneğin, proteinler) tespit edilmesi için bir işlemdir. O antikorlar Büyük özgüllük 1 antijenleri lokalize olabilir tespit zaman İmmünohistokimya 1934 yılında JR Marrack öncülük ettiler. 1942 yılında başlayarak, immunohistokimyasal görselleştirmek için floresan antikorlar kullanılarak çalışmalar in vitro ilk bazı in vivo histokimyasal çalışmada ilk 4 basıldı sonra 2,3, yayınlandı. 1960 'li yıllarda, üç yıl immünohistokimyasal yöntemleri süre sonra, bir enzim-konjüge edilmiş antikor, ikincil reaktifler olarak kullanılmaya başlanmıştır. Bu yöntemler aynı anda ve birbirinden bağımsız Fransa ve ABD'de 5,6 geliştirilmiştir. Bugün, antikorların geniş bir dizi immunohistokimya çalışmaları 7 için sonsuz olanaklar sağlar.
"> Bu yazışmaların genel amacı immünohistokimyasal içine kısa bir tanıtım sağlamak, bu tekniğin kapsamlı ve ayrıntılı bir yorum olması anlamına gelmez özetlenen yöntemde, iki antijen için immünohistokimyasal teknikler mikroglia için (işaretçileri sunulmuş ve. perfüze paraformaldehit boyama nöronlar), sukroz cryoprotected cryosectioned sıçan beyni. immünohistokimyasal boyama, arka plan boyama azaltmak için spesifik olmayan antijen bloke ile başlar. Daha sonra, birincil antikor ile inkübasyon dokusunda özel bir antijene bağlanma sağlar. birincil antikor izlenerek, başka bir antikor, ikincil antikor olarak adlandırılan, bir konjüge görselleştirme sinyali 8 birincil antikor bağlantı uygulanır. ikincil antikor birincil antikora yükseltilmiş olan türlere özgü immünoglobulin G (IgG) alanı hedef alır. sekonder antikor sinyali güçlendirir Primer antikor t Fab bölgelerinde beriPrimer antikor IgG etki alanında birden fazla site için elinden ikincil antikor bağlama. Her iki durumda da, ikincil antikorun Fc bölgelerine konjüge enzimler ya da floresan moleküller görselleştirme sağlar. Örneğin, bir tavşan anti-Iba1 birincil antikor Iba1 için spesifik bir tavşan IgG molekülüdür. Eşek anti-tavşan IgG ikincil antikor olarak tatbik edildiği zaman, bu tanıma ve tavşan anti-Iba1 IgG birden fazla bölgeye (bakınız Şekil 1) bağlanacaktır. eşek antikor çeşitli yöntemlerle görülebilir. Bu yazışmalar floresan mikroskobu ile görselleştirme, primer antikor tanıyan sekonder antikor, konjuge bir floroforun tespiti üzerinde duruluyor. Floresan immünohistokimya, bu tür ajanlar Hoechst veya DAPI gibi bir nükleer boya bütün çekirdeklerinde görselleştirmek için kullanılabilmektedir.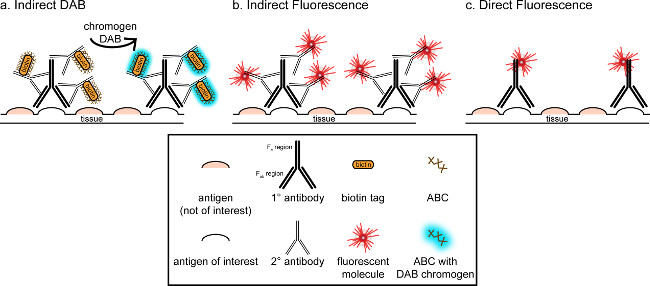
Şekil 1: SchDoğrudan ve dolaylı antikor etiketleme tekniklerinin ematic temsili. Antikorlar, ilgi alanındaki antijene bağlanan ve birincil antikor türleri karşı artan sekonder antikor ile amplifiye edilebilir. Bu teknik, görselleştirme (A) için amplifikasyon ve DAB için avidin-biyotin kompleksi (ABC) kullanılarak gerçekleştirilmiştir, ya da doğrudan konjüge edilmiş floresan ikincil antikor (B). Alternatif olarak, birincil antikorlar doğrudan biyotin veya bir fluorofor (C) dahil olmak üzere birçok farklı etiketler, konjuge edilebilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
(DAB; Şekiller 1 ve 2), immünohistokimyasal görselleştirilmesi için alternatif bir yöntem, 3,3'-diaminobenzidin tetrahidroklorür kullanır. Bu, bir biyotinile kullanılarak fluoresans farklıdır veyaparlak alan mikroskopisi altında algılanabilen bir çökelti DAB dönüştürmek için bir enzim içerir bayırturpu peroksidaz (HRP) konjüge edilmiş ikincil bir antikor. Tek bir antijen ilgi ya da boyama uzun ömürlü olması için gerekli olan durumlarda, DAB floresan boyama daha uygun olabilir. Bununla birlikte, DAB boyama iki nükleer antijen ilgi, özellikle, birden fazla belirteçleri arasında farklılaşması için çok uygundur değildir. DAB malzemeleri ve protokol değişiklikler hakkında bilgi için, Tablo 1 bakınız. Alternatif olarak, nitro mavi tetrazolyum klorür / 5-bromo-4-kloro-3-indolil fosfat (NBT / BCIP) orta konjüge bir alkalin fosfataz (AP) görselleştirmek için kullanılabilmektedir antikordur.
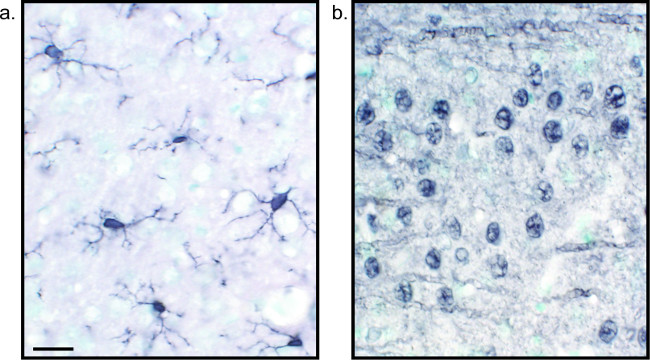
Şekil 2:. Nikel geliştirilmiş DAB tek etiketli sıçan beyin dokusu kesitlerinin Temsilcisi görüntüleri Sıçan beyin seTek başına mikroglia veya nöronların uzun süren analiz için Iba1 (A) ve Pan-nöronal (B) için nikel geliştirilmiş DAB ile etiketlenmiş olan seksiyonlar. Ölçek çubuğu 20 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Bir doku içinde ilgi antijenin tahmini bolluğu analiz ediliyor düşünmek gerekir. Dolaylı yöntemler (yukarıda anlatıldığı gibi) düşük yoğunlukta olan hedefler için yararlıdır. Ilgi, antijen yüksek bolluk olduğunda, direkt yöntemler uygulanabilir. Doğrudan yöntemler doğrudan görselleştirme sinyaline konjuge edilmiş bir birincil antikor içerir ve dolayısıyla ikincil antikor gereklidir. Bu yöntem boyama işlemini kolaylaştırır, ancak dolaylı yöntemlerle elde amplifikasyon ortadan kaldırır. Bir doğrudan konjüge edilmiş birincil antikor kullanarak da sekonder antikorların çapraz reaktivite ortadan kaldırırne zaman çift etiketleme.
Bu iletişim Iba1 ve Pan-nöronal (Tablo 1 ayrıntıları) ile çift etiketleme için protokol göstermektedir. Iba1 dallanmış, hiper-dallanmış, aktif, amoeboid ve çubuk dahil olmak üzere birçok aktivasyon devletler içinde mikroglia lekeler. Pan-nöronal lekeler nöronal akson, dendrit ve soma. Iba1 çoğu mikroglia ve Pan-nöronal olası hedefler nöron leke yana, lekeleri bu kombinasyon mikroglia-nöron etkileşimleri geniş bir anlayış kazanıyor yararlıdır.
Özetle, immünohistokimyasal antikorların dikkatli seçimi dayanmaktadır. Araştırma sorusu daha spesifik hale geldikçe, diğer antijenlere karşı üretilen antikorlar arzu edilebilir. Belirli bir mikrogliyal aktivasyon durumunu hedeflemek için, bir yerine Iba1 daha CD45 veya CD68 antikorları kullanmayı tercih edebilir. Dahası, fareler ile çalışma, F4 / 80 gerekli sonuçlar verebilir. Benzer şekilde, nöronal elemanlar özellikle antikorlar ra ile hedeflenebilirçekirdeğin karşı kili, sinaps (öncesi veya sonrası), akson ve büyüme konisinin. Ayrıca, nöron (Çift cortin, Neun) yaşını ayırt diğer belirteçler ve nöronal rejenerasyon (GAP-43) vardır.
Protocol
Representative Results
Discussion
Bu iletişimin genel amacı okuyucuya immünhistokimya prosedürleri tanıtmak oldu. Bunun için, Iba1 ve Pan-nöronal antijenler ile çift etiketleme örneği mikroglia ve perfüze paraformaldehid nöronlar gözlemlemek, sükroz cryoprotected cryosectioned sıçan beyin kullanıldı.
Bu teknik, sonsuz amaçlara hizmet etmek için adapte edilebilir. Beyin, akciğer, karaciğer, böbrek ve bağırsak sınırlayıcı gibi, ancak doku tiplerinin, çeşitli farklı antijenlerin dizisi protokolü…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
References
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l’Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira’s basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).

