Грунтовка для иммуногистохимии Cryosectioned ткани мозга крыс: Пример окрашивания для микроглии и нейронов
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
Иммуногистохимия это широко используемый метод для обнаружения присутствия, расположение и относительное обилие антигенов в месте. Этот протокол вводный уровень описывает реагенты, оборудование и методы, необходимые для завершения иммуногистохимическое окрашивание тканей мозга грызунов, с помощью маркеров для микроглии и нейронов элементов в качестве примера. В частности, эта статья шаг за шагом протокол для люминесцентных визуализации микроглии и нейронов через иммуногистохимии для Iba1 и Пан-нейронов, соответственно. Флуоресценции дважды маркировки особенно полезен для локализации нескольких белков в пределах того же образца, что обеспечивает возможность точно наблюдать взаимодействие между типами клеток, рецепторов, лиганды, и / или внеклеточного матрикса по отношению друг к другу, а также белка со- Локализация в пределах одной ячейки. В отличие от других методов визуализации, интенсивность окрашивания флуоресценции иммуногистохимии может уменьшаться внедели до нескольких месяцев после окрашивания, если соответствующие меры предосторожности не будут приняты. Несмотря на это ограничение, во многих приложениях флуоресценции дважды маркировки предпочтительнее альтернативы, такие как 3,3'-диаминобензидина тетрагидрохлорид (DAB) или щелочной фосфатазы (AP), а флуоресценции более быстро и эффективно позволяет более точно дифференциации между двумя или более маркеры. Обсуждение включает в себя советы по устранению неполадок и советы по продвижению успех.
Introduction
Иммуногистохимическое является способ обнаружения антигенов (т.е. белки) в срезах тканей с использованием первичных антител, которые специфически связываются с антигенами, представляющих интерес. Иммуногистохимия был впервые JR Маррак в 1934 году, когда он решил, что антитела могут локализовать антигены с большой специфичностью 1. Начиная с 1942 года, некоторые из первых в пробирке исследования с использованием флуоресцентных антител к себе иммуногистохимии были опубликованы 2,3, после чего первый в естественных условиях гистохимических исследование было опубликовано 4. В 1960-х годах, три десятилетия после создания иммуногистохимических методов, фермент-сопряженный антитела стали использовать в качестве вторичных реагентов. Эти методы были одновременно и независимо друг от друга разработали во Франции и США 5,6. Сегодня широкий спектр антител дает бесконечные возможности для иммуногистохимических исследований 7.
"> Общая цель этого соответствия, чтобы обеспечить краткое введение в иммуногистохимического окрашивания; он не предназначен, чтобы быть всесторонним и исчерпывающий обзор этой техники в методу, описанному, иммуногистохимических методов для двух антигенов представлены (маркеры для микроглии и. нейроны) для окрашивания параформальдегида перфузии, сахароза криопротекции, cryosectioned мозга крысы Иммуногистохимическое окрашивание. начинается с блокирования неспецифического связывания антигена, чтобы уменьшить фоновое окрашивание. Затем инкубацию с первичными антителами позволяет связываться со специфическим антигеном в ткани. После первичного антитела, другое антитело, называют вторичным антителом, применяется для связывания первичных антител к конъюгированной визуализации сигнала 8. вторичное антитело цели иммуноглобулина G (IgG) домен, определенные для вида, в котором первичное антитело было поднятыми. вторичное антитело усиливает сигнал первичного антитела, так как Fab регионов тОн вторичного антитела связываются с нескольких сайтов на домене IgG первичного антитела. Либо ферментах или флуоресцентных молекул, конъюгированных с F C регионах вторичного антитела включить визуализацию. Например, анти-кролик Iba1 первичное антитело кролика молекулы IgG специфичны для Iba1. При осел анти-кроличий IgG применяется в качестве вторичного антитела, он будет распознавать и связывать с несколькими регионах кролика против IgG Iba1 (рисунок 1). Осел антитела могут быть визуализированы с помощью различных методов. Это соответствие фокусируется на обнаружении флуорофора конъюгированных с вторичным антителом, которое распознает первичное антитело, для визуализации с помощью флуоресцентной микроскопии. В флуоресцентного иммуногистохимии, окрашивающий ядра, такие как Hoechst или DAPI может быть использован для визуализации всех ядер.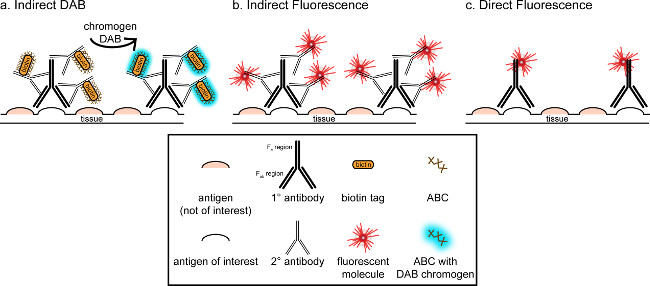
Рисунок 1: Schematic представление прямой против методов непрямой антител маркировки. Антитела связываются с антигеном интерес и может быть усилен вторичных антител, против видов первичных антител. Этот метод может быть выполнена с использованием авидин-биотин комплекса (ABC) для усиления и DAB для визуализации (А), или непосредственно конъюгированное вторичное антитело флуоресцентные (В). Кроме того, первичные антитела могут быть непосредственно сопряжен с различными тегов, в том числе биотин или флуорофора (C). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Альтернативный способ визуализации иммуногистохимического окрашивания использует 3,3'-диаминобензидина (DAB тетрагидрохлорид; см фиг.1 и 2). Это отличается от флуоресценции с помощью биотинилированного илипероксидазой хрена (HRP), конъюгированный вторичное антитело, которое обеспечивает фермент для преобразования DAB в виде осадка, который виден при ярком микроскопии. В случаях, когда один антиген представляет интерес или окрашивание, необходимых, чтобы быть длительным, DAB может быть более подходящим, чем флуоресцентного окрашивания. Тем не менее, окрашивание DAB не очень хорошо подходит для дифференциации между множеством маркеров, особенно если две атомные антигены представляют интерес. Для получения информации о материалах DAB и модификаций протокола, обратитесь таблицу 1. С другой стороны, нитро синий хлорида тетразолия / 5-бром-4-хлор-3-индолил фосфат (NBT / BCIP) может быть использован для визуализации щелочной фосфатазы (AP) конъюгированный вторичный антитела.
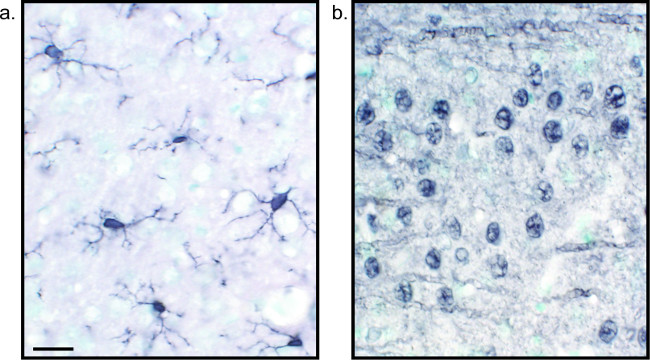
Рисунок 2:. Типичные изображения никеля повышена DAB разделах одно- помечены ткани мозга крыс Крысы мозг сеctions которые меченные никеля повышена DAB для Iba1 (A) и Пан-нейронов (В) позволяют для длительного анализа микроглии или нейроны только. Масштабная линейка 20 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Необходимо учитывать оценивается обилие интерес антигеном в ткани анализируются. Косвенные методы (как описано выше) могут быть использованы для целей с низкой численностью. Когда интерес антиген находится в высокой численности, прямые методы могут быть применены. Прямые способы включают первичное антитело, непосредственно конъюгированное с сигналом визуализации, и таким образом не вторичное антитело не требуется. Этот метод упрощает процесс окрашивания, но исключает усиление достигается с помощью косвенных методов. Использование непосредственно конъюгированное первичное антитело также устраняет перекрестной реактивности вторичных антителпри двойном маркировки.
Эта связь подробно протокол для двойного мечения Iba1 и Пан-нейронных (подробности в таблице 1). Iba1 окрашивает микроглии во многих государствах, в том числе активации разветвленной, гипер-разветвленная, активированный, амебоидных, и стержня. Пан-нейронные пятна нейронов аксоны, дендриты, и Сома. Так Iba1 окрашивает большинству микроглии и Пан-нейронов мишеней нейрон, это сочетание пятен полезно в получении широкого понимания микроглии-нейронных взаимодействий.
В общем, иммуногистохимического окрашивания зависит от тщательного подбора антител. Как вопрос исследования становится более конкретным, антитела, антигены к альтернативным может быть лучшего. Чтобы настроить таргетинг на определенное состояние активации микроглии, можно выбрать для использования CD45 CD68 антитела или, скорее, чем Iba1. Кроме того, в работе с мышами, F4 / 80 может обеспечить необходимые результаты. Аналогичным образом, нейронные элементы могут быть специально предназначены с антителами РАИСЭД против ядра, синапсов (до или пост-), аксона, и рост конуса. Кроме того, есть и другие маркеры, которые отличают возраст нейрона (Дважды кортин, NeuN), и регенерацию нейронов (GAP-43).
Protocol
Representative Results
Discussion
Общая цель этой связи было ввести процедуры иммуногистохимии для читателя. Для этого, например, двойной маркировки с Iba1 и Пан-нейронных антигенов наблюдать микроглии и нейронов в параформальдегиде перфузии, был использован сахарозы криопротекции, cryosectioned мозга крысы.
Э…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
References
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l’Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira’s basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).

