Primaire pour Immunohistochimie sur tissus Cryosectioned cerveau de rat: Exemple coloration pour microglies et les neurones
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
Immunohistochimie est une technique largement utilisée pour détecter la présence, l'emplacement et l'abondance relative des antigènes in situ. Ce protocole de niveau d'introduction décrit les réactifs, le matériel et les techniques nécessaires pour compléter la coloration immunohistochimique du tissu cérébral des rongeurs, en utilisant des marqueurs pour les microglies et les éléments neuronaux comme un exemple. Plus précisément, ce document est un protocole étape par étape pour la visualisation fluorescente des microglies et les neurones via immunohistochimie pour Iba1 et Pan-neuronale, respectivement. Fluorescence double marquage est particulièrement utile pour la localisation de multiples protéines dans le même échantillon, en fournissant la possibilité d'observer avec précision les interactions entre les types de cellules, des récepteurs, des ligands, et / ou de la matrice extracellulaire par rapport à l'autre ainsi que des protéines co- localisation à l'intérieur d'une seule cellule. Contrairement à d'autres techniques de visualisation, la fluorescence immunohistochimie intensité de la coloration peut diminuer enles semaines ou mois suivants coloration, à moins que des précautions appropriées soient prises. Malgré cette limitation, dans de nombreuses applications fluorescence double marquage est préférée à d'autres solutions telles que la 3,3'-diaminobenzidine (DAB) ou la phosphatase alcaline (AP), en tant que fluorescence est plus efficace du temps et permet la différenciation plus précise entre deux ou plusieurs marqueurs. La discussion inclut des trucs et conseils pour favoriser la réussite de dépannage.
Introduction
L'immunohistochimie est un procédé pour la détection d'antigènes (par exemple des protéines) dans des coupes de tissu en utilisant des anticorps primaires qui se lient spécifiquement à des antigènes d'intérêt. L'immunohistochimie a été lancée par JR Marrack en 1934 quand il a déterminé que les anticorps peuvent localiser des antigènes avec une grande spécificité 1. A partir de 1942, une partie de la première des études in vitro utilisant des anticorps fluorescents pour visualiser immunohistochimie ont été publiés 2,3, après quoi la première étude in vivo histochimique a été publié 4. Au cours des années 1960, trois ans après le début de méthodes immunohistochimiques, des anticorps conjugués enzymatiques ont commencé à être utilisés comme réactifs secondaires. Ces méthodes ont été développées simultanément et indépendamment en France et aux Etats-Unis 5,6. Aujourd'hui, un large éventail d'anticorps offre des possibilités infinies pour les études d'immunohistochimie 7.
"> L'objectif global de cette correspondance est de fournir une brève introduction dans la coloration immunohistochimique; il est pas censé être un examen complet et exhaustif de cette technique dans le procédé décrit, des techniques d'immunohistochimie pour deux antigènes sont présentés (marqueurs de la microglie et. neurones) pour la coloration de paraformaldehyde perfusé, le saccharose cryoprotégés, le cerveau de rat cryosectioned. La coloration immunohistochimique commence par bloquer la liaison pour réduire la coloration de fond antigène non spécifique. Ensuite, l'incubation avec l'anticorps primaire permet de se lier à un antigène spécifique dans le tissu. À la suite de l'anticorps primaire, un autre anticorps, appelé anticorps secondaire, est appliquée pour lier l'anticorps primaire à un signal de visualisation conjugué 8. L'anticorps secondaire cible de l'immunoglobuline G (IgG) domaine spécifique de l'espèce dans laquelle l'anticorps primaire a été soulevée. L'anticorps secondaire amplifie le signal de l'anticorps primaire depuis les régions Fab de til anticorps secondaire se lient à des sites multiples sur le domaine IgG de l'anticorps primaire. Chacune des enzymes ou des molécules fluorescentes conjuguées aux régions F c de l'anticorps secondaire permettent la visualisation. Par exemple, un anticorps primaire anti-lapin Iba1 est une molécule d'IgG de lapin spécifique pour Iba1. Lorsque âne anti-IgG de lapin est appliqué comme un anticorps secondaire, on reconnaître et se lier à de multiples régions de l'anticorps de lapin anti-IgG Iba1 (voir figure 1). L'anticorps peut être visualisé âne par divers procédés. Cette correspondance met l'accent sur la détection d'un fluorophore conjugué à l'anticorps secondaire qui reconnaît l'anticorps primaire, pour la visualisation par microscopie fluorescente. En immunohistochimie fluorescent, un colorant nucléaire Hoechst ou comme DAPI peut être utilisée pour visualiser tous les noyaux.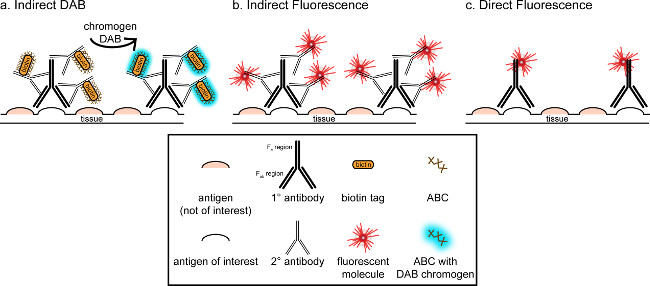
Figure 1: Schreprésentation hématique des vs. directe des techniques de marquage d'anticorps indirecte. anticorps se lient à l'antigène d'intérêt et peut être amplifié par des anticorps secondaires dirigés contre les espèces des anticorps primaires. Cette technique peut être effectuée en utilisant le complexe avidine-biotine (ABC) pour l'amplification et pour la visualisation DAB (A), ou un anticorps secondaire fluorescent directement conjugué (B). Alternativement, des anticorps primaires peuvent être directement conjugués avec de nombreuses balises différentes, y compris la biotine ou un fluorophore (C). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Une méthode alternative pour la visualisation de la coloration immunohistochimique utilise le 3,3'-diaminobenzidine (DAB; voir les figures 1 et 2). Cela diffère de la fluorescence en utilisant un ou biotinyléla peroxydase de raifort (HRP) conjuguée à un anticorps secondaire, qui fournit une enzyme pour convertir DAB à un précipité qui est visible en microscopie à fond clair. Dans les cas où un seul antigène est d'intérêt ou de coloration est appelé à être de longue durée, DAB peut être plus approprié de coloration fluorescente. Cependant, DAB coloration est pas bien adapté pour la différenciation entre des marqueurs multiples, en particulier si deux antigènes nucléaires présentent un intérêt. Pour plus d'informations sur les matériaux de DAB et les modifications de protocole, consulter le tableau 1. En variante, un groupe nitro bleu de chlorure de tétrazolium / 5-Bromo-4-chloro-3-indolyl phosphate (NBT / BCIP) peut être utilisée pour visualiser une phosphatase alcaline (AP) conjugué secondaire anticorps.
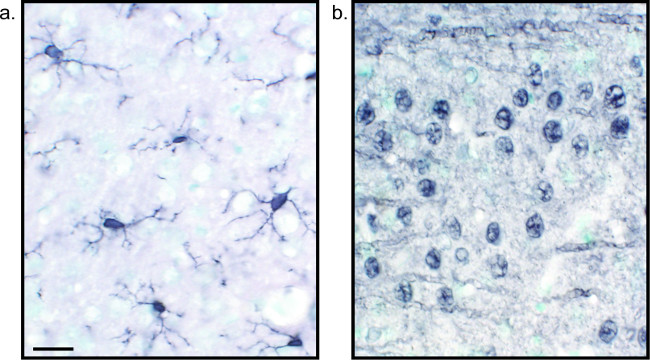
Figure 2:. Des images représentatives de sections individuelles marqué DAB nickel améliorée rat tissus du cerveau de rat cerveau tilisezctions qui sont étiquetés avec des DAB de nickel-amélioré pour Iba1 (A) et Pan-neuronale (B) permettre une analyse de longue durée de la microglie ou neurones seul. Barre d'échelle 20 um. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
Il faut considérer l'abondance estimée de l'antigène d'intérêt dans le tissu analysé. Les méthodes indirectes (comme décrit ci-dessus) sont utiles pour cibles avec une faible abondance. Lorsque l'antigène d'intérêt est en grande abondance, méthodes directes peuvent être appliquées. Les méthodes directes impliquent un anticorps primaire qui est directement conjugué à un signal de visualisation, et donc pas d'anticorps secondaire est exigée. Cette méthode simplifie le processus de coloration, mais élimine l'amplification réalisée par des méthodes indirectes. Utilisation d'un anticorps primaire conjugué directement élimine également la réactivité croisée des anticorps secondaireslors d'un double étiquetage.
Cette communication détaille le protocole pour double marquage avec Iba1 et Pan-neuronales (détails dans le tableau 1). Iba1 colore la microglie dans de nombreux états d'activation, notamment ramifiée, hyper-ramifié, activé, amoeboid, et la tige. Taches Pan-neuronales neuronale axones, dendrites, et Soma. Depuis Iba1 taches les plus microglie et les objectifs pan-neuronales le neurone, cette combinaison de taches est utile à acquérir une large compréhension des interactions neurone-microglie.
En somme, la coloration immunohistochimique repose sur la sélection rigoureuse des anticorps. Comme la question de la recherche devient plus spécifique, des anticorps dirigés contre les antigènes de rechange peuvent être souhaités. Pour cibler un état d'activation de la microglie spécifique, on peut choisir d'utiliser CD45 ou CD68, plutôt que Iba1. En outre, en travaillant avec des souris, F4 / 80 peut fournir les résultats nécessaires. De même, les éléments neuronaux peuvent être spécifiquement ciblées avec des anticorps raised contre le noyau, synapse (avant ou après), axone, et le cône de croissance. En outre, il ya d'autres marqueurs qui différencient l'âge du neurone (Double-Cortin, NeuN), et la régénération neuronale (GAP-43).
Protocol
Representative Results
Discussion
L'objectif global de cette communication était d'introduire des procédures d'immunohistochimie pour le lecteur. Pour cela, l'exemple de double marquage avec Iba1 et antigènes Pan-neuronales pour observer les microglies et les neurones dans paraformaldéhyde perfusé, le saccharose cerveau cryoprotégés, rat cryosectioned a été utilisé.
Cette technique peut être adaptée pour servir des fins interminables. Un tableau d'antigènes différents dans une variété de t…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
References
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l’Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira’s basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).

