Primer för Immunohistokemi på Cryosectioned råtthjärna Vävnad: Exempel färgning för Mikroglia och Neurons
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
Immunohistokemi är en allmänt använd teknik för detektering av närvaron, plats och relativ förekomst av antigener in situ. Denna inledande nivå protokoll beskriver de reagenser, utrustning och tekniker som krävs för att slutföra immunhistokemisk färgning av gnagare hjärnvävnad, användning av markörer för mikroglia och neuronala element som ett exempel. Närmare bestämt är detta papper en steg-för-steg-protokoll för fluorescerande visualisering av mikroglia och nervceller via immunohistokemi för Iba1 och Pan-neuronal resp. Fluorescens dubbel-märkning är särskilt användbar för lokalisering av flera proteiner i samma prov, som ger möjlighet att noggrant observera interaktioner mellan celltyper, receptorer, ligander, och / eller den extracellulära matrisen i förhållande till varandra såväl som protein co- lokalisering inom en enda cell. Till skillnad från andra tekniker visualisering, kan fluorescens immunohistokemi färgningsintensitet minska ide kommande veckorna månader efter färgning, såvida inte lämpliga försiktighetsåtgärder har vidtagits. Trots denna begränsning, i många applikationer fluorescens dubbel-märkning är att föredra framför alternativ såsom 3,3'-diaminobensidin-tetrahydroklorid (DAB) eller alkaliskt fosfatas (AP), som fluorescens är mer tidseffektivt och möjliggör mer exakt differentiering mellan två eller flera markörer. Diskussionen omfattar felsökningstips och råd för att främja framgång.
Introduction
Immunohistokemi är ett förfarande för detektering av antigener (dvs proteiner) i vävnadssnitt med hjälp av primära antikroppar som binder specifikt till antigenerna av intresse. Immunhistokemi var uppfunnen av JR Marrack 1934 när han konstaterat att antikroppar kunde lokalisera antigener med stor specificitet 1. Från och med 1942, några av de första in vitro-studier med fluorescerande antikroppar för att visualisera immunohistokemi publicerades 2,3, varefter den första in vivo-histokemisk studie publicerades 4. Under 1960-talet, tre decennier efter starten av immunhistokemiska metoder, började enzymkonjugerade antikroppar som skall användas som sekundära reagens. Dessa metoder samtidigt och oberoende utvecklat i Frankrike och USA 5,6. Idag erbjuder ett brett utbud av antikroppar oändliga möjligheter för immunohistokemi studier 7.
"> Det övergripande målet för denna korrespondens är att ge en kort introduktion till immunohistokemisk färgning, det är inte tänkt att vara en heltäckande och uttömmande genomgång av denna teknik i den metod som anges är immunohistokemiska tekniker för två antigener presenteras (markörer för mikroglia och. neuroner) för färgning av paraformaldehyd perfusion börjar sackaros kryoskyddad, cryosectioned råtthjärna. Immunohistokemisk färgning med blockerande ospecifik antigenbindning att minska bakgrundsfärgning. Därefter inkubation med primär antikropp gör det möjligt för bindning till ett specifikt antigen i vävnaden. Efter den primära antikroppen, en annan antikropp, benämnd sekundär antikropp, appliceras för att länka den primära antikroppen till ett konjugerat visualisering signal 8. Den sekundära antikroppen riktar sig immunoglobulin G (IgG) domän är specifik för de arter där den primära antikroppen togs upp. förstärker Den sekundära antikroppen signalen av den primära antikroppen, eftersom Fab-regionerna av tHan sekundär antikropp binder till flera webbplatser på IgG-domänen av den primära antikroppen. Antingen enzymer eller fluorescerande molekyler konjugerade till F c regioner i sekundär antikropp möjliggör visualisering. Till exempel är en kanin-anti-Iba1 primär antikropp en kanin-IgG-molekyl specifik för Iba1. När åsne-anti-kanin-IgG anbringas som en sekundär antikropp, kommer den att känna igen och binda till flera regioner av kanin-anti-Iba1 IgG (se figur 1). Åsnan antikropp kan visualiseras med olika metoder. Denna överensstämmelse är inriktad på detektering av en fluorofor konjugerad till den sekundära antikroppen, som igenkänner den primära antikroppen, för visualisering genom fluorescensmikroskopi. I fluorescerande immunohistokemi, kan en nukleär färgning såsom Hoechst eller DAPI användas för att visualisera alla kärnor.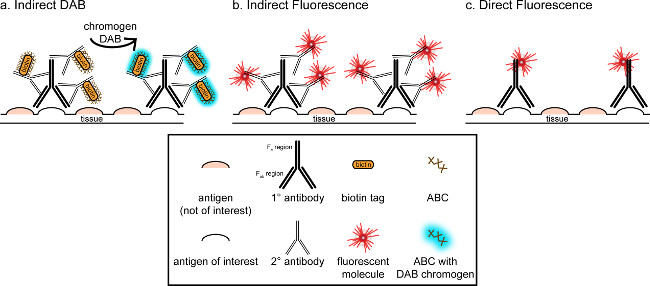
Figur 1: SchEmatic representation av direkt kontra indirekt antikroppsmärkningstekniker. Antikroppar binder till antigenet av intresse och kan förstärkas genom sekundära antikroppar riktade mot arter av de primära antikropparna. Denna teknik kan utföras med användning av avidin-biotin-komplex (ABC) för amplifiering och DAB för visualisering (A), eller en direkt konjugerad fluorescerande sekundär antikropp (B). Alternativt kan primära antikroppar direkt konjugerad med många olika taggar, inklusive biotin eller en fluorofor (C). Klicka här för att se en större version av denna siffra.
En alternativ metod för visualisering av immunohistokemisk färgning använder 3,3'-diaminobensidin-tetrahydroklorid (DAB; se figurerna 1 och 2). Detta skiljer sig från fluorescens genom att använda en biotinylerad ellerpepparrotsperoxidas (HRP) konjugerad sekundär antikropp, som ger ett enzym för att omvandla DAB till en fällning som är synlig under ljusfältsmikroskopi. I de fall där en enda antigen är av intresse eller färgning krävs för att vara långvarig, kan DAB vara lämpligare än fluorescerande färgning. Emellertid DAB-färgning är inte väl lämpad för differentiering mellan flera markörer, särskilt om två nukleära antigener är av intresse. För information om DAB material och protokoll modifieringar, konsultera tabell 1. Alternativt kan nitroblå tetrazoliumklorid / 5-brom-4-klor-3-indolylfosfat (NBT / BCIP) användas för att visualisera en alkalisk fosfatas (AP) konjugerad sekundär antikropp.
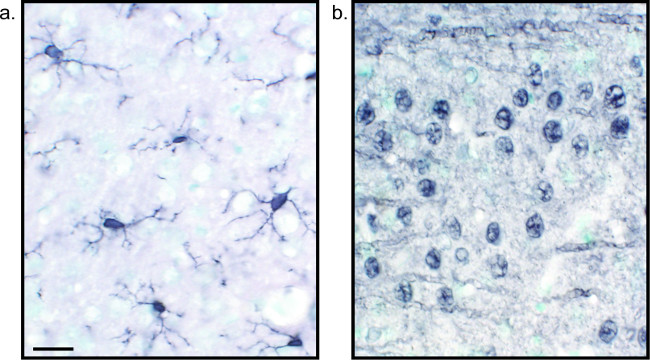
Figur 2:. Bilderna är av nickel-förstärkt DAB enkelmärkta råtthjärnvävnadssnitt Rat hjärnan synsTGÄRDER som är märkta med nickel-förstärkt DAB för Iba1 (A) och Pan-neuronal (B) möjliggör långvarig analys av mikroglia eller nervceller ensam. Skala bar 20 pm. Klicka här för att se en större version av denna siffra.
Man måste beakta det uppskattade överflöd av antigenet av intresse i den vävnad som analyseras. Indirekta metoder (såsom beskrivits ovan) är användbara för mål med låg förekomst. När antigenet av intresse är i hög överflöd, kan direkta metoder tillämpas. Direkta metoder innefattar en primär antikropp som är direkt konjugerad till en visualiseringssignal, och därmed ingen sekundär antikropp krävs. Denna metod förenklar färgningsprocessen, men eliminerar amplifieringen uppnås med indirekta metoder. Med användning av en direkt konjugerad primär antikropp också eliminerar korsreaktivitet av sekundära antikropparnär dubbel märkning.
Detta meddelande specificerar protokoll för dubbelmärkning med Iba1 och Pan-neuronala (detaljer i tabell 1). Iba1 fläckar mikroglia i många aktiverings stater, däribland förgrenat, hyper-förgrenad, aktiveras amöboid och stav. Pan-neuronala fläckar neuronala axoner, dendriter och Soma. Sedan Iba1 fläckar flesta mikroglia och Pan-neuronala mål neuron, är denna kombination av fläckar användbara i att få en bred förståelse för mikroglia-neuron interaktioner.
Sammanfattningsvis bygger immunhistokemisk färgning på noggrant urval av antikroppar. Som frågeställningen blir mer specifika, kan antikroppar riktade till alternativa antigener önska. Om du vill rikta en särskild microglial aktiveringstillstånd, kan man välja att använda CD45 eller CD68 antikroppar, snarare än Iba1. Vidare att arbeta med möss, får F4 / 80 ger de nödvändiga resultaten. På samma sätt kan neuronala element specifikt inriktade med antikroppar raserad mot kärnan, synapsen (före eller efter), axon, och tillväxten konen. Dessutom finns andra markörer som skiljer en ålder av neuron (Dubbel Cortin, NeuN) och neuronal regenerering (GAP-43).
Protocol
Representative Results
Discussion
Det övergripande målet med detta meddelande var att införa immunohistokemi förfaranden för läsaren. För detta, till exempel dubbel-märkning med Iba1 och Pan-neuronala antigener observera mikroglia och nervceller i paraformaldehyd perfusion, var sackaros kryoskyddad, cryosectioned råtthjärna används.
Denna teknik kan anpassas för att tjäna oändliga syften. En mängd olika antigener i en mängd olika typer, såsom men inte vävnads begränsat till hjärnan, lunga, lever, njurar o…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
References
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l’Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira’s basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).

