Multimodal Imaging and Platform microendoscopie Spectroscopy Fiber-bundle pour non-invasive,<em> In Vivo</em> L'analyse des tissus
Summary
The assembly and use of a multimodal microendoscope is described which can co-register superficial tissue image data with tissue physiological parameters including hemoglobin concentration, melanin concentration, and oxygen saturation. This technique can be useful for evaluating tissue structure and perfusion, and can be optimized for individual needs of the investigator.
Abstract
Les techniques récentes de microendoscopie faisceau de fibres permettent une analyse non-invasive de tissu in vivo en utilisant soit des techniques d'imagerie ou une combinaison des techniques de spectroscopie. La combinaison des techniques d'imagerie et de spectroscopie dans une sonde optique unique peut fournir une analyse plus complète de la santé des tissus. Dans cet article, deux modalités différentes sont combinées, l'imagerie à haute résolution fluorescence microendoscopie et la spectroscopie de réflectance diffuse, dans une sonde optique unique. Haute résolution de l'imagerie par fluorescence microendoscopie est une technique utilisée pour visualiser les tissus apicale micro-architecture et, bien que la plupart du temps une technique qualitative a montré la différenciation en temps réel efficace entre les tissus néoplasiques et non néoplasiques. spectroscopie de réflexion diffuse est une technique qui permet d'extraire les paramètres physiologiques de tissus, y compris la concentration en hémoglobine locale, la concentration de la mélanine, et la saturation en oxygène. Cet article décrit les spécifications rbligatoire pour construire la sonde à fibre optique, comment construire l'instrumentation, puis montre la technique sur la peau humaine in vivo. Ce travail a révélé que le tissu micro-architecture, kératinocytes spécifiquement apical de la peau, peut être co-enregistré avec ses paramètres physiologiques associés. La sonde d'instrumentation et de faisceau de fibre présentée ici peut être optimisé soit comme un appareil portatif, ou par voie endoscopique compatible pour une utilisation dans une variété de systèmes d'organes. la recherche clinique supplémentaire est nécessaire pour tester la viabilité de cette technique pour différents états pathologiques épithéliales.
Introduction
Techniques de microendoscopie fibre faisceau analysent typiquement dans un tissu in vivo en utilisant soit des techniques d'imagerie ou une combinaison des techniques de spectroscopie. 1-3 Une telle technique d'imagerie à haute résolution de la fluorescence microendoscopie, peut imager un tissu apicale de micro-architecture avec une résolution de sous-cellulaire dans une petite , micro – champ de vue, en utilisant un agent de contraste topique tel que proflavine, fluorescéine, ou de l' encre pyranine. 1,3-11 Cette modalité d'imagerie a montré prometteur performance clinique dans qualitativement différencier le tissu épithélial malade et sain en temps réel avec une faible variabilité inter-observateur. 8 de temps en temps, les enquêteurs utiliseront les données de microscopie par fluorescence à haute résolution pour extraire des caractéristiques quantitatives telles que la cellule et la taille nucléaire ou de la zone des glandes, mais cela reste une technique essentiellement qualitative ciblée sur la visualisation de la morphologie des tissus. 1,3,8- 10 d'autre part, les techniques de spectroscopie, par exemplecomme la spectroscopie de réflectance diffuse, sont ciblés à fournir des informations de tissus fonctionnels et ont montré prometteur performance clinique pour identifier quantitativement les lésions cancéreuses dans plusieurs organes 2,12-15.
Par conséquent, il y a un besoin pour un dispositif intégrant les deux types de modalités pour potentiellement réduire davantage variabilité inter-observateur, maintenir la visualisation en temps réel du tissu micro-architecture, et de fournir une analyse plus complète de la santé des tissus. Pour atteindre cet objectif, un instrument à base de sonde multimodal a été construit qui combine deux modalités dans une sonde à fibre optique unique:. Haute résolution fluorescence microendoscopie et la spectroscopie de réflectance sous-diffuse 11 Cette méthode de co-registres qualitatives des images à haute résolution de apical la morphologie des tissus (propriétés structurelles) avec des informations quantitatives spectrale (propriétés fonctionnelles) à partir de deux profondeurs de tissu distinctes, y compris la concentration d'hémoglobine locale ([Hb]), la concentration de mélanine ([Mel]), et la saturation en oxygène (SaO 2). 11,12,16 Cette spectroscopie de réflectance modalité de sous-diffuse spécifique utilise deux séparations source-détecteur (FDS) pour échantillonner deux profondeurs de tissus uniques pour fournir une image plus complète de la santé des tissus par échantillonnage jusqu'à la membrane basale et le stroma de tissu sous – jacent. 11
La fibre-sonde est constitué d'un diamètre de 1 mm d'image fibre centrale à environ 4,5 um 50 000 éléments de fibre de diamètre, d'un diamètre de gaine de 1,1 mm et un diamètre de revêtement global de 1,2 mm. La fibre d'image est entourée de cinq 200 um fibres de diamètre avec des diamètres de revêtement de 220 um. Chaque fibre de 200 um multimode est situé à une distance de centre à centre de 864 um à une distance du centre de la fibre d'image. Chacune des fibres multimodes 200 um sont 25 °. En utilisant le plus à gauche fibre multimode de 200 um comme fibre "source", et le plus eree 200 um fibres multimodes comme les fibres "collection", cette géométrie crée nécessairement trois SDD centre à centre de 374 um, 730 um, 1051 um et 1323 um. Les extrémités des fibres sont enfermées dans une enveloppe métallique cylindrique qui maintient les distances entre les fibres constante. Le diamètre de l'enveloppe métallique cylindrique est de 3 mm. L'extrémité distale (vers la pointe de la sonde à fibre optique) de la sonde à fibre optique est de 2 pieds de long. La sonde se sépare alors en six fibres individuelles respectives à l'extrémité proximale (vers l'instrumentation) , ce qui est un temps supplémentaire de 2 pieds de long, pour une longueur totale de 4 pieds. La figure 1 montre une représentation de la sonde à fibre optique.
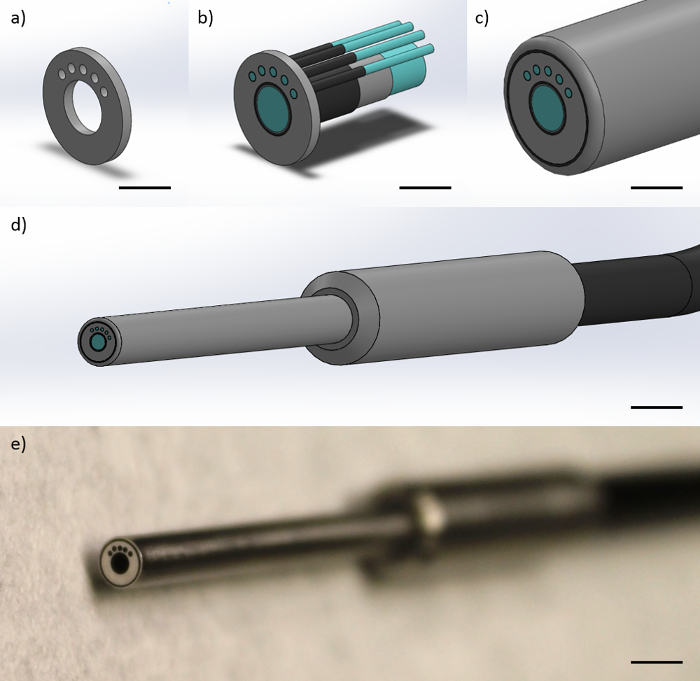
Figure 1:. Conception de la sonde à fibre optique La sonde à fibre optique se compose d'un 1 mm de diamètre d' image fibre et quatre 200 um fibres multimodes. Cefigure montre des représentations de (a) l'embout métallique qui limite la géométrie des fibres à la pointe de la sonde pour obtenir SDD de 374, 730 et 1051 um par rapport à la gauche de 200 fibres um multimode (barre d' échelle ≈ 1 mm), (b) les fibres étant limitées dans le capuchon métallique, montrant les noyaux de fibres, gaine de fibre, et revêtement de fibres (barre d' échelle ≈ 1 mm), (c) le polyamide de gaine protectrice autour des fibres (barre d' échelle ≈ 1 mm), (d ) l'embout distal fini de la sonde, avec la poignée de doigt métallique et unique câble noir contenant toutes les fibres (barre d' échelle ≈ 4 mm), et (e) une image de l'extrémité distale de la sonde (barre d' échelle ≈ 4 mm). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Cette instrumentation multimodal et techni associéQue est la première combinaison de ces modalités au sein d'une seule sonde, bien que d'autres techniques structurelles / fonctionnelles combinées existent qui combinent différentes modalités. Par exemple, l' imagerie hyperspectrale combine l' imagerie grand champ avec l' hémoglobine et la mélanine propriétés quantitatives, 17,18 et d' autres techniques ont été développées qui combinent la tomographie par cohérence optique (OCT) avec l' analyse de l' expression des protéines tissulaires, 19 pour ne citer que quelques – uns. Cet article présente une configuration d'instrumentation compacte et facile à mettre en œuvre qui utilise une sonde générale de fibre optique qui peut être optimisée à des fins diverses, y compris l'utilisation endoscopique dans le tube et de l'oesophage gastro-intestinal inférieur ou comme sonde de poche pour une utilisation dans la cavité buccale et le placement de la peau externe. 11,20
Le matériel pour cette instrumentation nécessite à la fois l'acquisition de données personnalisées et le code de post-traitement pour acquérir des spectres de réflectance diffuse, puis extraire le volum résultanttissus paramètres physiologiques e-moyenne , y compris [Hb], [Mel], et SaO 2. Le code d'acquisition de données personnalisées a été construit pour permettre l'acquisition simultanée d'une caméra (pour la microscopie de fluorescence à haute résolution) et un spectromètre (pour la spectroscopie de réflectance diffuse). Les pilotes sont souvent disponibles sur les sites Web des fabricants pour permettre l'intégration avec une variété de langages de programmation. Le code post-traitement personnalisé importe une des valeurs d'absorption a priori in vivo [Hb] et [Mel] 21 et utilise un procédé de montage d'optimisation non linéaire précédemment développé qui crée une courbe ajustée des spectres. 22 La courbe ajustée est construit en minimisant la χ 2 valeur entre lui – même et les spectres bruts et la détermination des tissus paramètres physiologiques ([Hb], [Mel], et SÃO 2) à partir de la courbe ajustée et avec le χ 2 plus bas prix. 22 le code peut être modifié pour inclurel'absorption d'autres chromophores ainsi, comme l'encre pyranine exogène utilisé ici, ainsi que des paramètres physiologiques cibles ne sont pas affectés.
Indicateurs physiologiques de la santé des tissus, tels que [Hb], [Mel], et SaO 2, peuvent être utilisés comme des rapports de la réponse tumorale à la thérapie ou comme des indicateurs de la vascularisation locale et l' angiogenèse. 14,23 Y compris une haute résolution fluorescence microendoscopie modalité aide le placement de la sonde de guidage et fournit aux enquêteurs une image plus complète de la relation entre la structure du tissu épithélial et la fonction. Dans cet article, la construction et l' application du microendoscope multimodal est décrit. 11
Protocol
Representative Results
Discussion
L'imagerie à haute résolution multimodal et sous-spectroscopie de réflectance diffuse de faisceau de fibre microendoscope rapportée ici peuvent être optimisés et utilisés par les enquêteurs pour une variété d'applications, y compris endoscopique ou l'utilisation de poche pour les études humaines ou animales. Elle fournit ainsi une méthode souple pour la visualisation des tissus de micro-architecture apicale vivo à côté des mesures de concentration en hémoglobine, la co…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This material is based on work supported by the National Institutes of Health (1R03-CA182052, 1R15-CA202662), the National Science Foundation Graduate Research Fellowship Program (G.G., DGE-1450079), the Arkansas Biosciences Institute, and the University of Arkansas Doctoral Academy Fellowship. Any opinions, findings, and conclusions or recommendations expressed in this material are those of the authors and do not necessarily reflect the views of the acknowledged funding agencies.
Materials
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs, Inc. | CM1-DCH | |
| 470 nm Dichroic Mirror (Beam Splitter) | Chroma Corporation | T470lpxr | |
| Cage Assembly Rod, 1.5", 4-Pack | Thorlabs, Inc. | ER1.5-P4 | |
| Cage Assembly Rod, 3.0", 4-Pack | Thorlabs, Inc. | ER3-P4 | |
| Cage Assembly Rod, 2.0", 4-Pack | Thorlabs, Inc. | ER2-P4 | |
| SM1-Threaded 30 mm Cage Plate | Thorlabs, Inc. | CP02 | |
| SM1 Series Stress-Free Retaining Ring | Thorlabs, Inc. | SM1PRR | |
| SM1 Lens Tube, 1.00" Thread Depth | Thorlabs, Inc. | SM1L10 | |
| Right-Angle Kinematic Mirror Mount | Thorlabs, Inc. | KCB1 | |
| 1" UV Enhanced Aluminum Mirror | Thorlabs, Inc. | PF10-03-F01 | |
| Z-Axis Translation Mount | Thorlabs, Inc. | SM1Z | |
| 10X Olympus Plan Achromatic Objective | Thorlabs, Inc. | RMS10X | |
| XY Translating Lens Mount | Thorlabs, Inc. | CXY1 | |
| SMA Fiber Adapter Plate with SM1 Thread | Thorlabs, Inc. | SM1SMA | |
| SM1 Lens Tube, 0.50" Thread Depth | Thorlabs, Inc. | SM1L05 | |
| 440/40 Bandpass Filter (Excitation) | Chroma Corporation | ET440/40x | |
| 525/36 Bandpass Filter (Emission) | Chroma Corporation | ET525/36m | |
| Quick Set Epoxy | Loctite | 1395391 | |
| 455 nm LED Light Housing Kit – 3-Watt | LED Supply | ALK-LH-3W-KIT | |
| 1" Achromatic Doublet, f=50mm | Thorlabs, Inc. | AC254-050-A | |
| Flea 3 USB Monochrome Camera | Point Grey, Inc. | FL3-U3-32S2M-CS | |
| 0.5" Post Holder, L = 1.5" | Thorlabs, Inc. | PH1.5 | |
| 0.5" Optical Post, L = 4.0" | Thorlabs, Inc. | TR4 | |
| Mounting Base, 1" x 2.3" x 3/8" | Thorlabs, Inc. | BA1S | |
| Long Lifetime Tungsten-Halogen Light Source (Vis-NIR) | Ocean Optics | HL-2000-LL | |
| 20X Olympus Plan Objective | Edmund Optics, Inc. | PLN20X | |
| Custom-Built Aluminum Motor Arm | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Arm Adaptor | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Housing | N/A | N/A | Custom designed and built |
| Stepper Motor – 400 steps/revolution | SparkFun Electronics | ROB-10846 | Multiple suppliers |
| Custom-Built Aluminum Optical Fiber Switch | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Optical Fiber Switch Face-Plate | N/A | N/A | Custom designed and built |
| Arduino Uno – R3 | SparkFun Electronics | DEV-11021 | Multiple suppliers |
| Electronic Breadboard – Self-Adhesive | SparkFun Electronics | PRT-12002 | Multiple suppliers |
| EasyDriver – Stepper Motor Driver | Sparkfun Electronics | ROB-12779 | |
| 12V, 229 mA Power Supply | Phihong | PSM03A | Multiple suppliers |
| Enhanced Sensitivity USB Spectrometer (Vis-NIR) | Ocean Optics | USB2000+VIS-NIR-ES | |
| 550 µm, 0.22 NA, SMA-SMA Fiber Patch Cable | Thorlabs, Inc. | M37L01 | |
| Custom-Built Fiber-Optic Probe | Myriad Fiber Imaging | N/A | |
| 20% Spectralon Diffuse Reflectance Standard | Labsphere, Inc. | SRS-20-010 | |
| Standard Yellow Highlighter | Sharpie | 25005 | Multiple suppliers, proflavine or fluorescein can be substituted |
References
- Muldoon, T. J., et al. Subcellular-resolution molecular imaging within living tissue by fiber microendoscopy. Opt Express. 15, 16413-16423 (2007).
- Rajaram, N., Reichenberg, J. S., Migden, M. R., Nguyen, T. H., Tunnell, J. W. Pilot clinical study for quantitative spectral diagnosis of non-melanoma skin cancer. Lasers Surg Med. 42, 716-727 (2010).
- Louie, J. S., Richards-Kortum, R., Anandasabapathy, S. Applications and advancements in the use of high-resolution microendoscopy for detection of gastrointestinal neoplasia. Clin Gastroenterol Hepatol. 12, 1789-1792 (2014).
- Chang, S. S., et al. High resolution microendoscopy for classification of colorectal polyps. Endoscopy. 45, 553-559 (2013).
- Muldoon, T. J., et al. Noninvasive imaging of oral neoplasia with a high-resolution fiber-optic microendoscope. Head Neck. 34, 305-312 (2011).
- Muldoon, T. J., et al. Evaluation of quantitative image analysis criteria for the high-resolution microendoscopic detection of neoplasia in Barrett’s esophagus. J Biomed Opt. 15, 026027 (2010).
- Prieto, S. P., Powless, A. J., Boice, J. W., Sharma, S. G., Muldoon, T. J. Proflavine Hemisulfate as a Fluorescent Contrast Agent for Point-of-Care Cytology. PLoS One. 10, e0125598 (2015).
- Parikh, N., et al. In vivo diagnostic accuracy of high resolution microendoscopy in differentiating neoplastic from non-neoplastic colorectal polyps: a prospective study. Am J Gastroenterol. 109, 68-75 (2014).
- Shin, D., et al. Quantitative analysis of high-resolution microendoscopic images for diagnosis of esophageal squamous cell carcinoma. Clin Gastroenterol Hepatol. 13, 272-279 (2015).
- Prieto, S. P., et al. Qualitative and quantitative comparison of colonic microendoscopy image features to histopathology. Proc SPIE Int Soc Opt Eng. 9328, (2015).
- Greening, G. J., et al. Fiber-bundle microendoscopy with sub-diffuse reflectance spectroscopy and intensity mapping for multimodal optical biopsy of stratified epithelium. Biomed Opt Express. 6, 4934-4950 (2015).
- Rajaram, N., Gopal, A., Zhang, X., Tunnell, J. W. Experimental validation of the effects of microvasculature pigment packaging on in vivo diffuse reflectance spectroscopy. Lasers Surg Med. 42, 680-688 (2010).
- Spliethoff, J. W., et al. Monitoring of tumor response to cisplatin using optical spectroscopy. Transl Oncol. 7, 230-239 (2014).
- Chang, V. T., et al. Quantitative physiology of the precancerous cervix in vivo through optical spectroscopy. Neoplasia. 11, 325-332 (2009).
- Yu, B., Shah, A., Nagarajan, V. K., Ferris, D. G. Diffuse reflectance spectroscopy of epithelial tissue with a smart fiber-optic probe. Biomed Opt Express. 5, 675-689 (2014).
- Hennessy, R., Goth, W., Sharma, M., Markey, M. K., Tunnell, J. W. Effect of probe geometry and optical properties on the sampling depth for diffuse reflectance spectroscopy. J Biomedical Opt. 19, 107002 (2014).
- Ghassemi, P., Travis, T. E., Moffatt, L. T., Shupp, J. W., Ramella-Roman, J. C. A polarized multispectral imaging system for quantitative assessment of hypertrophic scars. Biomed Opt Express. 5, 3337-3354 (2014).
- Vasefi, F., et al. Polarization-sensitive hyperspectral imaging in vivo: a multimode dermoscope for skin analysis. Sci Rep. 4, (2014).
- Winkler, A. M., Rice, P. F. S., Drezek, R. A., Barton, J. K. Quantitative tool for rapid disease mapping using optical coherence tomography images of azoxymethane-treated mouse colon. J Biomedl Opt. 15, 041512 (2010).
- Bish, S. F., et al. Handheld Diffuse Reflectance Spectral Imaging (DRSi) for in-vivo characterization of skin. Biomed Opt Express. 5, 573-586 (2014).
- Prahl, S. A. . Optical Absorption of Hemoglobin. , (1999).
- Rajaram, N., et al. Design and validation of a clinical instrument for spectral diagnosis of cutaneous malignancy. Appl Opt. 49, 142-152 (2010).
- Hennessy, R., Markey, M. K., Tunnell, J. W. Impact of one-layer assumption on diffuse reflectance spectroscopy of skin. J Biomed Opt. 20, 27001 (2015).
- Rajaram, N., Nguyen, T. H., Tunnell, J. W. Lookup table-based inverse model for determining optical properties of turbid media. J Biomed Opt. 13, 050501 (2008).
- Nichols, B. S., Rajaram, N., Tunnell, J. W. Performance of a lookup table-based approach for measuring tissue optical properties with diffuse optical spectroscopy. J Biomed Opt. 17, 057001 (2012).
- Greening, G. J., James, H. M., Muldoon, T. J. . Optical Phantoms: Diffuse and Sub-diffuse Imaging and Spectroscopy Validation. , 1-37 (2015).
- Karsten, A. E., Smit, J. E. Modeling and verification of melanin concentration on human skin type. Photochem Photobiol. 88, 469-474 (2012).
- Glennie, D. L., Hayward, J. E., Farrell, T. J. Modeling changes in the hemoglobin concentration of skin with total diffuse reflectance spectroscopy. J Biomed Opt. 20, 035002 (2015).
- Lim, L., Nichols, B., Rajaram, N., Tunnell, J. W. Probe pressure effects on human skin diffuse reflectance and fluorescence spectroscopy measurements. J Biomed Opt. 16, 011012 (2011).

