マルチモーダルイメージングおよび非侵襲のための分光繊維束Microendoscopyプラットフォーム、<em>インビボ</em>組織分析
Summary
The assembly and use of a multimodal microendoscope is described which can co-register superficial tissue image data with tissue physiological parameters including hemoglobin concentration, melanin concentration, and oxygen saturation. This technique can be useful for evaluating tissue structure and perfusion, and can be optimized for individual needs of the investigator.
Abstract
最近の繊維束microendoscopy技術は、イメージング技術または分光技術の組み合わせのいずれかを用いてインビボで組織の非侵襲的な分析を可能にします。単一の光プローブにイメージングと分光技術を組み合わせることにより、組織の健康状態のより完全な分析を提供することができます。この記事では、2つの異なる様式は、単一の光プローブに、高解像度蛍光microendoscopy画像と拡散反射分光法を組み合わせています。高分解能蛍光microendoscopyイメージングは、頂端組織のマイクロアーキテクチャを視覚化し、主に質的な技術がために使用される技術である腫瘍性および非腫瘍性組織との間の効果的なリアルタイムの分化を示しました。拡散反射分光法は、局所ヘモグロビン濃度、メラニン濃度、および酸素飽和度を含む組織の生理学的パラメータを抽出することができる技術です。この記事では、仕様rを説明しますインスツルメンテーションを構築し、その後、in vivoでヒトの皮膚上の技術を実証する方法を、光ファイバープローブを構築するためにequired。この作品は、具体的には、頂端皮膚ケラチノサイトは、その関連する生理学的パラメータと同時登録することができ、組織のマイクロアーキテクチャことを明らかにしました。ここで紹介する計測機器や繊維束プローブは、器官系の様々な使用のためのハンドヘルドまたは内視鏡と互換性のあるデバイスのいずれかとして最適化することができます。追加の臨床研究は、異なる上皮疾患状態のためのこの技術の実行可能性をテストするために必要とされます。
Introduction
繊維束microendoscopy技術は、典型的には、イメージング技術または分光技術の組み合わせのいずれかを用いて、インビボ組織に分析する。小サブセルラー解像度で1-3一つのそのようなイメージング技術、高分解能蛍光microendoscopy、缶画像頂端組織のマイクロアーキテクチャ、マイクロスケール視野、プロフラビン、フルオレセイン、またはピラニンインクなどの局所造影剤を使用して。1,3-11このイメージングモダリティは、質的に低いとリアルタイムに罹患し、健康な上皮組織を分化における有望な臨床成績を示しています観察者間変動。8時には、研究者らは、細胞や核の大きさや腺領域として定量的な特徴を抽出するために、高解像度蛍光顕微鏡データを使用しますが、これは組織形態を可視化をターゲットに、主に定性的な手法のまま。1,3,8-一方10、分光技術は、このような拡散反射分光法のような機能的な組織情報を提供し、定量的に、複数の臓器に癌病変を識別する際に臨床成績を約束を示しているに向かって標的化される。2,12-15
したがって、潜在的にモダリティの両方のタイプを組み込んだデバイスが必要であり、さらに、観察者間の変動を減少させる、組織のマイクロアーキテクチャのリアルタイム可視化を維持し、組織の健康状態のより完全な分析を提供します。この目標を達成するために、マルチモーダルプローブベースの機器は、単一の光ファイバープローブ内の2つのモダリティ組み合わせた構築した。高分解能蛍光microendoscopyサブ拡散反射分光法を頂端の定性的な高解像度画像11このメソッド共レジスタ地元のヘモグロビン濃度を含む二つの異なる組織の深さから定量的なスペクトル情報(機能的特性)との組織形態(構造特性)([HB])、メラニン濃度([メル])、および酸素飽和度(SAO 2)。11,12,16は、この特定のサブ拡散反射分光法様式は、提供するために2つのユニークな組織深度をサンプリングするために2つの光源-検出器の分離(のSDS)を使用し基底膜と下にある組織間質にダウンサンプリングすることで組織の健康のより包括的な画像。11
ファイバープローブは、約50,000 4.5μmの直径の繊維要素、1.1ミリメートルと1.2ミリメートルの全体的なコーティング直径のクラッド径を有する中央1ミリメートル径のイメージファイバで構成されています。イメージファイバは、220ミクロンのクラッド直径が5 200ミクロンの直径の繊維に囲まれています。各200μmのマルチモード光ファイバは、離れてイメージファイバの中心から864ミクロンの中心間距離に位置しています。 200μmのマルチモードファイバの各々が25°離れています。 「ソース」繊維として左端200μmのマルチモードファイバを使用して、追加目μmの「コレクション」繊維として200μmのマルチモードファイバをreeが、この形状は、必ずしも374ミクロンの3中心のSDSを作成し、730ミクロン、1051ミクロン、および1323。ファイバー先端は、一定の繊維間の距離を保つ筒状の金属ケース内に封入されています。円筒状の金属ケースの直径は3mmです。光ファイバープローブの先端部(光ファイバープローブ先端に向かって)は2フィートの長さです。プローブを4フィート全長のために、さらに2フィートである(計装向かって)近位端部6のそれぞれの個々の繊維に分離する。 図1は、光ファイバープローブの表現を示します。
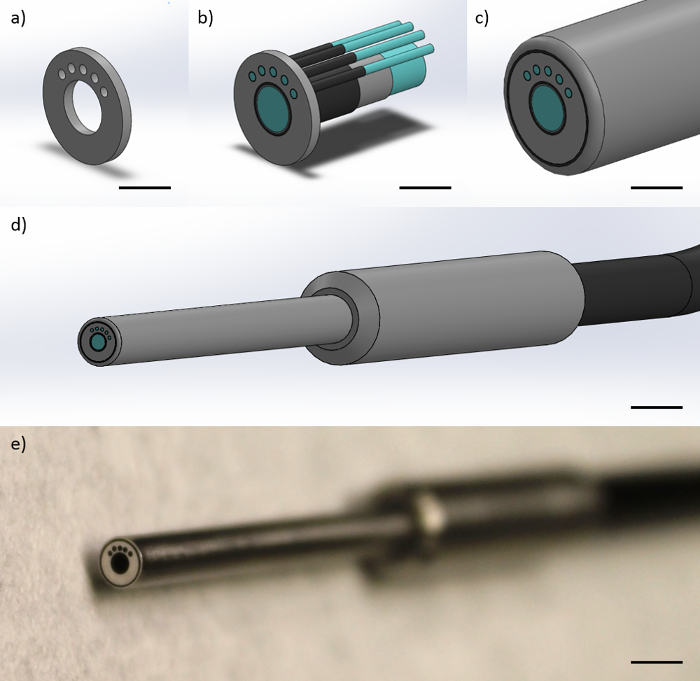
図1:光ファイバープローブ設計光ファイバープローブは、1 1ミリメートル径のイメージファイバと4200μmのマルチモードファイバで構成されています。このこの図は、左端の200ミクロンのマルチモードファイバ(スケールバー≈1ミリメートル)に対する374ののSDSを得るために、プローブ先端で繊維の形状を制約する(a)は、金属製エンドキャップの表現、730、および1051ミクロンを示しています(b)は、繊維が、金属キャップ内に拘束され、ファイバコア、ファイバクラッディング、およびファイバ被覆(スケールバー≈1mm)で示し、(c)は 、繊維の周りに保護ポリアミドシース(スケールバー≈1 mm)と、(D )金属フィンガーグリップと全ての繊維を含む単一の黒いケーブル(スケールバー≈4ミリメートル)、および(e)プローブ(スケールバー≈4ミリメートルの遠位先端の絵)を有するプローブの完成遠位先端部、。 この図の拡大版をご覧になるにはこちらをクリックしてください。
このマルチモーダル機器および関連するテクニック他の複合構造/機能の技術はそれが異なるモダリティを組み合わせる存在しないが、QUEは、単一のプローブ内のこれらの様式の第一の組み合わせです。例えば、ハイパースペクトルイメージングは定量的なヘモグロビンおよびメラニン特性を有する広視野イメージングを組み合わせた、17,18、および他の技術は、いくつか例を挙げると19、組織のタンパク質発現の分析を光コヒーレンストモグラフィー(OCT)を組み合わせたものが開発されています。下部消化管および食道内または口腔内で使用するためのハンドヘルドプローブとして、内視鏡の使用など、様々な目的のために最適化することができ、一般的な光ファイバープローブを使用し、コンパクトで簡単に実装する計装セットアップでこの記事を報告そして、外部の皮膚の配置。11,20
この計測器のハードウェアは、拡散反射スペクトルを取得した後、得られたvolumを抽出するために、カスタム・データ収集および後処理コードの両方を必要とします[Hbの]、[メル]、およびSAO 2を含む電子平均組織の生理的パラメータ。カスタムデータ取得コードは、(高分解能蛍光顕微鏡用)カメラから同時に取得し、(拡散反射分光法)分光計を可能にするように構築されました。ドライバは、多くの場合、さまざまなプログラミング言語との統合を可能にするために、メーカーのウェブサイトから入手可能です。カスタム後処理コードがin vivoでの先験的吸収値をインポートする[ヘモグロビン]と[メル] 21、その後スペクトルの近似曲線を作成し、以前に開発された非線形最適化フィッティング処理を採用しています。22近似曲線を最小化することにより構築されています自身と生のスペクトルとの間のχ2値が近似曲線から、最低χ2値。22コードを用いて組織の生理的パラメータ([ヘモグロビン]、[メル]、およびSAO 2)を決定すること含むように修正することができますそのようなここで使用される外因性のピラニンインクとしてだけでなく、他の発色団から吸収するので、そのターゲットの生理的パラメータは影響を受けません。
このような【のHb]、[メル]、およびSAO 2などの組織の健康の生理学的指標は、治療に対する腫瘍応答の報告として、または局所血管新生および血管形成の指標として用いることができる。高分解能蛍光microendoscopyモダリティ含める14,23ガイドプローブの配置を助け、上皮組織の構造と機能の関係の全体像と研究者を提供します。この記事では、マルチモーダルmicroendoscopeの構築と応用が記載されている。11
Protocol
Representative Results
Discussion
ここで報告マルチモーダル高解像度画像とサブ拡散反射分光法繊維束microendoscopeは、ヒトまたは動物の研究のための内視鏡またはハンドヘルドの使用を含む種々の用途のために研究者によって最適化して使用することができます。従って、ヘモグロビン濃度、メラニン濃度、および2つの異なる組織の深さからの組織酸素飽和度の測定値と一緒に、インビボ頂端組織のマイクロアー?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This material is based on work supported by the National Institutes of Health (1R03-CA182052, 1R15-CA202662), the National Science Foundation Graduate Research Fellowship Program (G.G., DGE-1450079), the Arkansas Biosciences Institute, and the University of Arkansas Doctoral Academy Fellowship. Any opinions, findings, and conclusions or recommendations expressed in this material are those of the authors and do not necessarily reflect the views of the acknowledged funding agencies.
Materials
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs, Inc. | CM1-DCH | |
| 470 nm Dichroic Mirror (Beam Splitter) | Chroma Corporation | T470lpxr | |
| Cage Assembly Rod, 1.5", 4-Pack | Thorlabs, Inc. | ER1.5-P4 | |
| Cage Assembly Rod, 3.0", 4-Pack | Thorlabs, Inc. | ER3-P4 | |
| Cage Assembly Rod, 2.0", 4-Pack | Thorlabs, Inc. | ER2-P4 | |
| SM1-Threaded 30 mm Cage Plate | Thorlabs, Inc. | CP02 | |
| SM1 Series Stress-Free Retaining Ring | Thorlabs, Inc. | SM1PRR | |
| SM1 Lens Tube, 1.00" Thread Depth | Thorlabs, Inc. | SM1L10 | |
| Right-Angle Kinematic Mirror Mount | Thorlabs, Inc. | KCB1 | |
| 1" UV Enhanced Aluminum Mirror | Thorlabs, Inc. | PF10-03-F01 | |
| Z-Axis Translation Mount | Thorlabs, Inc. | SM1Z | |
| 10X Olympus Plan Achromatic Objective | Thorlabs, Inc. | RMS10X | |
| XY Translating Lens Mount | Thorlabs, Inc. | CXY1 | |
| SMA Fiber Adapter Plate with SM1 Thread | Thorlabs, Inc. | SM1SMA | |
| SM1 Lens Tube, 0.50" Thread Depth | Thorlabs, Inc. | SM1L05 | |
| 440/40 Bandpass Filter (Excitation) | Chroma Corporation | ET440/40x | |
| 525/36 Bandpass Filter (Emission) | Chroma Corporation | ET525/36m | |
| Quick Set Epoxy | Loctite | 1395391 | |
| 455 nm LED Light Housing Kit – 3-Watt | LED Supply | ALK-LH-3W-KIT | |
| 1" Achromatic Doublet, f=50mm | Thorlabs, Inc. | AC254-050-A | |
| Flea 3 USB Monochrome Camera | Point Grey, Inc. | FL3-U3-32S2M-CS | |
| 0.5" Post Holder, L = 1.5" | Thorlabs, Inc. | PH1.5 | |
| 0.5" Optical Post, L = 4.0" | Thorlabs, Inc. | TR4 | |
| Mounting Base, 1" x 2.3" x 3/8" | Thorlabs, Inc. | BA1S | |
| Long Lifetime Tungsten-Halogen Light Source (Vis-NIR) | Ocean Optics | HL-2000-LL | |
| 20X Olympus Plan Objective | Edmund Optics, Inc. | PLN20X | |
| Custom-Built Aluminum Motor Arm | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Arm Adaptor | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Housing | N/A | N/A | Custom designed and built |
| Stepper Motor – 400 steps/revolution | SparkFun Electronics | ROB-10846 | Multiple suppliers |
| Custom-Built Aluminum Optical Fiber Switch | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Optical Fiber Switch Face-Plate | N/A | N/A | Custom designed and built |
| Arduino Uno – R3 | SparkFun Electronics | DEV-11021 | Multiple suppliers |
| Electronic Breadboard – Self-Adhesive | SparkFun Electronics | PRT-12002 | Multiple suppliers |
| EasyDriver – Stepper Motor Driver | Sparkfun Electronics | ROB-12779 | |
| 12V, 229 mA Power Supply | Phihong | PSM03A | Multiple suppliers |
| Enhanced Sensitivity USB Spectrometer (Vis-NIR) | Ocean Optics | USB2000+VIS-NIR-ES | |
| 550 µm, 0.22 NA, SMA-SMA Fiber Patch Cable | Thorlabs, Inc. | M37L01 | |
| Custom-Built Fiber-Optic Probe | Myriad Fiber Imaging | N/A | |
| 20% Spectralon Diffuse Reflectance Standard | Labsphere, Inc. | SRS-20-010 | |
| Standard Yellow Highlighter | Sharpie | 25005 | Multiple suppliers, proflavine or fluorescein can be substituted |
References
- Muldoon, T. J., et al. Subcellular-resolution molecular imaging within living tissue by fiber microendoscopy. Opt Express. 15, 16413-16423 (2007).
- Rajaram, N., Reichenberg, J. S., Migden, M. R., Nguyen, T. H., Tunnell, J. W. Pilot clinical study for quantitative spectral diagnosis of non-melanoma skin cancer. Lasers Surg Med. 42, 716-727 (2010).
- Louie, J. S., Richards-Kortum, R., Anandasabapathy, S. Applications and advancements in the use of high-resolution microendoscopy for detection of gastrointestinal neoplasia. Clin Gastroenterol Hepatol. 12, 1789-1792 (2014).
- Chang, S. S., et al. High resolution microendoscopy for classification of colorectal polyps. Endoscopy. 45, 553-559 (2013).
- Muldoon, T. J., et al. Noninvasive imaging of oral neoplasia with a high-resolution fiber-optic microendoscope. Head Neck. 34, 305-312 (2011).
- Muldoon, T. J., et al. Evaluation of quantitative image analysis criteria for the high-resolution microendoscopic detection of neoplasia in Barrett’s esophagus. J Biomed Opt. 15, 026027 (2010).
- Prieto, S. P., Powless, A. J., Boice, J. W., Sharma, S. G., Muldoon, T. J. Proflavine Hemisulfate as a Fluorescent Contrast Agent for Point-of-Care Cytology. PLoS One. 10, e0125598 (2015).
- Parikh, N., et al. In vivo diagnostic accuracy of high resolution microendoscopy in differentiating neoplastic from non-neoplastic colorectal polyps: a prospective study. Am J Gastroenterol. 109, 68-75 (2014).
- Shin, D., et al. Quantitative analysis of high-resolution microendoscopic images for diagnosis of esophageal squamous cell carcinoma. Clin Gastroenterol Hepatol. 13, 272-279 (2015).
- Prieto, S. P., et al. Qualitative and quantitative comparison of colonic microendoscopy image features to histopathology. Proc SPIE Int Soc Opt Eng. 9328, (2015).
- Greening, G. J., et al. Fiber-bundle microendoscopy with sub-diffuse reflectance spectroscopy and intensity mapping for multimodal optical biopsy of stratified epithelium. Biomed Opt Express. 6, 4934-4950 (2015).
- Rajaram, N., Gopal, A., Zhang, X., Tunnell, J. W. Experimental validation of the effects of microvasculature pigment packaging on in vivo diffuse reflectance spectroscopy. Lasers Surg Med. 42, 680-688 (2010).
- Spliethoff, J. W., et al. Monitoring of tumor response to cisplatin using optical spectroscopy. Transl Oncol. 7, 230-239 (2014).
- Chang, V. T., et al. Quantitative physiology of the precancerous cervix in vivo through optical spectroscopy. Neoplasia. 11, 325-332 (2009).
- Yu, B., Shah, A., Nagarajan, V. K., Ferris, D. G. Diffuse reflectance spectroscopy of epithelial tissue with a smart fiber-optic probe. Biomed Opt Express. 5, 675-689 (2014).
- Hennessy, R., Goth, W., Sharma, M., Markey, M. K., Tunnell, J. W. Effect of probe geometry and optical properties on the sampling depth for diffuse reflectance spectroscopy. J Biomedical Opt. 19, 107002 (2014).
- Ghassemi, P., Travis, T. E., Moffatt, L. T., Shupp, J. W., Ramella-Roman, J. C. A polarized multispectral imaging system for quantitative assessment of hypertrophic scars. Biomed Opt Express. 5, 3337-3354 (2014).
- Vasefi, F., et al. Polarization-sensitive hyperspectral imaging in vivo: a multimode dermoscope for skin analysis. Sci Rep. 4, (2014).
- Winkler, A. M., Rice, P. F. S., Drezek, R. A., Barton, J. K. Quantitative tool for rapid disease mapping using optical coherence tomography images of azoxymethane-treated mouse colon. J Biomedl Opt. 15, 041512 (2010).
- Bish, S. F., et al. Handheld Diffuse Reflectance Spectral Imaging (DRSi) for in-vivo characterization of skin. Biomed Opt Express. 5, 573-586 (2014).
- Prahl, S. A. . Optical Absorption of Hemoglobin. , (1999).
- Rajaram, N., et al. Design and validation of a clinical instrument for spectral diagnosis of cutaneous malignancy. Appl Opt. 49, 142-152 (2010).
- Hennessy, R., Markey, M. K., Tunnell, J. W. Impact of one-layer assumption on diffuse reflectance spectroscopy of skin. J Biomed Opt. 20, 27001 (2015).
- Rajaram, N., Nguyen, T. H., Tunnell, J. W. Lookup table-based inverse model for determining optical properties of turbid media. J Biomed Opt. 13, 050501 (2008).
- Nichols, B. S., Rajaram, N., Tunnell, J. W. Performance of a lookup table-based approach for measuring tissue optical properties with diffuse optical spectroscopy. J Biomed Opt. 17, 057001 (2012).
- Greening, G. J., James, H. M., Muldoon, T. J. . Optical Phantoms: Diffuse and Sub-diffuse Imaging and Spectroscopy Validation. , 1-37 (2015).
- Karsten, A. E., Smit, J. E. Modeling and verification of melanin concentration on human skin type. Photochem Photobiol. 88, 469-474 (2012).
- Glennie, D. L., Hayward, J. E., Farrell, T. J. Modeling changes in the hemoglobin concentration of skin with total diffuse reflectance spectroscopy. J Biomed Opt. 20, 035002 (2015).
- Lim, L., Nichols, B., Rajaram, N., Tunnell, J. W. Probe pressure effects on human skin diffuse reflectance and fluorescence spectroscopy measurements. J Biomed Opt. 16, 011012 (2011).

