Imaging Multimodale e la piattaforma Microendoscopy Spettroscopia Fiber-fascio per non invasiva,<em> In Vivo</em> Analisi dei tessuti
Summary
The assembly and use of a multimodal microendoscope is described which can co-register superficial tissue image data with tissue physiological parameters including hemoglobin concentration, melanin concentration, and oxygen saturation. This technique can be useful for evaluating tissue structure and perfusion, and can be optimized for individual needs of the investigator.
Abstract
Tecniche Microendoscopy fibra fascio recenti consentono l'analisi non invasiva dei tessuti in vivo, utilizzando sia tecniche di imaging o una combinazione di tecniche di spettroscopia. La combinazione di tecniche di imaging e la spettroscopia in un unico sensore ottico può fornire una più completa analisi di salute del tessuto. In questo articolo, due modalità dissimili sono combinati, immagini ad alta risoluzione di fluorescenza microendoscopy e la spettroscopia di riflettanza diffusa, in un unico sonda ottica. Ad alta risoluzione imaging di fluorescenza microendoscopy è una tecnica utilizzata per visualizzare tessuto apicale micro-architettura e, anche se principalmente una tecnica qualitativa, ha dimostrato differenziazione efficace in tempo reale tra tessuto neoplastico e non neoplastico. spettroscopia di riflettanza diffusa è una tecnica che può estrarre tessuto di parametri fisiologici concentrazione locale di emoglobina, la concentrazione di melanina, e la saturazione di ossigeno. Questo articolo descrive le specifiche r, facoltativo per costruire la sonda a fibre ottiche, come costruire la strumentazione, e quindi dimostra la tecnica su pelle umana in vivo. Questo lavoro ha rivelato che il tessuto micro-architettura, cheratinociti della pelle in particolare apicali, può essere co-registrato con i suoi parametri fisiologici associati. La sonda strumentazione e fibra fascio qui presentata può essere ottimizzato come dispositivo palmare o endoscopicamente compatibile per l'uso in una varietà di sistemi di organi. ricerca clinica supplementare è necessaria per verificare la fattibilità di questa tecnica per i diversi stati di malattia epiteliali.
Introduction
Tecniche Microendoscopy fibra fascio di solito analizzano nel tessuto vivo utilizzando sia tecniche di imaging o una combinazione di tecniche di spettroscopia. 1-3 Una di queste tecniche di imaging ad alta risoluzione di fluorescenza microendoscopy, può immagine del tessuto apicale micro-architettura con una risoluzione sub-cellulare in un piccolo , microscala campo di vista, utilizzando un mezzo di contrasto topico come proflavina, fluoresceina, o inchiostro pyranine. 1,3-11 Questa modalità di imaging ha mostrato promettenti prestazioni cliniche in qualitativamente differenziare tessuto epiteliale malati e sani in tempo reale con basso inter-osservatore variabilità. 8 di tanto in tanto, gli investigatori potranno utilizzare i dati di microscopia a fluorescenza ad alta risoluzione per estrarre le caratteristiche quantitative, come cellule e la dimensione nucleare o l'area della ghiandola, ma questa rimane una tecnica essenzialmente qualitativa mirata verso la visualizzazione morfologia del tessuto. 1,3,8- 10 D'altra parte, tecniche di spettroscopia, talecome spettroscopia di riflettanza diffusa, sono mirati a fornire informazioni tessuti funzionali e hanno mostrato promettenti prestazioni cliniche per identificare quantitativamente lesioni cancerose in più organi. 2,12-15
Pertanto, vi è una necessità di un dispositivo che incorpora entrambi i tipi di modalità per potenzialmente ridurre ulteriormente la variabilità inter-osservatore, mantenere visualizzazione in tempo reale del tessuto micro-architettura e fornire un'analisi più completa di salute del tessuto. Per raggiungere questo obiettivo, uno strumento basato sonda multimodale è stato costruito, che combina due modalità di una sonda singola fibra ottica:. Ad alta risoluzione di fluorescenza microendoscopy e la spettroscopia di riflettanza sub-diffusa 11 Questo metodo co-registri qualitativi immagini ad alta risoluzione di apicale morfologia del tessuto (proprietà strutturali) con informazioni quantitative spettrale (proprietà funzionali) da due profondità dei tessuti distinti tra cui concentrazione di emoglobina locale ([Hb]), la concentrazione di melanina ([Mel]), e la saturazione di ossigeno (SaO2). 11,12,16 Questo specifico sub-diffusa spettroscopia di riflettanza modalità utilizza due separazioni sorgente-detector (SDS) per assaggiare due profondità dei tessuti unici a fornire un quadro più completo della salute dei tessuti campionando fino alla membrana basale e stroma tessuto sottostante. 11
La fibra-sonda comprende a 1 mm di diametro della fibra centrale immagine con elementi circa 50.000 4,5 micron fibre di diametro, un diametro rivestimento di 1,1 mm ed un diametro complessivo di rivestimento di 1,2 mm. La fibra immagine è circondata da cinque 200 micron di diametro fibre con diametro di rivestimento di 220 micron. Ogni fibra 200 micron multimodale si trova una distanza da centro a centro di 864 micron dal centro della fibra dell'immagine. Ciascuno dei 200 micron fibre multimodali sono 25 °. Utilizzando la sinistra 200 micron fibra multimodale come la fibra "source", e l'ulteriore three 200 micron fibre multimodali come le fibre "collection", questa geometria necessariamente crea tre da centro a centro SDS di 374 micron, 730 micron, 1.051 micron e 1.323 micron. Le punte di fibre sono racchiusi in un involucro metallico cilindrico che mantiene le distanze tra fibre costante. Il diametro della carcassa cilindrica metallica è di 3 mm. L'estremità distale (verso la punta della sonda in fibra ottica) della sonda in fibra ottica è lungo 2 piedi. La sonda separa poi nei sei rispettive fibre individuali all'estremità prossimale (verso la strumentazione) che è lungo un ulteriore 2 piedi, per una lunghezza totale di 4 piedi. La Figura 1 mostra una rappresentazione della sonda in fibra ottica.
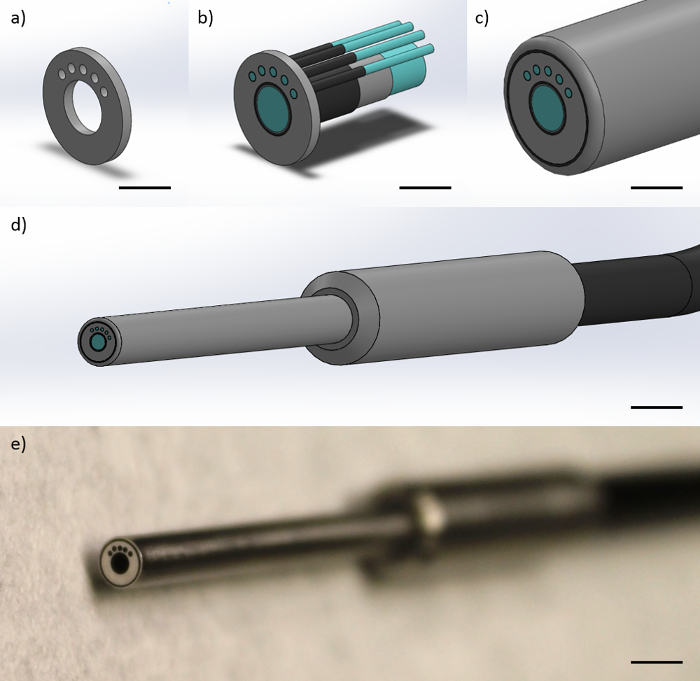
Figura 1:. Il design della sonda a fibre ottiche La sonda in fibra ottica è costituito da un 1 mm di diametro della fibra di immagine e quattro 200 micron fibre multimodali. Questofigura mostra rappresentazioni di (a) il terminale metallico che vincola la geometria delle fibre sulla punta della sonda per produrre SDS di 374, 730 e 1.051 micron rispetto alla sinistra 200 fibre micron multimodale (Scala bar ≈ 1 mm), (b) le fibre essendo vincolato all'interno del tappo di metallo, mostrando i nuclei delle fibre, rivestimento della fibra, e rivestimento in fibra (Scala bar ≈ 1 mm), (c) la poliammide guaina protettiva attorno alle fibre (Scala bar ≈ 1 mm), (d ) la punta distale finale della sonda, con l'impugnatura in metallo e cavo nero unico che contiene tutte le fibre (Scala bar ≈ 4 mm), e (e) un quadro della punta distale della sonda (Scala bar ≈ 4 mm). clicca qui per vedere una versione più grande di questa figura.
Questa strumentazione multimodale e Techni associatiQue è la prima combinazione di queste modalità all'interno di una singola sonda, anche se esistono altre tecniche combinate strutturali / funzionali che combinano diverse modalità. Ad esempio, l'imaging iperspettrale combina immagini a grande campo con emoglobina e melanina proprietà quantitative, 17,18 e altre tecniche sono state sviluppate che uniscono la tomografia a coerenza ottica (OCT) con l'analisi dell'espressione delle proteine dei tessuti, 19 solo per citarne alcuni. Questo articolo riferisce di una configurazione strumentazione compatta e facile da implementare che utilizza una sonda generale fibra ottica che può essere ottimizzato per vari scopi compreso l'uso endoscopico nel tratto gastrointestinale inferiore e dell'esofago o come sonda portatile per l'uso nella cavità orale e il posizionamento della pelle esterna. 11,20
L'hardware di questo strumentazione richiede sia l'acquisizione di dati personalizzati e il codice di post-elaborazione per l'acquisizione diffusa spettri di riflettanza e quindi estrarre il volum risultantetessuto parametri fisiologici e-media, tra cui [Hb], [Mel], e São 2. Il codice di acquisizione dati personalizzati è stato costruito per permettere l'acquisizione simultanea da una telecamera (per alta risoluzione microscopia a fluorescenza) e uno spettrometro (per la spettroscopia di riflettanza diffusa). I driver sono spesso disponibili dai siti web dei produttori per consentire l'integrazione con una varietà di linguaggi di programmazione. Il codice di post-elaborazione personalizzato importa un valori di assorbimento a priori in vivo [Hb] e [Mel] 21 e quindi utilizza un attacco di processo di ottimizzazione non lineare precedentemente sviluppato che crea una curva montato degli spettri. 22 La curva a muro è costruito riducendo al minimo la χ 2 valore tra se stesso e gli spettri crudo e la determinazione dei parametri fisiologici dei tessuti ([Hb], [Mel], e Sao 2) dalla curva arredata e con il più basso χ 2 valore. 22 il codice può essere modificato per includereassorbimento da altri cromofori così, come l'inchiostro pyranine esogeno qui utilizzato, in modo che bersaglio parametri fisiologici sono inalterati.
Indicatori fisiologici di salute dei tessuti, come ad esempio [Hb], [Mel], e São 2, possono essere usati come segnalazioni di risposta del tumore alla terapia o come indicatori di vascolarizzazione locale e l'angiogenesi. 14,23 Compresa una ad alta risoluzione di fluorescenza microendoscopy modalità aiuta il posizionamento della sonda guida e fornisce gli investigatori con un quadro più completo della relazione tra struttura del tessuto epiteliale e la funzione. In questo articolo, la costruzione e l'applicazione del microendoscope multimodale è descritto. 11
Protocol
Representative Results
Discussion
L'imaging ad alta risoluzione multimodale e sub-diffusa microendoscope fibra fascio di spettroscopia di riflettanza riportato qui possono essere ottimizzati e utilizzati dagli investigatori per una varietà di applicazioni, tra cui endoscopica o l'uso palmare per studi umani o animali. Esso fornisce quindi un metodo flessibile per la visualizzazione in vivo apicale del tessuto micro-architettura insieme a misure della concentrazione di emoglobina, la concentrazione di melanina, e la saturazione di…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This material is based on work supported by the National Institutes of Health (1R03-CA182052, 1R15-CA202662), the National Science Foundation Graduate Research Fellowship Program (G.G., DGE-1450079), the Arkansas Biosciences Institute, and the University of Arkansas Doctoral Academy Fellowship. Any opinions, findings, and conclusions or recommendations expressed in this material are those of the authors and do not necessarily reflect the views of the acknowledged funding agencies.
Materials
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs, Inc. | CM1-DCH | |
| 470 nm Dichroic Mirror (Beam Splitter) | Chroma Corporation | T470lpxr | |
| Cage Assembly Rod, 1.5", 4-Pack | Thorlabs, Inc. | ER1.5-P4 | |
| Cage Assembly Rod, 3.0", 4-Pack | Thorlabs, Inc. | ER3-P4 | |
| Cage Assembly Rod, 2.0", 4-Pack | Thorlabs, Inc. | ER2-P4 | |
| SM1-Threaded 30 mm Cage Plate | Thorlabs, Inc. | CP02 | |
| SM1 Series Stress-Free Retaining Ring | Thorlabs, Inc. | SM1PRR | |
| SM1 Lens Tube, 1.00" Thread Depth | Thorlabs, Inc. | SM1L10 | |
| Right-Angle Kinematic Mirror Mount | Thorlabs, Inc. | KCB1 | |
| 1" UV Enhanced Aluminum Mirror | Thorlabs, Inc. | PF10-03-F01 | |
| Z-Axis Translation Mount | Thorlabs, Inc. | SM1Z | |
| 10X Olympus Plan Achromatic Objective | Thorlabs, Inc. | RMS10X | |
| XY Translating Lens Mount | Thorlabs, Inc. | CXY1 | |
| SMA Fiber Adapter Plate with SM1 Thread | Thorlabs, Inc. | SM1SMA | |
| SM1 Lens Tube, 0.50" Thread Depth | Thorlabs, Inc. | SM1L05 | |
| 440/40 Bandpass Filter (Excitation) | Chroma Corporation | ET440/40x | |
| 525/36 Bandpass Filter (Emission) | Chroma Corporation | ET525/36m | |
| Quick Set Epoxy | Loctite | 1395391 | |
| 455 nm LED Light Housing Kit – 3-Watt | LED Supply | ALK-LH-3W-KIT | |
| 1" Achromatic Doublet, f=50mm | Thorlabs, Inc. | AC254-050-A | |
| Flea 3 USB Monochrome Camera | Point Grey, Inc. | FL3-U3-32S2M-CS | |
| 0.5" Post Holder, L = 1.5" | Thorlabs, Inc. | PH1.5 | |
| 0.5" Optical Post, L = 4.0" | Thorlabs, Inc. | TR4 | |
| Mounting Base, 1" x 2.3" x 3/8" | Thorlabs, Inc. | BA1S | |
| Long Lifetime Tungsten-Halogen Light Source (Vis-NIR) | Ocean Optics | HL-2000-LL | |
| 20X Olympus Plan Objective | Edmund Optics, Inc. | PLN20X | |
| Custom-Built Aluminum Motor Arm | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Arm Adaptor | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Housing | N/A | N/A | Custom designed and built |
| Stepper Motor – 400 steps/revolution | SparkFun Electronics | ROB-10846 | Multiple suppliers |
| Custom-Built Aluminum Optical Fiber Switch | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Optical Fiber Switch Face-Plate | N/A | N/A | Custom designed and built |
| Arduino Uno – R3 | SparkFun Electronics | DEV-11021 | Multiple suppliers |
| Electronic Breadboard – Self-Adhesive | SparkFun Electronics | PRT-12002 | Multiple suppliers |
| EasyDriver – Stepper Motor Driver | Sparkfun Electronics | ROB-12779 | |
| 12V, 229 mA Power Supply | Phihong | PSM03A | Multiple suppliers |
| Enhanced Sensitivity USB Spectrometer (Vis-NIR) | Ocean Optics | USB2000+VIS-NIR-ES | |
| 550 µm, 0.22 NA, SMA-SMA Fiber Patch Cable | Thorlabs, Inc. | M37L01 | |
| Custom-Built Fiber-Optic Probe | Myriad Fiber Imaging | N/A | |
| 20% Spectralon Diffuse Reflectance Standard | Labsphere, Inc. | SRS-20-010 | |
| Standard Yellow Highlighter | Sharpie | 25005 | Multiple suppliers, proflavine or fluorescein can be substituted |
References
- Muldoon, T. J., et al. Subcellular-resolution molecular imaging within living tissue by fiber microendoscopy. Opt Express. 15, 16413-16423 (2007).
- Rajaram, N., Reichenberg, J. S., Migden, M. R., Nguyen, T. H., Tunnell, J. W. Pilot clinical study for quantitative spectral diagnosis of non-melanoma skin cancer. Lasers Surg Med. 42, 716-727 (2010).
- Louie, J. S., Richards-Kortum, R., Anandasabapathy, S. Applications and advancements in the use of high-resolution microendoscopy for detection of gastrointestinal neoplasia. Clin Gastroenterol Hepatol. 12, 1789-1792 (2014).
- Chang, S. S., et al. High resolution microendoscopy for classification of colorectal polyps. Endoscopy. 45, 553-559 (2013).
- Muldoon, T. J., et al. Noninvasive imaging of oral neoplasia with a high-resolution fiber-optic microendoscope. Head Neck. 34, 305-312 (2011).
- Muldoon, T. J., et al. Evaluation of quantitative image analysis criteria for the high-resolution microendoscopic detection of neoplasia in Barrett’s esophagus. J Biomed Opt. 15, 026027 (2010).
- Prieto, S. P., Powless, A. J., Boice, J. W., Sharma, S. G., Muldoon, T. J. Proflavine Hemisulfate as a Fluorescent Contrast Agent for Point-of-Care Cytology. PLoS One. 10, e0125598 (2015).
- Parikh, N., et al. In vivo diagnostic accuracy of high resolution microendoscopy in differentiating neoplastic from non-neoplastic colorectal polyps: a prospective study. Am J Gastroenterol. 109, 68-75 (2014).
- Shin, D., et al. Quantitative analysis of high-resolution microendoscopic images for diagnosis of esophageal squamous cell carcinoma. Clin Gastroenterol Hepatol. 13, 272-279 (2015).
- Prieto, S. P., et al. Qualitative and quantitative comparison of colonic microendoscopy image features to histopathology. Proc SPIE Int Soc Opt Eng. 9328, (2015).
- Greening, G. J., et al. Fiber-bundle microendoscopy with sub-diffuse reflectance spectroscopy and intensity mapping for multimodal optical biopsy of stratified epithelium. Biomed Opt Express. 6, 4934-4950 (2015).
- Rajaram, N., Gopal, A., Zhang, X., Tunnell, J. W. Experimental validation of the effects of microvasculature pigment packaging on in vivo diffuse reflectance spectroscopy. Lasers Surg Med. 42, 680-688 (2010).
- Spliethoff, J. W., et al. Monitoring of tumor response to cisplatin using optical spectroscopy. Transl Oncol. 7, 230-239 (2014).
- Chang, V. T., et al. Quantitative physiology of the precancerous cervix in vivo through optical spectroscopy. Neoplasia. 11, 325-332 (2009).
- Yu, B., Shah, A., Nagarajan, V. K., Ferris, D. G. Diffuse reflectance spectroscopy of epithelial tissue with a smart fiber-optic probe. Biomed Opt Express. 5, 675-689 (2014).
- Hennessy, R., Goth, W., Sharma, M., Markey, M. K., Tunnell, J. W. Effect of probe geometry and optical properties on the sampling depth for diffuse reflectance spectroscopy. J Biomedical Opt. 19, 107002 (2014).
- Ghassemi, P., Travis, T. E., Moffatt, L. T., Shupp, J. W., Ramella-Roman, J. C. A polarized multispectral imaging system for quantitative assessment of hypertrophic scars. Biomed Opt Express. 5, 3337-3354 (2014).
- Vasefi, F., et al. Polarization-sensitive hyperspectral imaging in vivo: a multimode dermoscope for skin analysis. Sci Rep. 4, (2014).
- Winkler, A. M., Rice, P. F. S., Drezek, R. A., Barton, J. K. Quantitative tool for rapid disease mapping using optical coherence tomography images of azoxymethane-treated mouse colon. J Biomedl Opt. 15, 041512 (2010).
- Bish, S. F., et al. Handheld Diffuse Reflectance Spectral Imaging (DRSi) for in-vivo characterization of skin. Biomed Opt Express. 5, 573-586 (2014).
- Prahl, S. A. . Optical Absorption of Hemoglobin. , (1999).
- Rajaram, N., et al. Design and validation of a clinical instrument for spectral diagnosis of cutaneous malignancy. Appl Opt. 49, 142-152 (2010).
- Hennessy, R., Markey, M. K., Tunnell, J. W. Impact of one-layer assumption on diffuse reflectance spectroscopy of skin. J Biomed Opt. 20, 27001 (2015).
- Rajaram, N., Nguyen, T. H., Tunnell, J. W. Lookup table-based inverse model for determining optical properties of turbid media. J Biomed Opt. 13, 050501 (2008).
- Nichols, B. S., Rajaram, N., Tunnell, J. W. Performance of a lookup table-based approach for measuring tissue optical properties with diffuse optical spectroscopy. J Biomed Opt. 17, 057001 (2012).
- Greening, G. J., James, H. M., Muldoon, T. J. . Optical Phantoms: Diffuse and Sub-diffuse Imaging and Spectroscopy Validation. , 1-37 (2015).
- Karsten, A. E., Smit, J. E. Modeling and verification of melanin concentration on human skin type. Photochem Photobiol. 88, 469-474 (2012).
- Glennie, D. L., Hayward, J. E., Farrell, T. J. Modeling changes in the hemoglobin concentration of skin with total diffuse reflectance spectroscopy. J Biomed Opt. 20, 035002 (2015).
- Lim, L., Nichols, B., Rajaram, N., Tunnell, J. W. Probe pressure effects on human skin diffuse reflectance and fluorescence spectroscopy measurements. J Biomed Opt. 16, 011012 (2011).

