使用QNsim1.0从电刺激多巴胺神经传递数据建模快速扫描循环伏安数据
Summary
快速扫描循环伏安法可以在药物,疾病和其他实验操作的上下文中监测体内多巴胺神经传递。这项工作描述了QNsim1.0的实现,QNsim1.0是一种根据定量神经生物学模型建模电刺激多巴胺反应的软件,用于量化多巴胺释放和再摄取动力学的估计。
Abstract
中枢多巴胺能(DAergic)途径在广泛的功能(如注意力,动机和运动)中具有重要作用。多巴胺(DA)涉及疾病和病症,包括注意缺陷多动障碍,帕金森病和创伤性脑损伤。因此,DA神经传递及其研究方法具有强烈的科学兴趣。 体内快速扫描循环伏安法(FSCV)是一种允许以精细的时间和空间分辨率选择性地监测DA浓度变化的方法。这种技术通常用于上升DAergic途径的电刺激以控制多巴胺神经传递的脉冲流动。尽管受刺激的DA神经传递范例可以产生具有清晰形态学的强大的DA反应,使其适合于动力学分析,但仍然存在关于如何根据其DA释放和清除来解释反应的许多争论ce组件。为了解决这个问题,最近开发了一种刺激DA神经传递的定量神经生物学(QN)框架,以在刺激的DA反应过程中实时模拟DA释放和再摄取的动力学。该模型的基础是基于来自刺激的DA神经传递的实验数据和来自各种研究线路的神经传递原理。 QN模型实现了与激发的DA释放和再摄取动力学相关的12个参数以模拟DA响应。这项工作描述了如何使用QNsim1.0模拟DA响应,还详细说明了系统地分辨刺激的多巴胺释放和再摄取动力学变化的原理。
Introduction
多巴胺(DA)神经传递在各种认知和行为功能中起重要作用,其功能障碍涉及几种常见的疾病和障碍。因此,开发定量研究体内 DA神经传递的准确方法至关重要,以评估DA神经传递在疾病模型和药物药理学背景下的变化。快速扫描循环伏安法(FSCV)允许在体内 DA神经传递监测,具有良好的空间和时间分辨率。虽然可以监测生理DA神经传递在清醒,自由行动的动物,麻醉动物的上升多巴胺能途径的电刺激可以产生稳定的DA反应,适合DA神经传递的增强的动力学分析。
电刺激的DA响应反映了DA释放和再摄取以及解释的动态相互作用这些反应主要使用被称为Michaelis-Menten(MM)模型12的刺激DA神经传递的简单模型。 MM模型由3个变量组成,根据恒定的DA释放速率和恒定的再摄取效率( 即, DA再摄取速率和细胞外DA浓度之间的关系)来描述DA响应,如等式1所述 : 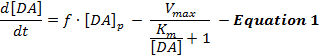
(DA释放)(DA再摄取)
在等式1中, f是刺激的频率; [DA] p是每脉冲刺激的估计的DA浓度增加; V max表示估计的最大再摄取速率;并且K m是估计的MM常数,其在理论上等同于饱和DAT的50%的细胞外DA浓度,导致半最大再摄取速率。这个差异可以通过估计[DA] p ,V max和K m参数来整合等式来模拟实验DA响应。
虽然MM模型有助于在各种实验环境中了解DA神经传递动力学方面的显着进步,但MM模型制作了简单的基本假设,限制了其在超生理刺激引起的DA反应建模时的适用性。例如,如果MM模型以凸起方式上升,则MM模型只能近似DA响应形状,但不能解释在背纹纹区域12中发现的渐进(凹)上升响应。因此,MM模型假设不能准确地捕获受激DA神经传递的动态释放和再摄取过程。
根据现实的量子来模拟受激DA响应基于互补研究和实验的刺激神经传递动力学原理,开发了定量神经生物学(QN)框架。各种神经传递研究表明,(1)刺激的神经递质释放是在刺激过程中速率降低的动态过程14 ,(2)在双相衰变动力学15后的刺激后期释放继续发生,和(3)DA在刺激持续时间2,16期间,再摄取效率逐渐被抑制。这三个概念作为QN框架的基础,三个方程由描述DA释放和再摄取动力学的12个参数组成( 表1 )。 QN框架可以密切模拟异质实验DA响应类型,以及p刺激参数和药物给药的实验操作的改变效果2,6 。虽然进一步的研究是必要的,以完善数据建模方法,未来的实验可以极大地受益于这种神经生物学接地的建模方法,这显着增加了从受刺激的DA神经传递范式中得出的推论。

表1: 建模方程和参数 。 请点击此处查看此图的较大版本。
本教程介绍如何使用QNsim 1.0对受激DA响应数据进行建模以估计DA释放和再摄取动力学。实际实验数据收集这里不描述加工,并且仅需要时间DA浓度数据。 QN框架的理论支持和基础已经在前面已经有很多的描述2 ,但是对应用QN框架来建立DA响应数据的实际观点如下所述。
QN框架模拟动态相互作用:1)动态DA释放,2)DA再摄取; 3)超生理刺激对这些过程的影响,从DA响应数据中提取有意义的动力学信息。 QN框架最适合于使用高持续时间( 例如, 60 Hz,10 s刺激)的高度超生理刺激获取的FSCV数据,其产生适用于动力学分析的强大的DA响应。在对底层释放和再摄取过程进行准确建模之后,可以使用模型参数来模拟DA反应,其应近似于ex感应DA响应。
QN框架的方程式描述了在受刺激的DA反应过程中DA释放和再摄取的速率。当刺激的DA释放速率在刺激过程中指数下降时,QN框架描述了刺激的DA释放速率作为从刺激开始(t 刺激 )开始的时间的函数。这与容易释放的池的耗尽一致,具有补充的稳态DA释放速率(DARss)以解释囊泡补充,类似于其他报告( 等式2 ) 14,17 。
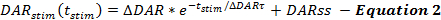
增加DA释放速率的操作,例如增加ΔDAR,ΔDARτ或DARss导致DA与时间图的响应幅度增加。每个参数ter对DA响应形状有差异。增加DARss和ΔDARτ都使得响应的上升阶段更线性(较少凸)。降低ΔDARτ促进凸度,其由ΔDAR的大小控制。基于建模经验,DARss通常小于ΔDAR的1/5;因此,ΔDAR是主要确定DA响应的总体响应幅度的释放参数。
刺激后DA释放速率由等式3建模为刺激结束时刺激的DA释放速率(DAR ES )的延续,作为刺激后(t post )时间的函数。后刺激DA释放速率遵循双相衰变模式,如前所述15 ,具有快速指数衰减期和延长的线性衰变期以模拟两个ca依赖于依赖的神经递质释放过程。
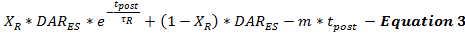
(快速指数衰减)(长时间线性衰减)
目前不可能确定发生多少刺激后DA释放。可以通过系统地最小化刺激后DA释放的估计和跨越从使用不同刺激持续时间的同一记录位点收集的一组实验DA响应来验证模型参数来解决这个限制。这种最小化允许用户对释放和再摄取进行保守的估计。因为电刺激导致促进刺激后神经递质释放的钙积聚,刺激的持续时间影响后刺激神经元垃圾释放参数18,19 。基于建模经验,发现随着刺激持续时间的增加,τR增加,X R降低,与更大的钙积累的预期效果相一致20 。
方程4描述了作为MM框架的扩展的DA再摄取速率并且包含动态K m项,其在刺激期间增加以模拟由超生理刺激2,16引起的逐渐降低的再摄取效率。刺激结束后K m保持恒定在K m值(K mES )。
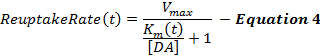
哪里,
<img alt =“等式6”src =“/ files / ftp_upload / 55595 / 55595eq6.jpg”/>
(刺激期间)(刺激后)
刺激的DA反应,特别是从腹侧纹状体区域,往往对初始K m值(K mi )的变化不敏感,这使得定义K mi值有问题。因此,像原始的MM框架一样,从对照未处理的动物12收集的DA反应,K mi近似为0.1-0.4μM。 ΔK m项决定了刺激过程中再摄取效率变化的程度,从我们的经验来看,约为2081; M在60Hz,10s刺激过程中。 k和K minf值确定K m随着时间的推移而改变,并且增加这些项中的任一个可以促进上升阶段的凹陷。 V max是部分与局部DA转运体密度相关的最大再摄取速率,其表现出腹外侧至背侧梯度21 。因此,背侧纹状体(D-Str)中的V max值通常大于30μM / s,但通常在腹侧区域(如伏核(NAc) 6 ))小于30μM / s。
上述一般准则可以帮助建模实验DA响应数据,但是生成近似实验DA响应的仿真需要迭代地调整模型参数。可以通过获得提供的超生理刺激的DA响应来改善模型参数的准确性一个强大的基板用于模拟,以及通过获得和建模多个DA响应来刺激在相同记录位置( 例如, 60Hz,5s和10s的刺激)的不同持续时间以验证参数的准确性(参见样本数据)。为了证明,在已经使用QN框架建模的药理学挑战之前和之后,在包含在伏隔核和背纹纹状体中收集的区域特异性刺激的DA应答的软件包中包含数据集。通过扩展,用户将发现这种方法可以类似地应用于表征DA神经传递在各种疾病背景和药理学操作中的动力学。
Protocol
Representative Results
Discussion
使用FSCV研究体内刺激的DA神经传递起源于20世纪80年代30 ,仍然是具有无与伦比的空间和时间分辨率的体内神经传递数据的丰富来源。受刺激的DA响应反映了由电刺激本身调制的DA释放和再摄取的复杂平衡。 QN模型结合了来自当代神经传递研究的原理,在动态释放和再摄取假设方面对体内刺激的DA神经传递数据进行建模。此外,QN框架将可能的FSCV分析范围…
Disclosures
The authors have nothing to disclose.
Acknowledgements
我们承认UPMC康复研究所支持这项工作。
Materials
| MATLAB R2016a for Mac | Mathworks | ||
| QNsim1.0 | In house software package | Software to model FSCV data using the QN framework |
References
- Taylor, I. M., et al. Kinetic diversity of dopamine transmission in the dorsal striatum. J Neurochem. 133 (4), 522-531 (2015).
- Harun, R., Grassi, C. M., Munoz, M. J., Torres, G. E., Wagner, A. K. Neurobiological model of stimulated dopamine neurotransmission to interpret fast-scan cyclic voltammetry data. Brain Res. 1599, 67-84 (2015).
- Taylor, I. M., Jaquins-Gerstl, A., Sesack, S. R., Michael, A. C. Domain-dependent effects of DAT inhibition in the rat dorsal striatum. Journal of neurochemistry. 122 (2), 283-294 (2012).
- Garris, P. A., Ciolkowski, E. L., Wightman, R. M. Heterogeneity of evoked dopamine overflow within the striatal and striatoamygdaloid regions. Neuroscience. 59 (2), 417-427 (1994).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain Res. 487 (2), 311-320 (1989).
- Harun, R., et al. Fast-scan cyclic voltammetry demonstrates that L-DOPA produces dose-dependent regionally selective, bimodal effects on striatal dopamine kinetics in vivo. J Neurochem. , (2015).
- Jones, S. R., Garris, P. A., Wightman, R. M. Different effects of cocaine and nomifensine on dopamine uptake in the caudate-putamen and nucleus accumbens. The Journal of pharmacology and experimental therapeutics. 274 (1), 396-403 (1995).
- Budygin, E. A., John, C. E., Mateo, Y., Jones, S. R. Lack of cocaine effect on dopamine clearance in the core and shell of the nucleus accumbens of dopamine transporter knock-out mice. J Neurosci. 22 (10), RC222 (2002).
- Jones, S. R., et al. Loss of autoreceptor functions in mice lacking the dopamine transporter. Nat Neurosci. 2 (7), 649-655 (1999).
- Wagner, A. K., et al. Chronic methylphenidate treatment enhances striatal dopamine neurotransmission after experimental traumatic brain injury. J Neurochem. 108 (4), 986-997 (2009).
- Wagner, A. K., et al. Controlled cortical impact injury influences methylphenidate-induced changes in striatal dopamine neurotransmission. J Neurochem. 110 (3), 801-810 (2009).
- Wightman, R. M., et al. Real-time characterization of dopamine overflow and uptake in the rat striatum. Neuroscience. 25 (2), 513-523 (1988).
- Moquin, K. F., Michael, A. C. Tonic autoinhibition contributes to the heterogeneity of evoked dopamine release in the rat striatum. J Neurochem. 110 (5), 1491-1501 (2009).
- Pyott, S. J., Rosenmund, C. The effects of temperature on vesicular supply and release in autaptic cultures of rat and mouse hippocampal neurons. J Physiol. 539 (Pt 2), 523-535 (2002).
- Atluri, P. P., Regehr, W. G. Delayed release of neurotransmitter from cerebellar granule cells. J Neurosci. 18 (20), 8214-8227 (1998).
- Wang, S. R., et al. Role of vesicle pools in action potential pattern-dependent dopamine overflow in rat striatum in vivo. J Neurochem. 119 (2), 342-353 (2011).
- Taschenberger, H., von Gersdorff, H. Fine-tuning an auditory synapse for speed and fidelity: developmental changes in presynaptic waveform, EPSC kinetics, and synaptic plasticity. J Neurosci. 20 (24), 9162-9173 (2000).
- Goda, Y., Stevens, C. F. Two components of transmitter release at a central synapse. Proc Nat Acad of Sci U S A. 91 (26), 12942-12946 (1994).
- Yao, J., Gaffaney, J. D., Kwon, S. E., Chapman, E. R. Doc2 is a Ca2+ sensor required for asynchronous neurotransmitter release. Cell. 147 (3), 666-677 (2011).
- Hagler, D. J., Goda, Y. Properties of synchronous and asynchronous release during pulse train depression in cultured hippocampal neurons. J Neurophysiol. 85 (6), 2324-2334 (2001).
- Ciliax, B. J., et al. The dopamine transporter: immunochemical characterization and localization in brain. J Neurosci. 15 (3 Pt 1), 1714-1723 (1995).
- Volz, T. J., Farnsworth, S. J., Rowley, S. D., Hanson, G. R., Fleckenstein, A. E. Methylphenidate-induced increases in vesicular dopamine sequestration and dopamine release in the striatum: the role of muscarinic and dopamine D2 receptors. J Pharm Exp Ther. 327 (1), 161-167 (2008).
- Dresel, S. H., Kung, M. P., Plossl, K., Meegalla, S. K., Kung, H. F. Pharmacological effects of dopaminergic drugs on in vivo binding of [99mTc]TRODAT-1 to the central dopamine transporters in rats. Eur J Nucl Med. 25 (1), 31-39 (1998).
- Near, J. A., Bigelow, J. C., Wightman, R. M. Comparison of uptake of dopamine in rat striatal chopped tissue and synaptosomes. J Pharm Exp Ther. 245 (3), 921-927 (1988).
- Michael, A. C., Ikeda, M., Justice, J. B. Dynamics of the recovery of releasable dopamine following electrical stimulation of the medial forebrain bundle. Neurosci Lett. 76 (1), 81-86 (1987).
- Fierro, L., DiPolo, R., Llano, I. Intracellular calcium clearance in Purkinje cell somata from rat cerebellar slices. The Journal of physiology. 510 (Pt 2), 499-512 (1998).
- Sandoval, V., Riddle, E. L., Hanson, G. R., Fleckenstein, A. E. Methylphenidate redistributes vesicular monoamine transporter-2: role of dopamine receptors. J Neurosci. 22 (19), 8705-8710 (2002).
- Daws, L. C., et al. Cocaine increases dopamine uptake and cell surface expression of dopamine transporters. Biochem Biophys Res Commun. 290 (5), 1545-1550 (2002).
- Little, K. Y., Kirkman, J. A., Carroll, F. I., Clark, T. B., Duncan, G. E. Cocaine use increases [3H]WIN 35428 binding sites in human striatum. Brain Res. 628 (1-2), 17-25 (1993).
- Ewing, A. G., Bigelow, J. C., Wightman, R. M. Direct in vivo monitoring of dopamine released from two striatal compartments in the rat. Science. 221 (4606), 169-171 (1983).
- Janezic, S., et al. Deficits in dopaminergic transmission precede neuron loss and dysfunction in a new Parkinson model. Proc Natl Acad Sci U S A. 110 (42), E4016-E4025 (2013).
- Macdonald, P. A., Monchi, O. Differential effects of dopaminergic therapies on dorsal and ventral striatum in Parkinson’s disease: implications for cognitive function. Parkinsons Dis. 2011, 572743 (2011).
- Kile, B. M., et al. Optimizing the Temporal Resolution of Fast-Scan Cyclic Voltammetry. ACS Chem Neurosci. 3 (4), 285-292 (2012).
- Venton, B. J., Troyer, K. P., Wightman, R. M. Response times of carbon fiber microelectrodes to dynamic changes in catecholamine concentration. Anal Chem. 74 (3), 539-546 (2002).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain research. 487 (2), 311-320 (1989).
- Wu, Q., Reith, M. E., Wightman, R. M., Kawagoe, K. T., Garris, P. A. Determination of release and uptake parameters from electrically evoked dopamine dynamics measured by real-time voltammetry. J Neurosci Methods. 112 (2), 119-133 (2001).

