Моделирование данных циклической вольтамперометрии с быстрым сканированием данных электроиммированных дофаминовых нейротрансмиссионных данных с использованием QNsim1.0
Summary
Быстрая сканирующая циклическая вольтамперометрия может контролировать нейропередачу дофамина in vivo в контексте лекарств, болезней и других экспериментальных манипуляций. В этой работе описывается реализация QNsim1.0, программного обеспечения для моделирования электростимулированных ответов дофамина в соответствии с количественной нейробиологической моделью для количественной оценки оценок высвобождения дофамина и обратного захвата.
Abstract
Центральные дофаминергические (DAergic) пути играют важную роль в широком спектре функций, таких как внимание, мотивация и движение. Допамин (DA) участвует в заболеваниях и расстройствах, включая расстройство гиперактивности дефицита внимания, болезнь Паркинсона и травматическую травму головного мозга. Таким образом, нейропередача DA и методы ее изучения представляют значительный научный интерес. Циклическая вольтамперометрия с быстрым сканированием in vivo (FSCV) представляет собой метод, который позволяет выборочно контролировать изменения концентрации DA с точным временным и пространственным разрешением. Этот метод обычно используется в сочетании с электрическими стимуляциями восходящих DAergic путей для контроля импульсного потока нейротрансмиссии допамина. Хотя стимулированная парадигма нейропередачи DA может давать надежные ответы ДА с ясной морфологией, что делает их поддающимися кинетическому анализу, все еще много дискуссий о том, как интерпретировать ответы с точки зрения их выпуска DA и clearanКомпонентов. Чтобы решить эту проблему, недавно была разработана количественная нейробиологическая (QN) структура стимулированной нейротрансмиссии DA, чтобы реально моделировать динамику высвобождения DA и повторного поглощения в течение стимулированного ответа DA. Основы этой модели основаны на экспериментальных данных о стимулированной нейротрансмиссии DA и принципах нейротрансмиссии, принятых из различных направлений исследований. Модель QN реализует 12 параметров, связанных с стимулированной динамикой DA и динамикой обратного захвата, для моделирования ответов DA. В этой работе описывается, как имитировать ответы DA с использованием QNsim1.0, а также подробные принципы, которые были реализованы для систематического распознавания изменений в стимулированной динамике высвобождения дофамина и обратного захвата.
Introduction
Дорамин (DA) нейропередача играет существенную роль в различных когнитивных и поведенческих функциях, а ее дисфункция связана с несколькими распространенными заболеваниями и расстройствами. Таким образом, крайне важно разработать точные методы количественного изучения нейротрансмиссии DA in vivo для оценки изменения нейротрансмиссии DA в контексте моделей болезни и фармакологии лекарственных препаратов. Быстрая сканирование циклической вольтамперометрии (FSCV) позволяет осуществлять мониторинг in vivo DA нейротрансмиссии с точным пространственным и временным разрешением. В то время как можно наблюдать физиологическую DA нейротрансмиссию у бодрствующих, свободно ведящих животных, электрическая стимуляция восходящих допаминергических путей у анестезированных животных может приводить к устойчивым ответам ДА, которые поддаются усиленному кинетическому анализу нейротрансмиссии DA.
Электрически стимулированные ответы DA отражают динамическое взаимодействие высвобождения и повторного поглощения DA и интерпретацииИз этих ответов преимущественно использовалась простая модель стимулированной нейротрансмиссии DA, называемая моделью Михаэлиса-Ментена (MM) 12 . Модель ММ состоит из 3 переменных для описания ответов DA в терминах постоянной скорости высвобождения DA и постоянной эффективности обратного захвата ( т. Е. Соотношения между частотой обратного захвата DA и внеклеточными DA-концентрациями), как описано в уравнении 1 : 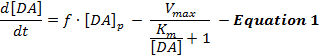
(Выпуск DA) (повторный захват DA)
В уравнении 1 f – частота стимуляции; [DA] p – расчетное увеличение концентрации ДА на импульс стимуляции; V max представляет оценочную максимальную скорость обратного захвата; И K m – оценочная константа ММ, которая теоретически эквивалентна внеклеточной концентрации DA, которая насыщает 50% DAT, что приводит к полумаксимальному коэффициенту обратного захвата. Это отличаетсяAl можно интегрировать для моделирования экспериментальных DA-ответов путем оценки параметров [DA] p , V max и K m .
Хотя модель ММ способствовала значительным достижениям в понимании кинетики нейротрансмиссии DA в различных экспериментальных условиях, модель ММ делает упрощенные фундаментальные предположения, которые ограничивают ее применимость при моделировании ответов ДА, вызванных супрафизиологическими стимуляциями 2 , 13 . Например, модель ММ может только приближать формы ответа ДА, если они растут выпуклым образом, но она не может учитывать постепенные (вогнутые) нарастающие ответы, обнаруженные в дорзальных полосатых областях 12 . Таким образом, предположения модели ММ не точно фиксируют процессы динамического высвобождения и обратного захвата стимулированной нейротрансмиссии DA.
Моделировать стимулированные ответы ДА в соответствии с реалистичным квантом(QN) была разработана на основе принципов стимулированной кинетики нейротрансмиссии, полученных из дополнительных исследований и экспериментов 2 . Различные линии исследований нейротрансмиссии показывают, что (1) стимулированное высвобождение нейротрансмиттера является динамическим процессом, который снижает скорость в течение стимуляции 14 , (2) высвобождение продолжается в фазе после стимуляции с кинетикой бифазного распада 15 и (3) DA Эффективность обратного захвата постепенно ингибируется во время самой стимуляции 2 , 16 . Эти три концепции служат основой структуры QN и трех уравнений, состоящих из 12 параметров, описывающих динамику высвобождения DA и обратного захвата ( таблица 1 ). Структура QN может моделировать гетерогенные экспериментальные типы ответов DA, а также pВыведенные эффекты экспериментальных манипуляций с параметрами стимуляции и введением лекарственного средства 2 , 6 . Хотя дальнейшие исследования необходимы для уточнения подхода к моделированию данных, будущие эксперименты могут в значительной степени выиграть от этого нейробиологически обоснованного подхода к моделированию, что значительно добавляет к выводам, сделанным из стимулированной парадигмы нейротрансмиссии DA.

Таблица 1: Моделирование уравнений и параметров . Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В этом учебном пособии описывается, как моделировать стимулированные данные ответа DA для оценки кинетики высвобождения DA и кинетики обратного захвата с использованием QNsim 1.0. Фактический сбор экспериментальных данных и пр.Обработка здесь не описывается и требует только временных данных о концентрации DA. Теоретическая поддержка и основы структуры QN были подробно описаны ранее 2 , но ниже описана практическая перспектива применения структуры QN для моделирования данных ответа DA.
Структура QN моделирует динамическое взаимодействие между: 1) динамическим выпуском DA, 2) обратным захватом DA и 3) эффектами супрафизиологических стимулов на эти процессы для извлечения значимой кинетической информации из данных ответа DA. Структура QN лучше всего подходит для моделирования данных FSCV, полученных с использованием высоко супрафизиологических стимуляций длительной продолжительности ( например, стимуляции 60 Гц, 10 с), которые создают надежные ответы ДА, которые поддаются анализу на кинетику. После точного моделирования основных процессов выпуска и обратного захвата параметры модели могут использоваться для имитации ответа DA, который должен аппроксимировать форму exЭкспериментальный ответ DA.
Уравнения структуры QN описывают скорости высвобождения DA и повторного поглощения в течение стимулированных ответов DA. Структура QN описывает стимулированную скорость высвобождения DA как функцию времени от начала стимуляции (t-стимул), когда скорость высвобождения DA экспоненциально уменьшается в течение стимуляции. Это согласуется с истощением легко освобождаемого пула с добавленной стабильной скоростью высвобождения DA (DARss) для учета пополнения везикул, как и другие отчеты (уравнение 2 ) 14 , 17 .
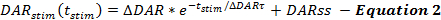
Манипуляции, которые увеличивают скорость высвобождения DA, такие как увеличение ΔDAR, Δ DAR τ или DARss, приводят к увеличению амплитуд ответов на DA по сравнению с временными графиками. Каждый параметрTer вносит дифференциальный характер в формы ответа DA. Увеличение DARss и Δ DAR τ приводит к тому, что нарастающая фаза ответов более линейна (менее выпуклая). Уменьшение Δ DAR τ способствует выпуклости, которая контролируется величиной Δ DAR. Основываясь на опыте моделирования, DARss обычно составляет менее 1/5 Δ ΔDAR; Таким образом, Δ DAR является параметром высвобождения, который в основном определяет общую амплитуду отклика ответа DA.
Скорость высвобождения DA после стимуляции моделируется уравнением 3 в качестве продолжения стимулированной скорости высвобождения DA от конца стимуляции (DAR ES ) в зависимости от времени после стимуляции (t post ). Скорость высвобождения DA после стимуляции следует за двухфазной картиной распада, как описано выше 15 , с быстрой фазой экспоненциального затухания и продолжительной фазой линейного распада для моделирования двух caLcium-зависимых процессов высвобождения нейротрансмиттеров.
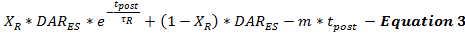
(Быстрое экспоненциальное распад) (Длительный линейный распад)
В настоящее время невозможно определить, сколько возникает пост-стимуляция DA. Это ограничение может быть устранено путем систематического минимизации оценок высвобождения DA после стимуляции и проверки параметров модели по набору экспериментальных ответов ДА, собранных с одного и того же сайта записи, с использованием различных продолжительности стимуляции. Эта минимизация позволяет пользователям делать консервативные оценки выпуска и обратного захвата. Поскольку электрические стимуляции приводят к накоплению кальция, который стимулирует высвобождение нейротрансмиттера после стимуляции, продолжительность стимуляции влияет на постстимулятивные нейротрантыПараметры выхода миттера 18 , 19 . Основываясь на опыте моделирования, было обнаружено, что по мере увеличения продолжительности стимуляции τ R увеличивается, а X R уменьшается, что согласуется с ожидаемым эффектом более высокого накопления кальция 20 .
Уравнение 4 описывает коэффициент обратного захвата DA как расширение каркаса ММ и включает динамический член K m , который увеличивается во время стимуляции, чтобы моделировать постепенно уменьшающуюся эффективность обратного захвата, вызванную супрафизиологическими стимуляциями 2 , 16 . K m после стимуляции поддерживается постоянным при значении K m в конце стимуляции (K mES ).
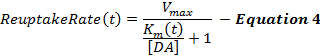
где,
<img alT = "Уравнение 6" src = "/ files / ftp_upload / 55595 / 55595eq6.jpg" />
(Во время стимуляции) (после стимуляции)
Стимулированные ответы ДА, особенно из брюшных полосатых областей, часто нечувствительны к изменениям начального значения K m (K mi ), что делает определение K mi значением проблематичным. Таким образом, как и исходная структура ММ, K mi приближается к 0,1-0,4 мкМ для ответов DA, полученных от контрольных необработанных животных 12 . Термин Δ K m определяет степень изменения эффективности повторного поглощения во время стимуляции, которая по нашему опыту составляет около 2081; M в течение 60-Гц, 10-секундной стимуляции. Значения k и K minf определяют, как K m изменяется с течением времени, и увеличение любого из этих условий способствует вогнутости фазы роста. V max представляет собой максимальную скорость обратного захвата, которая частично относится к локальной плотности транспортера DA, которая проявляет вентромедиальный дорсолатеральный градиент 21 . Соответственно, значения V max в дорсальной полосатой (D-Str) обычно больше 30 мкМ / с, но обычно менее 30 мкМ / с в брюшных областях, таких как ядро accumbens (NAc) 6 .
Общие руководящие принципы, приведенные выше, могут помочь в моделировании экспериментальных данных отклика DA, но генерация моделирования, которая приближается к экспериментальному ответу DA, требует итеративной корректировки параметров модели. Точность параметров модели может быть улучшена путем получения ответов ДА на супрафизиологические стимуляции, которые обеспечиваютEa надежную подложку для моделирования, а также путем получения и моделирования множественных ответов DA на стимуляции различной продолжительности на одном и том же участке записи ( например, стимуляции 60 Гц, 5 и 10 сек) для проверки точности параметров ( См. Примеры данных). Чтобы продемонстрировать, набор данных включен в пакет программного обеспечения, содержащий региоспецифические стимулированные ответы DA, собранные в ядре accumbens и дорсальном полосатом, до и после фармакологической проблемы, которая уже смоделирована с использованием структуры QN. В дополнение, пользователи найдут, что эта методология может быть аналогично применена для характеристики кинетики нейротрансмиссии DA в различных контекстах заболевания и фармакологических манипуляциях.
Protocol
Representative Results
Discussion
Использование FSCV для изучения in vivo стимулированной нейротрансмиссии DA возникло в 1980-х годах 30 и по-прежнему остается богатым источником данных о нейропередаче in vivo с беспрецедентным пространственным и временным разрешением. Стимулированные ответы DA отражают сл…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы признаем Институт реабилитации УПМК за поддержку этой работы.
Materials
| MATLAB R2016a for Mac | Mathworks | ||
| QNsim1.0 | In house software package | Software to model FSCV data using the QN framework |
References
- Taylor, I. M., et al. Kinetic diversity of dopamine transmission in the dorsal striatum. J Neurochem. 133 (4), 522-531 (2015).
- Harun, R., Grassi, C. M., Munoz, M. J., Torres, G. E., Wagner, A. K. Neurobiological model of stimulated dopamine neurotransmission to interpret fast-scan cyclic voltammetry data. Brain Res. 1599, 67-84 (2015).
- Taylor, I. M., Jaquins-Gerstl, A., Sesack, S. R., Michael, A. C. Domain-dependent effects of DAT inhibition in the rat dorsal striatum. Journal of neurochemistry. 122 (2), 283-294 (2012).
- Garris, P. A., Ciolkowski, E. L., Wightman, R. M. Heterogeneity of evoked dopamine overflow within the striatal and striatoamygdaloid regions. Neuroscience. 59 (2), 417-427 (1994).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain Res. 487 (2), 311-320 (1989).
- Harun, R., et al. Fast-scan cyclic voltammetry demonstrates that L-DOPA produces dose-dependent regionally selective, bimodal effects on striatal dopamine kinetics in vivo. J Neurochem. , (2015).
- Jones, S. R., Garris, P. A., Wightman, R. M. Different effects of cocaine and nomifensine on dopamine uptake in the caudate-putamen and nucleus accumbens. The Journal of pharmacology and experimental therapeutics. 274 (1), 396-403 (1995).
- Budygin, E. A., John, C. E., Mateo, Y., Jones, S. R. Lack of cocaine effect on dopamine clearance in the core and shell of the nucleus accumbens of dopamine transporter knock-out mice. J Neurosci. 22 (10), RC222 (2002).
- Jones, S. R., et al. Loss of autoreceptor functions in mice lacking the dopamine transporter. Nat Neurosci. 2 (7), 649-655 (1999).
- Wagner, A. K., et al. Chronic methylphenidate treatment enhances striatal dopamine neurotransmission after experimental traumatic brain injury. J Neurochem. 108 (4), 986-997 (2009).
- Wagner, A. K., et al. Controlled cortical impact injury influences methylphenidate-induced changes in striatal dopamine neurotransmission. J Neurochem. 110 (3), 801-810 (2009).
- Wightman, R. M., et al. Real-time characterization of dopamine overflow and uptake in the rat striatum. Neuroscience. 25 (2), 513-523 (1988).
- Moquin, K. F., Michael, A. C. Tonic autoinhibition contributes to the heterogeneity of evoked dopamine release in the rat striatum. J Neurochem. 110 (5), 1491-1501 (2009).
- Pyott, S. J., Rosenmund, C. The effects of temperature on vesicular supply and release in autaptic cultures of rat and mouse hippocampal neurons. J Physiol. 539 (Pt 2), 523-535 (2002).
- Atluri, P. P., Regehr, W. G. Delayed release of neurotransmitter from cerebellar granule cells. J Neurosci. 18 (20), 8214-8227 (1998).
- Wang, S. R., et al. Role of vesicle pools in action potential pattern-dependent dopamine overflow in rat striatum in vivo. J Neurochem. 119 (2), 342-353 (2011).
- Taschenberger, H., von Gersdorff, H. Fine-tuning an auditory synapse for speed and fidelity: developmental changes in presynaptic waveform, EPSC kinetics, and synaptic plasticity. J Neurosci. 20 (24), 9162-9173 (2000).
- Goda, Y., Stevens, C. F. Two components of transmitter release at a central synapse. Proc Nat Acad of Sci U S A. 91 (26), 12942-12946 (1994).
- Yao, J., Gaffaney, J. D., Kwon, S. E., Chapman, E. R. Doc2 is a Ca2+ sensor required for asynchronous neurotransmitter release. Cell. 147 (3), 666-677 (2011).
- Hagler, D. J., Goda, Y. Properties of synchronous and asynchronous release during pulse train depression in cultured hippocampal neurons. J Neurophysiol. 85 (6), 2324-2334 (2001).
- Ciliax, B. J., et al. The dopamine transporter: immunochemical characterization and localization in brain. J Neurosci. 15 (3 Pt 1), 1714-1723 (1995).
- Volz, T. J., Farnsworth, S. J., Rowley, S. D., Hanson, G. R., Fleckenstein, A. E. Methylphenidate-induced increases in vesicular dopamine sequestration and dopamine release in the striatum: the role of muscarinic and dopamine D2 receptors. J Pharm Exp Ther. 327 (1), 161-167 (2008).
- Dresel, S. H., Kung, M. P., Plossl, K., Meegalla, S. K., Kung, H. F. Pharmacological effects of dopaminergic drugs on in vivo binding of [99mTc]TRODAT-1 to the central dopamine transporters in rats. Eur J Nucl Med. 25 (1), 31-39 (1998).
- Near, J. A., Bigelow, J. C., Wightman, R. M. Comparison of uptake of dopamine in rat striatal chopped tissue and synaptosomes. J Pharm Exp Ther. 245 (3), 921-927 (1988).
- Michael, A. C., Ikeda, M., Justice, J. B. Dynamics of the recovery of releasable dopamine following electrical stimulation of the medial forebrain bundle. Neurosci Lett. 76 (1), 81-86 (1987).
- Fierro, L., DiPolo, R., Llano, I. Intracellular calcium clearance in Purkinje cell somata from rat cerebellar slices. The Journal of physiology. 510 (Pt 2), 499-512 (1998).
- Sandoval, V., Riddle, E. L., Hanson, G. R., Fleckenstein, A. E. Methylphenidate redistributes vesicular monoamine transporter-2: role of dopamine receptors. J Neurosci. 22 (19), 8705-8710 (2002).
- Daws, L. C., et al. Cocaine increases dopamine uptake and cell surface expression of dopamine transporters. Biochem Biophys Res Commun. 290 (5), 1545-1550 (2002).
- Little, K. Y., Kirkman, J. A., Carroll, F. I., Clark, T. B., Duncan, G. E. Cocaine use increases [3H]WIN 35428 binding sites in human striatum. Brain Res. 628 (1-2), 17-25 (1993).
- Ewing, A. G., Bigelow, J. C., Wightman, R. M. Direct in vivo monitoring of dopamine released from two striatal compartments in the rat. Science. 221 (4606), 169-171 (1983).
- Janezic, S., et al. Deficits in dopaminergic transmission precede neuron loss and dysfunction in a new Parkinson model. Proc Natl Acad Sci U S A. 110 (42), E4016-E4025 (2013).
- Macdonald, P. A., Monchi, O. Differential effects of dopaminergic therapies on dorsal and ventral striatum in Parkinson’s disease: implications for cognitive function. Parkinsons Dis. 2011, 572743 (2011).
- Kile, B. M., et al. Optimizing the Temporal Resolution of Fast-Scan Cyclic Voltammetry. ACS Chem Neurosci. 3 (4), 285-292 (2012).
- Venton, B. J., Troyer, K. P., Wightman, R. M. Response times of carbon fiber microelectrodes to dynamic changes in catecholamine concentration. Anal Chem. 74 (3), 539-546 (2002).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain research. 487 (2), 311-320 (1989).
- Wu, Q., Reith, M. E., Wightman, R. M., Kawagoe, K. T., Garris, P. A. Determination of release and uptake parameters from electrically evoked dopamine dynamics measured by real-time voltammetry. J Neurosci Methods. 112 (2), 119-133 (2001).

