QNsim1.0を用いた電気刺激されたドーパミン神経伝達データからの高速スキャンサイクリックボルタンメトリーデータのモデリング
Summary
ファーストスキャンサイクリックボルタンメトリーは、薬剤、疾患、および他の実験的操作の文脈におけるインビボドーパミン神経伝達をモニターすることができる。この研究は、定量的な神経生物学的モデルに従って電気刺激されたドーパミン応答をモデリングしてドーパミン放出および再取り込み動態の推定を定量化するためのソフトウェアであるQNsim1.0の実施について記載している。
Abstract
中枢ドーパミン作動性(DAergic)経路は、注目、動機付け、および運動などの広範な機能において重要な役割を果たす。ドーパミン(DA)は、注意欠陥多動性障害、パーキンソン病および外傷性脳損傷を含む疾患および障害に関与している。したがって、DA神経伝達およびそれを研究する方法は、強い科学的興味の対象である。 インビボファストスキャンサイクリックボルタンメトリー(FSCV)は、細かい時間および空間分解能でDA濃度の変化を選択的にモニタリングする方法である。この技術は、ドーパミン神経伝達のインパルス流を制御するためにDAergic経路を上昇させる電気刺激と併せて一般に使用される。刺激されたDA神経伝達パラダイムは、明確な形態を有する堅牢なDA応答を生成することができるが、それらを運動分析に適したものにすることができるが、DA放出およびクリアランCEコンポーネント。この懸念に対処するために、刺激されたDA応答の過程にわたってDA放出および再取り込みの動態を現実的にモデル化するために、刺激されたDA神経伝達の定量的神経生物学(QN)枠組みが最近開発された。このモデルの基礎は、刺激されたDA神経伝達からの実験データ、および様々な研究から採択された神経伝達の原理に基づいている。 QNモデルは、DA応答をモデル化するために、刺激されたDA放出および再取り込み動態に関連する12のパラメータを実装する。この作業は、QNsim1.0を使用してDA反応をシミュレートする方法と、刺激されたドーパミン放出および再取り込み動態の変化を体系的に識別するために実施された詳細な原理を説明しています。
Introduction
ドーパミン(DA)神経伝達は、様々な認知機能および行動機能において必須の役割を果たし、その機能不全は、いくつかの一般的な疾患および障害に関与している。このように、疾患モデルおよび薬物薬理の状況においてDA神経伝達がどのように変化するかを評価するために、in vivoで DA神経伝達を定量的に研究する正確な方法を開発することが重要である。ファーストスキャンサイクリックボルタンメトリー(FSCV)は、細かい空間的および時間的分解能で生体内 DA神経伝達をモニターすることを可能にする。覚醒した動物において自由に行動する動物において生理学的DA神経伝達をモニタリングすることは可能であるが、麻酔動物において上昇するドーパミン作動性経路の電気刺激は、DA神経伝達の強化された動態分析に敏感な頑強なDA応答を生成し得る。
電気刺激されたDA応答は、DA放出および再取り込みの動的相互作用、ならびに解釈は、Michaelis-Menten(MM)モデル12と呼ばれる刺激されたDA神経伝達の単純なモデルを主に使用しています。 MMモデルは、式1によって記述されるように、一定のDA放出速度および一定の再取り込み効率( すなわち、 DA再取り込み速度と細胞外DA濃度との間の関係)に関してDA応答を表す3つの変数からなる: 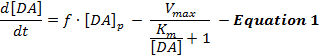
(DA放出)(DA再取り込み)
式1において、 fは刺激の頻度であり、 [DA] pは、刺激パルス1回当たりのDA濃度の推定増加量であり、 V maxは推定最大再吸収率を表す。 K mは理論的にはDATの50%を飽和させる細胞外DA濃度と等価である推定MM定数であり、最大再吸収率の半分に達する。このdifferential方程式は、[DA] p 、V max 、およびK mパラメータを推定することによって、実験的DA応答をシミュレートするために統合することができる。
MMモデルは、超生理学的刺激によって誘発されたDA反応をモデリングする際の適用性を制限する単純な基本的仮定を作成する(2,13)。例えば、MMモデルは、それらが凸状に上昇する場合にのみDA応答形状に近似することができるが、背側線条領域12に見られる緩やかな(凹状の)上昇応答を説明することはできない12 。したがって、MMモデルの仮定は、刺激されたDA神経伝達の動的放出および再取り込みプロセスを正確に捕捉しない。
現実的な量に従って刺激されたDA応答をモデル化する(QN)フレームワークは、相補的な研究および実験2から誘導された刺激された神経伝達動態の原理に基づいて開発された。神経伝達研究の様々なラインは、(1)刺激された神経伝達物質の放出が、刺激14の過程で速度が減少する動的過程であること、(2)二相性崩壊動態15で刺激後段階で放出が継続すること、再吸収効率は、刺激自体の持続期間中、徐々に阻害される。これらの3つの概念はQNフレームワークの基礎となり、3つの方程式はDA放出と再取り込みのダイナミクスを記述する12のパラメータで構成されています( 表1 )。 QNフレームワークは、異種の実験的なDA応答タイプとp刺激パラメータおよび薬物投与の実験操作の改善された効果2,6。データモデリングアプローチを改良するためにさらなる研究が必要であるが、将来の実験は、刺激されたDA神経伝達パラダイムから引き出される推論に有意に追加するこの生物学的に基礎をなすモデリングアプローチから大きく利益を得ることができる。

表1: 方程式とパラメータのモデリング この図の拡大版を見るには、ここをクリックしてください。
このチュートリアルでは、QNsim 1.0を使用して刺激されたDA応答データをモデリングしてDA放出を推定し、動態を再取り込みする方法について説明します。実際の実験データ収集とPRここでは説明を省略し、一時的なDA濃度データのみを必要とする。 QNフレームワークの理論的なサポートと基礎は以前に広範に記述されているが、QNフレームワークをDA応答データのモデル化に適用する実践的な観点を以下に説明する。
QNフレームワークは、DA応答データから有意義な運動情報を抽出するために、1)動的DA放出、2)DA再取り込み、および3)超生理学的刺激のこれらのプロセスに対する効果をモデル化する。 QNフレームワークは、長期間( 例えば、 60Hz、10秒の刺激)の高度超生理学的刺激を用いて得られたFSCVデータをモデル化するのに最適であり、動態分析に適した頑強なDA応答を生成する。基礎となる放出および再取り込みプロセスの正確なモデル化に続いて、モデルパラメータを使用して、exの形状に近似するべきDA応答をシミュレートすることができる懐疑的なDA反応。
QNフレームワークの方程式は、刺激されたDA反応の過程におけるDA放出および再取り込みの速度を記述する。 QNフレームワークは、DA放出速度が刺激の過程で指数関数的に減少するとき、刺激開始時(t stim )からの時間の関数としての刺激DA放出速度を記載する。これは、他の報告( 式2 ) 14,17と同様に、小胞の補充を説明する定常状態のDA放出速度(DARss)を加えた、容易に放出可能なプールの枯渇と一致する。
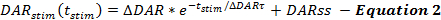
ΔDAR、ΔDARτ、またはDARssを増加させるなど、DA放出率を増加させる操作は、DA対時間プロットの応答振幅を増加させる。各パラメterはDA応答の形状に差異をもたらします。 DARssとΔDARτの両方を増加させると、応答の立ち上がり位相がより線形に(より凸に)なる。 ΔDARτを減少させると、ΔDARの大きさによって制御される凸性が促進される。モデリングの経験に基づいて、DARssは一般的にΔDARの1/5未満です。したがって、ΔDARは、主にDA応答の全体応答振幅を決定する放出パラメータである。
刺激後DA放出速度は、刺激後の時間(t post )の関数としての刺激終了(DAR ES )からの刺激DA放出速度の継続として、 式3によってモデル化される。刺激後のDA放出速度は、先に記載したように、急速な指数減衰期および2つのモデルをモデル化するための長時間の線形減衰期を伴う、二相減衰パターンに従うlucium-dependent neurotransmitter release processes)が挙げられる。
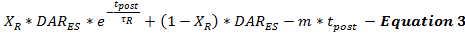
(急激な指数関数的減衰)(長時間の線形減衰)
刺激後のDA放出がどのくらい起こるかを決定することは現時点では不可能である。この制限は、刺激後のDA放出の推定値を体系的に最小化し、変化する刺激期間を使用して同じ記録サイトから収集された一連の実験的DA応答にわたってモデルパラメータを検証することによって対処することができる。この最小化により、ユーザは放出および再吸収の推定値を控えめにすることができる。電気刺激は、刺激後の神経伝達物質の放出を促進するカルシウム蓄積をもたらすので、刺激の持続時間は、刺激後の神経伝達に影響を及ぼすミッター放出パラメータ18,19 。モデル化の経験に基づいて、刺激持続時間が増加すると、より大きなカルシウム蓄積20の予想される効果と一致して、τRが増加し、X Rが減少することが見出された。
式4は、MM骨格の延長としてのDA再取り込み速度を記述し、超生理学的刺激によって引き起こされる徐々に減少する再取り込み効率をモデル化するために刺激中に増加する動的K m項を組み込む。刺激後のK mは 、刺激終了時のK m値で一定に保持される(K mES )。
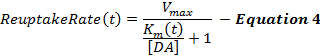
ここで、
<img alt = "数式6" src = "/ files / ftp_upload / 55595 / 55595eq6.jpg" />
(刺激中)(刺激後)
刺激されたDA応答、特に腹側線条体領域からの応答は、初期K m値(K i mi )の変化に敏感でないことが多く、K mi値を問題とする。したがって、元のMMフレームワークと同様に、対照未処理動物12から採取したDA応答について、Ki miは0.1〜0.4μMで近似される。 ΔK m項は、刺激中の再吸収効率の変化の程度を決定し、我々の経験からは約2081; 60Hz、10秒間の刺激の間、Mを刺激する。 kおよびK minf値は、K mが経時的にどのように変化するかを決定し、これらの項のいずれかを増加させると、上昇段階の凹面が促進される。 V maxは、局所的DA輸送体密度に部分的に関係する最大再取り込み速度であり、背側勾配から腹側勾配21を示す 。したがって、背側線条(D-Str)におけるV max値は、側坐核(NAc) 6のように、腹側領域では一般に30μM/ sより大きいが、一般に30μM/ s未満である。
上記の一般的なガイドラインは、実験的なDA応答データをモデル化するのに役立ちますが、実験的なDA応答に近似するシミュレーションを生成するには、モデルパラメータを繰り返し調整する必要があります。モデルパラメータの精度は、超生理学的刺激に対するDA応答を得ることによって改善することができる( 例えば、 60Hz、5秒および10秒の刺激)で変動する持続時間の刺激に対する複数のDA応答を取得しモデリングすることによって、パラメータの精度を検証することができるサンプルデータを参照してください)。 QNフレームワークを使用して既にモデル化された薬理学的攻撃の前後に、側坐核および背側線条に収集された位置特異的刺激DA応答を含むソフトウェアパッケージに含まれるデータセットを示す。この方法論は、種々の疾患状況および薬理学的操作におけるDA神経伝達の動態を特徴付けるために同様に適用することができる。
Protocol
Representative Results
Discussion
インビボで刺激されたDA神経伝達を研究するためのFSCVの使用は、1980年代に始まり、依然として比類のない空間的および時間的分解能を有する生体内の神経伝達データの豊富な供給源であり続けている。刺激されたDA応答は、電気刺激それ自体によって変調されるDA放出および再取り込みの複雑なバランスを反映する。 QNモデルは、現代の神経伝達研究の原理を、生体内…
Disclosures
The authors have nothing to disclose.
Acknowledgements
我々はこの作業を支援するUPMCリハビリテーション研究所を認めている。
Materials
| MATLAB R2016a for Mac | Mathworks | ||
| QNsim1.0 | In house software package | Software to model FSCV data using the QN framework |
References
- Taylor, I. M., et al. Kinetic diversity of dopamine transmission in the dorsal striatum. J Neurochem. 133 (4), 522-531 (2015).
- Harun, R., Grassi, C. M., Munoz, M. J., Torres, G. E., Wagner, A. K. Neurobiological model of stimulated dopamine neurotransmission to interpret fast-scan cyclic voltammetry data. Brain Res. 1599, 67-84 (2015).
- Taylor, I. M., Jaquins-Gerstl, A., Sesack, S. R., Michael, A. C. Domain-dependent effects of DAT inhibition in the rat dorsal striatum. Journal of neurochemistry. 122 (2), 283-294 (2012).
- Garris, P. A., Ciolkowski, E. L., Wightman, R. M. Heterogeneity of evoked dopamine overflow within the striatal and striatoamygdaloid regions. Neuroscience. 59 (2), 417-427 (1994).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain Res. 487 (2), 311-320 (1989).
- Harun, R., et al. Fast-scan cyclic voltammetry demonstrates that L-DOPA produces dose-dependent regionally selective, bimodal effects on striatal dopamine kinetics in vivo. J Neurochem. , (2015).
- Jones, S. R., Garris, P. A., Wightman, R. M. Different effects of cocaine and nomifensine on dopamine uptake in the caudate-putamen and nucleus accumbens. The Journal of pharmacology and experimental therapeutics. 274 (1), 396-403 (1995).
- Budygin, E. A., John, C. E., Mateo, Y., Jones, S. R. Lack of cocaine effect on dopamine clearance in the core and shell of the nucleus accumbens of dopamine transporter knock-out mice. J Neurosci. 22 (10), RC222 (2002).
- Jones, S. R., et al. Loss of autoreceptor functions in mice lacking the dopamine transporter. Nat Neurosci. 2 (7), 649-655 (1999).
- Wagner, A. K., et al. Chronic methylphenidate treatment enhances striatal dopamine neurotransmission after experimental traumatic brain injury. J Neurochem. 108 (4), 986-997 (2009).
- Wagner, A. K., et al. Controlled cortical impact injury influences methylphenidate-induced changes in striatal dopamine neurotransmission. J Neurochem. 110 (3), 801-810 (2009).
- Wightman, R. M., et al. Real-time characterization of dopamine overflow and uptake in the rat striatum. Neuroscience. 25 (2), 513-523 (1988).
- Moquin, K. F., Michael, A. C. Tonic autoinhibition contributes to the heterogeneity of evoked dopamine release in the rat striatum. J Neurochem. 110 (5), 1491-1501 (2009).
- Pyott, S. J., Rosenmund, C. The effects of temperature on vesicular supply and release in autaptic cultures of rat and mouse hippocampal neurons. J Physiol. 539 (Pt 2), 523-535 (2002).
- Atluri, P. P., Regehr, W. G. Delayed release of neurotransmitter from cerebellar granule cells. J Neurosci. 18 (20), 8214-8227 (1998).
- Wang, S. R., et al. Role of vesicle pools in action potential pattern-dependent dopamine overflow in rat striatum in vivo. J Neurochem. 119 (2), 342-353 (2011).
- Taschenberger, H., von Gersdorff, H. Fine-tuning an auditory synapse for speed and fidelity: developmental changes in presynaptic waveform, EPSC kinetics, and synaptic plasticity. J Neurosci. 20 (24), 9162-9173 (2000).
- Goda, Y., Stevens, C. F. Two components of transmitter release at a central synapse. Proc Nat Acad of Sci U S A. 91 (26), 12942-12946 (1994).
- Yao, J., Gaffaney, J. D., Kwon, S. E., Chapman, E. R. Doc2 is a Ca2+ sensor required for asynchronous neurotransmitter release. Cell. 147 (3), 666-677 (2011).
- Hagler, D. J., Goda, Y. Properties of synchronous and asynchronous release during pulse train depression in cultured hippocampal neurons. J Neurophysiol. 85 (6), 2324-2334 (2001).
- Ciliax, B. J., et al. The dopamine transporter: immunochemical characterization and localization in brain. J Neurosci. 15 (3 Pt 1), 1714-1723 (1995).
- Volz, T. J., Farnsworth, S. J., Rowley, S. D., Hanson, G. R., Fleckenstein, A. E. Methylphenidate-induced increases in vesicular dopamine sequestration and dopamine release in the striatum: the role of muscarinic and dopamine D2 receptors. J Pharm Exp Ther. 327 (1), 161-167 (2008).
- Dresel, S. H., Kung, M. P., Plossl, K., Meegalla, S. K., Kung, H. F. Pharmacological effects of dopaminergic drugs on in vivo binding of [99mTc]TRODAT-1 to the central dopamine transporters in rats. Eur J Nucl Med. 25 (1), 31-39 (1998).
- Near, J. A., Bigelow, J. C., Wightman, R. M. Comparison of uptake of dopamine in rat striatal chopped tissue and synaptosomes. J Pharm Exp Ther. 245 (3), 921-927 (1988).
- Michael, A. C., Ikeda, M., Justice, J. B. Dynamics of the recovery of releasable dopamine following electrical stimulation of the medial forebrain bundle. Neurosci Lett. 76 (1), 81-86 (1987).
- Fierro, L., DiPolo, R., Llano, I. Intracellular calcium clearance in Purkinje cell somata from rat cerebellar slices. The Journal of physiology. 510 (Pt 2), 499-512 (1998).
- Sandoval, V., Riddle, E. L., Hanson, G. R., Fleckenstein, A. E. Methylphenidate redistributes vesicular monoamine transporter-2: role of dopamine receptors. J Neurosci. 22 (19), 8705-8710 (2002).
- Daws, L. C., et al. Cocaine increases dopamine uptake and cell surface expression of dopamine transporters. Biochem Biophys Res Commun. 290 (5), 1545-1550 (2002).
- Little, K. Y., Kirkman, J. A., Carroll, F. I., Clark, T. B., Duncan, G. E. Cocaine use increases [3H]WIN 35428 binding sites in human striatum. Brain Res. 628 (1-2), 17-25 (1993).
- Ewing, A. G., Bigelow, J. C., Wightman, R. M. Direct in vivo monitoring of dopamine released from two striatal compartments in the rat. Science. 221 (4606), 169-171 (1983).
- Janezic, S., et al. Deficits in dopaminergic transmission precede neuron loss and dysfunction in a new Parkinson model. Proc Natl Acad Sci U S A. 110 (42), E4016-E4025 (2013).
- Macdonald, P. A., Monchi, O. Differential effects of dopaminergic therapies on dorsal and ventral striatum in Parkinson’s disease: implications for cognitive function. Parkinsons Dis. 2011, 572743 (2011).
- Kile, B. M., et al. Optimizing the Temporal Resolution of Fast-Scan Cyclic Voltammetry. ACS Chem Neurosci. 3 (4), 285-292 (2012).
- Venton, B. J., Troyer, K. P., Wightman, R. M. Response times of carbon fiber microelectrodes to dynamic changes in catecholamine concentration. Anal Chem. 74 (3), 539-546 (2002).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain research. 487 (2), 311-320 (1989).
- Wu, Q., Reith, M. E., Wightman, R. M., Kawagoe, K. T., Garris, P. A. Determination of release and uptake parameters from electrically evoked dopamine dynamics measured by real-time voltammetry. J Neurosci Methods. 112 (2), 119-133 (2001).

