דוגמנות מהירה סריקה מחזורית Voltammetry נתונים מ חשמלית חשמלית דופמין ניטור נתונים באמצעות QNsim1.0
Summary
במהירות voltammetry מחזורית לסרוק יכול לפקח על וירו דופאמין נוירוטרנסמינציה בהקשר של סמים, מחלות, מניפולציות ניסיוניות אחרות. עבודה זו מתארת את יישום QNsim1.0, תוכנה לעיצוב תגובות דופמין מגורה חשמלית על פי המודל הנוירוביולוגי כמותי לכמת הערכות של שחרור דופאמין ודינמיקה reuptake.
Abstract
לדופאמינרג'יק (דרגי) מסלולים יש תפקיד חשוב במגוון רחב של פונקציות, כגון תשומת לב, מוטיבציה ותנועה. Dopamine (DA) מעורב במחלות והפרעות, כולל הפרעות קשב וריכוז, מחלת פרקינסון ופגיעה מוחית טראומטית. לפיכך, ד.ע.י. נוירוטרנסמינציה ושיטות ללמוד את זה הם עניין מדעי אינטנסיבי. ב vivo במהירות סריקה voltammetry מחזורית (FSCV) היא שיטה המאפשרת סלקטיבי ניטור שינויים ריכוז DA עם רזולוציה טמפורלית ומרחבית בסדר. טכניקה זו משמשת בדרך כלל יחד עם גירויים חשמליים של מסלולים דרגיים עולה לשלוט על זרימת דחף של דופאמין נוירוטרנסמינציה. למרות שפרדיגמת ההעברה הנוירוטרנסמיטית של ד"א יכולה לייצר תגובות ד"א חזקות עם מורפולוגיות ברורות, מה שהופך אותן לאמינות לניתוח קינטי, עדיין יש ויכוח רב על איך לפרש את התגובות במונחים של שחרור DA שלהם ו clearanרכיבי CE. כדי לענות על חשש זה, מסגרת נוירוביולוגית (QN) כמותית של נוירוטרנסמינציה DA מופעלת פותחה לאחרונה כדי ליצור מודל מציאותי של הדינמיקה של שחרור התרופה המחודשת והתחדשות במהלך תגובה מגרה של ה- DA. היסודות של מודל זה מבוססים על נתונים ניסיוניים של תדר נוי משופר של ד.ע. ועקרונות נוירוטרנסמיזציה שאומצו מקווים שונים של מחקר. מודל QN מיישמת 12 פרמטרים הקשורים שחרור משחרר DA ו reuptake דינמיקה לדגם תגובות DA. עבודה זו מתארת כיצד לדמות תשובות DA באמצעות QNsim1.0 וכן פירוט העקרונות שיושמו כדי להבחין בשינויים באופן שיטתי בהוצאת הדופאמין הממריצה ובדינמיקה של החזרת הקליטה מחדש.
Introduction
דופאמין (ד"א) נוירוטרנסמינציה ממלא תפקיד חיוני תפקודים קוגניטיביים והתנהגותיים שונים, ואת תפקוד לקוי שלה מעורב בכמה מחלות נפוצות והפרעות. ככזה, חשוב לפתח שיטות מדויקות של למידה כמותית של נוירוטרנסמינציה DA ב vivo כדי להעריך כיצד משפיעה עצבי DA על הקשרים של מודלים של מחלות פרמקולוגיה סמים. סריקה מהירה voltammetry מחזורית (FSCV) מאפשר ניטור ב neivotransmission vivo DA עם רזולוציה מרחבית וטמפורלית בסדר. אמנם ניתן לעקוב אחר עצבי התערבות פיזיולוגית DA ער, מתנהג בחופשיות בעלי חיים, גירוי חשמלי של מסלולים דופאמינרגליים עולה בחיות הרדים יכול לייצר תגובות DA חזקים כי הם מקובלים על ניתוח קינטי משופרת של נוירוטרנסמינציה DA.
תגובות DA מעוררות חשמלית משקפות יחסי גומלין דינמיים בין שחרור התובע המחודש לבין החזרתו מחדש, ופרשנויותמהתגובות הללו השתמשו בעיקר במודל פשוט של נוירוטרנסמינציה של התובע המחוזי המכונן הנקרא מודל מיכאליס-מנטן (MM). מודל MM מורכב משלושה משתנים כדי לתאר תגובות DA במונחים של קצב שחרור קבוע של DA ועלייה חוזרת של יעילות חוזרת ( כלומר, היחס בין שיעור ההחזרה של התובע המחוזי לבין ריכוז התאים החוץ-תאיים), כפי שמתואר במשוואה 1 : 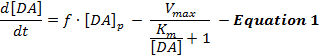
(שחרור DA) (Reauptake DA)
במשוואה 1, f הוא תדירות הגירוי; [DA] p הוא אומדן התוספת D DA לכל פעימה של גירוי; V מקס מייצג את שיעור החזרת הקצב המרבי המשוער; ו K מ ' הוא קבוע משוער MM, אשר שווה מבחינה תיאורטית ריכוז DA חוץ תאי רוויה 50% של DAT, המוביל לשיעור reuptake חצי מקסימלית. זה שונהניתן לשלב משוואה אל כדי לדמות תגובות DA ניסיוניות על ידי אמידת הפרמטרים [DA], V max , ו- K m .
למרות מודל MM יש להקל התקדמות משמעותית בהבנה של קינטיקה נוירוטרנסמינציה בקונטקסט ניסיוני שונים, מודל MM עושה הנחות היסוד פשטנית להגביל את תחולתו כאשר דוגמנות תגובות DA התעוררה על ידי גירויים supropysiological 2 , 13 . לדוגמה, מודל MM יכול רק להשוות צורות תגובה DA אם הם עולים בצורה קמורה, אבל זה לא יכול להסביר את התגובות הדרגתיות (קעור) עולה התגלו באזורים סטריאטליים הגב 12 . לפיכך, ההנחות מודל MM לא ללכוד במדויק את שחרור דינמי ותהליכים reuptake של נוירוטרנסמינציה DA מופעלת.
כדי לדמות תגובות DA מגורה על פי כמות ריאליסטיתItative מסגרת, נוירוביולוגי (QN) מסגרת כמותית פותחה על בסיס עקרונות של קינטיקה נוירוטרנסמינציה מגורה הנגזר מחקר משלים ניסויים 2 . קווים שונים של מחקר נוירוטרנסמיטי מראים כי (1) שחרור נוירוטרנסמיטור מגרה הוא תהליך דינמי כי יורד בקצב במהלך גירוי 14 , (2) שחרור ממשיך בשלב שלאחר גירוי עם קינטיקה biphasic ריקבון 15 , ו (3) DA יעילות reuptake הוא מעוכב בהדרגה במהלך משך הגירוי עצמו 2 , 16 . שלושה מושגים אלה משמשים בסיס של מסגרת QN, ואת שלוש משוואות המורכבת של 12 פרמטרים המתארים את הדינמיקה של שחרור DA ו reuptake ( טבלה 1 ). במסגרת QN ניתן לדמות מקרוב הטרוגניות ניסיוני DA סוגי התגובה, כמו גם את pההשפעות של מניפולציות ניסיוניות של פרמטרים גירוי וניהול סמים 2 , 6 . למרות שמחקרים נוספים נחוצים כדי לחדד את גישת מודלים הנתונים, ניסויים עתידיים יכולים להפיק תועלת רבה מן גישה זו מודלים נוירוביולוגית מעוגנת, אשר מוסיף באופן משמעותי את ההמלצות שנלקחו הפרדיגמה נוירוטרנסמינציה מעוררת DA.

טבלה 1: משוואות דוגמנות ופרמטרים . אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
הדרכה זו מתארת כיצד המודל מגורה נתונים בתגובה DA כדי להעריך שחרור DA ו קינטיקה reuptake באמצעות QNsim 1.0. אוסף נתונים ניסיוניים בפועל PROcessing אינו מתואר כאן ורק דורש נתונים ריכוז DA זמני. התמיכה התיאורטית ואת היסודות של מסגרת QN תוארו בהרחבה בעבר 2 , אבל פרספקטיבה מעשית על החלת מסגרת QN מודל נתוני התגובה DA מתואר להלן.
מסגרת QN מודלים אינטראקציה דינמית בין: 1) שחרור DA דינמי, 2) Reauptake DA, ו 3) את ההשפעות של גירויים supropysiological על תהליכים אלה כדי לחלץ מידע קינטי משמעותי נתונים התגובה DA. מסגרת QN היא המתאימה ביותר עבור מודלים FSCV נתונים שנרכשו באמצעות גירויים supropysiological מאוד של משך זמן ארוך ( למשל, 60 הרץ, 10 גירויים), אשר מייצרים תגובות DA חזקים כי הם ניתנים לניתוח קינטי. בעקבות הדגימה המדויקת של תהליכי השחרור והתהליכים הבסיסיים, ניתן להשתמש בפרמטרים של המודל כדי לדמות תגובת DA שתשווה את הצורה של האקסתגובת התובע המחוזי.
המשוואות של מסגרת QN לתאר את שיעורי שחרור DA ו reuptake במהלך תגובות מגרה DA. מסגרת QN מתאר את שיעור שחרור התובע המחוזי מגורה כפונקציה של זמן מתחילת גירוי (לא גירוי), כאשר שיעור שחרור DA גדל באופן אקספוננציאלי במהלך הגירוי. זה עולה בקנה אחד עם הידלדלות של הבריכה reasily לשחרור, עם תוספת קבועה המדינה DA שיעור שחרור (DARss) כדי להסביר את חידוש שלפוחית, בדומה לדו"חות אחרים ( משוואה 2 ) 14 , 17 .
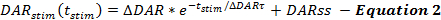
מניפולציות המגדילות את קצב שחרור התובע המחוזי, כגון הגדלת Δ DAR, Δ DAR τ , או DARss, מובילות להגדלת תגובה בתגובה לתמ"ג לעומת חלקות זמן. כל פרמהטר תורם באופן דיפרנציאלי לצורות תגובה של DA. הגדלת DARss ו Δ DAR τ גם להפוך את השלב עולה של תגובות ליניארי יותר (פחות קמורה). הקטנת Δ DAR τ מקדמת את הקימור, הנשלט על ידי גודל Δ DAR. בהתבסס על ניסיון הדוגמנות, DARss הוא בדרך כלל פחות מ 1/5 th של Δ DAR; לכן, Δ DAR הוא פרמטר השחרור הקובע בעיקר את משרעת התגובה הכוללת של תגובת DA.
שיעור ההתרעה לאחר שחרור ה- DA הוא המודל של משוואה 3 כהמשכה של קצב שחרור ה- DA המומרץ מסוף הגירוי (DAR ES ) כפונקציה של זמן לאחר הגירוי (t post ). שיעור ההפרשה לאחר הדעיכה של התרופה עוקב אחר דפוס ריקבון ביפאסי, כפי שתואר לעיל, עם שלב ריקבון מעריכי מהיר ושלב דעיכה ליניארי ממושך,נתרן תלויי נוירוטרנסמיטר תהליכים.
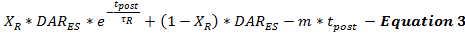
(ריקבון מעריכי מהיר) (ריקבון ליניארי ממושך)
בשלב זה לא ניתן לקבוע עד כמה מתרחש מחזה DA שלאחר הגירוי. מגבלה זו יכולה להיות מטופלת על ידי שיטתי מזעור הערכות שלאחר גירוי DA שחרור ו אימות פרמטרים מודל על פני קבוצה של תגובות DA ניסיוני שנאספו מאותו אתר הקלטה באמצעות משתנים גירוי משתנים. מזעור זה מאפשר למשתמשים לבצע הערכות שמרניות של שחרור ו reuptake. בגלל גירויים חשמליים להוביל הצטברות סידן המקדם שלאחר שחרור נוירוטרנסמיטר, משך הגירוי משפיע על שלאחר נוירוטרנס גירויהפרמטרים שחרור Mitter 18 , 19 . בהתבסס על חוויית הדגימה, נמצא כי ככל שמגדילה את משך הגירוי, τ R עולה ו- X R פוחתת, בהתאם להשפעות הצפויות של הצטברות סידן גדולה יותר 20 .
משוואה 4 מתארת את שיעור ההחזרה מחדש של ה- DA כהארכה של מסגרת ה- MM ומשלבת מונח דינמי של K m , אשר מגביר במהלך הגירוי לדגם ירידה הדרגתית ביעילות החזרת החמצן הנגרמת על ידי גירויים סופראפיזיולוגיים 2 , 16 . K מ לאחר גירוי מוחזק קבוע בערך K מ בסוף גירוי (K mES).
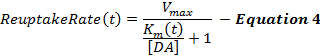
איפה,
<img alT = "משוואה 6" src = "/ files / ftp_upload / 55595 / 55595eq6.jpg" />
(במהלך גירוי) (לאחר גירוי)
תגובות DA מעוררות, במיוחד באזורים סטריליים בגחון, הם לעתים קרובות לא רגישים לשינויים בערך הראשוני K (K mi ), מה שהופך הגדרת ערך K mi בעייתי. לכן, כמו מסגרת MM המקורי, K K הוא בקירוב ב 0.1-0.4 מיקרומטר M עבור תגובות DA שנאספו מבעלי חיים שאינם מטופלים 12 . המונח Δ K מ ' קובע את מידת החידוש ביעילות שינוי במהלך גירוי, אשר מניסיוננו הוא כ 20Jon M במשך 60-הרץ, 10-s גירוי. ערכי K ו- K minf קובעים כיצד שינויים ב- K m משתנים עם הזמן, והגדלת אחד מהמונחים האלה מקדמת את קיומו של השלב העולה. מקס V הוא שיעור החזרת הקיבול המקסימלי המתייחס בחלקו לצפיפות הטרנספורמטור המקומי, אשר מציג וירומדיאליות לשיפוע dorsolateral 21 . לפיכך, ערכי V מקסימום בסטריאטום הגבי (D-Str) בדרך כלל גבוהים מ -30 μ M / s אך בדרך כלל פחות מ -30 מיקרומטר M / s באזורים הגחון, כמו הגרעין accumbens (NAc) 6 .
ההנחיות הכלליות לעיל יכולות לסייע במידול נתונים ניסיוניים של תשובות DA, אך יצירת סימולציה הקרובה לתגובת DA התנסית דורשת התאמת פרמטרים של מודל. הדיוק של הפרמטרים מודל ניתן לשפר על ידי קבלת תגובות DA כדי גירויים supropysiological כי provEA מצע חזק עבור סימולציה, כמו גם על ידי קבלת ודוגמאות מרובה תשובות DA לגירויים משתנים משתנים באותו אתר ההקלטה ( למשל, 60-Hz, 5-s ו 10- s גירויים) כדי לאמת את הדיוק של הפרמטרים ( ראה נתוני המדגם). כדי להדגים, מערך נתונים כלול בחבילת התוכנה המכילה תגובות דגימות מגרות של regiospecific שנאספו בגרעין האקומבנס ובסטריאטום הגבי, לפני ואחרי אתגר פרמקולוגי שכבר נבנה באמצעות מסגרת QN. בנוסף, משתמשים ימצאו כי מתודולוגיה זו יכולה להיות מיושמת באופן דומה על מנת לאפיין את הקינטיקה של נוירוטרנסמינציה DA בהקשר של מחלות שונות ומניפולציות פרמקולוגיות.
Protocol
Representative Results
Discussion
השימוש ב- FSCV כדי ללמוד ב- vivo מגרה את ההעברה הנוירונלית של ה- DA שמקורו בשנות השמונים 30 ועדיין ממשיך להיות מקור עשיר לנתוני ההעברה העצביים של vivo עם רזולוציה מרחבית וזמנית שאין דומה לה. תגובות DA מעוררות משקפות איזון מורכב של שחרור DA וחזרתו מחדש, המאו…
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מכירים במכון השיקום של UPMC לתמיכה בעבודה זו.
Materials
| MATLAB R2016a for Mac | Mathworks | ||
| QNsim1.0 | In house software package | Software to model FSCV data using the QN framework |
References
- Taylor, I. M., et al. Kinetic diversity of dopamine transmission in the dorsal striatum. J Neurochem. 133 (4), 522-531 (2015).
- Harun, R., Grassi, C. M., Munoz, M. J., Torres, G. E., Wagner, A. K. Neurobiological model of stimulated dopamine neurotransmission to interpret fast-scan cyclic voltammetry data. Brain Res. 1599, 67-84 (2015).
- Taylor, I. M., Jaquins-Gerstl, A., Sesack, S. R., Michael, A. C. Domain-dependent effects of DAT inhibition in the rat dorsal striatum. Journal of neurochemistry. 122 (2), 283-294 (2012).
- Garris, P. A., Ciolkowski, E. L., Wightman, R. M. Heterogeneity of evoked dopamine overflow within the striatal and striatoamygdaloid regions. Neuroscience. 59 (2), 417-427 (1994).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain Res. 487 (2), 311-320 (1989).
- Harun, R., et al. Fast-scan cyclic voltammetry demonstrates that L-DOPA produces dose-dependent regionally selective, bimodal effects on striatal dopamine kinetics in vivo. J Neurochem. , (2015).
- Jones, S. R., Garris, P. A., Wightman, R. M. Different effects of cocaine and nomifensine on dopamine uptake in the caudate-putamen and nucleus accumbens. The Journal of pharmacology and experimental therapeutics. 274 (1), 396-403 (1995).
- Budygin, E. A., John, C. E., Mateo, Y., Jones, S. R. Lack of cocaine effect on dopamine clearance in the core and shell of the nucleus accumbens of dopamine transporter knock-out mice. J Neurosci. 22 (10), RC222 (2002).
- Jones, S. R., et al. Loss of autoreceptor functions in mice lacking the dopamine transporter. Nat Neurosci. 2 (7), 649-655 (1999).
- Wagner, A. K., et al. Chronic methylphenidate treatment enhances striatal dopamine neurotransmission after experimental traumatic brain injury. J Neurochem. 108 (4), 986-997 (2009).
- Wagner, A. K., et al. Controlled cortical impact injury influences methylphenidate-induced changes in striatal dopamine neurotransmission. J Neurochem. 110 (3), 801-810 (2009).
- Wightman, R. M., et al. Real-time characterization of dopamine overflow and uptake in the rat striatum. Neuroscience. 25 (2), 513-523 (1988).
- Moquin, K. F., Michael, A. C. Tonic autoinhibition contributes to the heterogeneity of evoked dopamine release in the rat striatum. J Neurochem. 110 (5), 1491-1501 (2009).
- Pyott, S. J., Rosenmund, C. The effects of temperature on vesicular supply and release in autaptic cultures of rat and mouse hippocampal neurons. J Physiol. 539 (Pt 2), 523-535 (2002).
- Atluri, P. P., Regehr, W. G. Delayed release of neurotransmitter from cerebellar granule cells. J Neurosci. 18 (20), 8214-8227 (1998).
- Wang, S. R., et al. Role of vesicle pools in action potential pattern-dependent dopamine overflow in rat striatum in vivo. J Neurochem. 119 (2), 342-353 (2011).
- Taschenberger, H., von Gersdorff, H. Fine-tuning an auditory synapse for speed and fidelity: developmental changes in presynaptic waveform, EPSC kinetics, and synaptic plasticity. J Neurosci. 20 (24), 9162-9173 (2000).
- Goda, Y., Stevens, C. F. Two components of transmitter release at a central synapse. Proc Nat Acad of Sci U S A. 91 (26), 12942-12946 (1994).
- Yao, J., Gaffaney, J. D., Kwon, S. E., Chapman, E. R. Doc2 is a Ca2+ sensor required for asynchronous neurotransmitter release. Cell. 147 (3), 666-677 (2011).
- Hagler, D. J., Goda, Y. Properties of synchronous and asynchronous release during pulse train depression in cultured hippocampal neurons. J Neurophysiol. 85 (6), 2324-2334 (2001).
- Ciliax, B. J., et al. The dopamine transporter: immunochemical characterization and localization in brain. J Neurosci. 15 (3 Pt 1), 1714-1723 (1995).
- Volz, T. J., Farnsworth, S. J., Rowley, S. D., Hanson, G. R., Fleckenstein, A. E. Methylphenidate-induced increases in vesicular dopamine sequestration and dopamine release in the striatum: the role of muscarinic and dopamine D2 receptors. J Pharm Exp Ther. 327 (1), 161-167 (2008).
- Dresel, S. H., Kung, M. P., Plossl, K., Meegalla, S. K., Kung, H. F. Pharmacological effects of dopaminergic drugs on in vivo binding of [99mTc]TRODAT-1 to the central dopamine transporters in rats. Eur J Nucl Med. 25 (1), 31-39 (1998).
- Near, J. A., Bigelow, J. C., Wightman, R. M. Comparison of uptake of dopamine in rat striatal chopped tissue and synaptosomes. J Pharm Exp Ther. 245 (3), 921-927 (1988).
- Michael, A. C., Ikeda, M., Justice, J. B. Dynamics of the recovery of releasable dopamine following electrical stimulation of the medial forebrain bundle. Neurosci Lett. 76 (1), 81-86 (1987).
- Fierro, L., DiPolo, R., Llano, I. Intracellular calcium clearance in Purkinje cell somata from rat cerebellar slices. The Journal of physiology. 510 (Pt 2), 499-512 (1998).
- Sandoval, V., Riddle, E. L., Hanson, G. R., Fleckenstein, A. E. Methylphenidate redistributes vesicular monoamine transporter-2: role of dopamine receptors. J Neurosci. 22 (19), 8705-8710 (2002).
- Daws, L. C., et al. Cocaine increases dopamine uptake and cell surface expression of dopamine transporters. Biochem Biophys Res Commun. 290 (5), 1545-1550 (2002).
- Little, K. Y., Kirkman, J. A., Carroll, F. I., Clark, T. B., Duncan, G. E. Cocaine use increases [3H]WIN 35428 binding sites in human striatum. Brain Res. 628 (1-2), 17-25 (1993).
- Ewing, A. G., Bigelow, J. C., Wightman, R. M. Direct in vivo monitoring of dopamine released from two striatal compartments in the rat. Science. 221 (4606), 169-171 (1983).
- Janezic, S., et al. Deficits in dopaminergic transmission precede neuron loss and dysfunction in a new Parkinson model. Proc Natl Acad Sci U S A. 110 (42), E4016-E4025 (2013).
- Macdonald, P. A., Monchi, O. Differential effects of dopaminergic therapies on dorsal and ventral striatum in Parkinson’s disease: implications for cognitive function. Parkinsons Dis. 2011, 572743 (2011).
- Kile, B. M., et al. Optimizing the Temporal Resolution of Fast-Scan Cyclic Voltammetry. ACS Chem Neurosci. 3 (4), 285-292 (2012).
- Venton, B. J., Troyer, K. P., Wightman, R. M. Response times of carbon fiber microelectrodes to dynamic changes in catecholamine concentration. Anal Chem. 74 (3), 539-546 (2002).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain research. 487 (2), 311-320 (1989).
- Wu, Q., Reith, M. E., Wightman, R. M., Kawagoe, K. T., Garris, P. A. Determination of release and uptake parameters from electrically evoked dopamine dynamics measured by real-time voltammetry. J Neurosci Methods. 112 (2), 119-133 (2001).

