मॉडर्निंग फास्ट-स्कैन चक्रीय वोल्टैमेटरी डाटा, जो विद्युत रूप से प्रेरित डोपामाइन न्यूरोट्रांसमिशन डेटा से QNsim1.0 का उपयोग करता है
Summary
फास्ट-स्कैन चक्रीय वोल्टमैट्री दवाओं, बीमारी और अन्य प्रयोगात्मक जोड़तोड़ के संदर्भ में विवो डोपामाइन न्यूरोट्रांसमिशन में निगरानी कर सकती है। यह काम QNsim1.0 के कार्यान्वयन का वर्णन करता है, जो नैदानिक न्यूरोबियल मॉडल के अनुसार विद्युत रूप से प्रेरित डोपामिन प्रतिक्रियाओं को मॉडल बनाने के लिए डोपामाइन रिहाई और गतिशीलता को फिर से शुरू करने के अनुमान के लिए एक सॉफ्टवेयर का वर्णन करता है।
Abstract
केन्द्रीय डोपामिनर्जिक (डीएआरजीक) रास्तेों की एक विस्तृत श्रृंखला में महत्वपूर्ण भूमिका है, जैसे ध्यान, प्रेरणा और आंदोलन डोपामिन (डीए) रोगों और विकारों में शामिल है जिसमें ध्यान घाटे में सक्रियता विकार, पार्किंसंस रोग, और दर्दनाक मस्तिष्क की चोट शामिल है। इस प्रकार, डीए न्यूरोट्रांसमिशन और इसका अध्ययन करने के तरीके गहन वैज्ञानिक हित हैं। विवो में तेजी से स्कैन चक्रीय वोल्टैमेट्री (एफएससीवी) एक विधि है जो चुनिंदा डीए एकाग्रता में बदलाव को अस्थायी और स्थानिक संकल्प के साथ बदलता है। इस तकनीक का उपयोग आमतौर पर डीएजीिक मार्गों के आरोहण के विद्युत उत्तेजनाओं के साथ किया जाता है ताकि डोपामाइन न्यूरोट्रांसमिशन के आवेग प्रवाह को नियंत्रित किया जा सके। हालांकि प्रेरित डीए न्यूरोट्रांसमिशन पैराग्जम स्पष्ट रूप से स्पष्ट डीए प्रतिक्रियाओं का उत्पादन कर सकता है, जिससे उन्हें गतिज विश्लेषण के लिए सक्षम बनाया जा सकता है, फिर भी उनके डीए रिलीज और क्लियरन के संदर्भ में प्रतिक्रियाओं की व्याख्या करने के बारे में बहुत बहस है।सीई घटकों इस चिंता का समाधान करने के लिए, उत्तेजित डीए न्यूरोट्रांसमिशन का एक मात्रात्मक न्यूरोबियल (क्यूएन) ढांचा हाल ही में डीए रिलीज़ की गतिशीलता को वास्तविक रूप से मॉडल बनाने के लिए विकसित किया गया था और एक प्रेरित डीए प्रतिक्रिया के दौरान फिर से शुरू किया गया था। इस मॉडल की नींव उत्तेजित डीए न्यूरोट्रांसमिशन के प्रयोगात्मक आंकड़ों और अनुसंधान के विभिन्न लाइनों से अपनाई गई न्यूरोट्रांसमिशन के सिद्धांतों पर आधारित है। QN मॉडल प्रेरित डीए रिलीज से संबंधित 12 मापदंडों का कार्यान्वयन करता है और डीए प्रतिक्रियाओं को मॉडल के लिए गतिशीलता में दोबारा शुरू करता है। यह काम बताता है कि QAsim1.0 का उपयोग करते हुए डीए प्रतिक्रियाओं का अनुकरण कैसे करें और उन सिद्धांतों का भी वर्णन करें जिनके कार्यान्वयन को प्रेरित डोपामाइन रिहाई में व्यवस्थित रूप से बदलना और गतिशीलता फिर से शुरू करना है।
Introduction
डोपामाइन (डीए) न्यूरोट्रांसमिशन विभिन्न संज्ञानात्मक और व्यवहार कार्यों में एक महत्वपूर्ण भूमिका निभाता है, और इसके दोष कई आम बीमारियों और विकारों में फैलता है। जैसे, रोग मॉडल और औषधि औषधि विज्ञान के संदर्भ में डीए न्यूरोट्रान्समिशन कैसे बदला जाता है, यह मूल्यांकन करने के लिए विवो में डीए न्यूरोट्रांसमिशन का मात्रात्मक अध्ययन करने के सटीक तरीकों को विकसित करना महत्वपूर्ण है। फास्ट-स्कैन चक्रीय वोल्टैमेट्री (एफएससीवी) विवो डीए न्यूरोट्रांसमिशन में ठीक स्थानिक और अस्थायी संकल्प के साथ निगरानी के लिए अनुमति देता है। जहां जागरूकता में स्वतंत्र डीए न्यूरोट्रांसमिशन की निगरानी करना संभव है, जानवरों को आज़ाद रूप से बर्ताव करते हुए, संवेदनाहारी जानवरों में बढ़ते डोपामिनर्जिक मार्गों के विद्युत उत्तेजना से मजबूत डीए प्रतिक्रियाएं उत्पन्न हो सकती हैं जो डीए न्यूरोट्रांसमिशन के उन्नत कैनेटिक विश्लेषण के लिए मुमकिन हैं।
इलेक्ट्रानिक रूप से प्रेरित डीए प्रतिक्रियाएं डीए रिलीज और पुनः आरंभ की गतिशील परस्पर क्रिया को दर्शाती हैं, और व्याख्याएंइन प्रतिक्रियाओं में मुख्य रूप से प्रेरित डीए न्यूरोट्रांसिशन के एक साधारण मॉडल का उपयोग किया जाता है जिसे माइकलिस-मेंटन (एमएम) मॉडल 12 कहा जाता है एमएएम मॉडल में डीए की प्रतिक्रियाओं के संदर्भ में डीए की प्रतिक्रियाओं का वर्णन करने के लिए 3 वैरिएबल होते हैं और एक निरंतर डीयू रिलीज रेट के संदर्भ में ( जैसे, डीए पुनर्गठन दर और बाह्य डीए सांद्रता के बीच संबंध) समीकरण 1 के अनुसार वर्णित है: 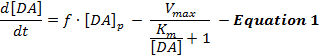
(डीए रिलीज़) (डीए रीप्तेक)
समीकरण 1 में, च उत्तेजना की आवृत्ति है; [डीए] पी उत्तेजना की नब्ज प्रति अनुमानित डीए एकाग्रता वृद्धि है; वी मैक्स अनुमानित अधिकतम रिव्वेट रेट का प्रतिनिधित्व करता है; और के एम अनुमानित एमएम स्थिरता है, जो सैद्धांतिक रूप से बाहरी डीए एकाग्रता के बराबर है जो 50% डीएटी को संतृप्त करता है, जिससे आधा-अधिक से अधिक प्राप्ति दर बढ़ जाती है। यह भिन्नताअल समीकरण [डीए] पी , वी मैक्स , और के एम मापदंडों के आकलन के द्वारा प्रयोगात्मक डीए प्रतिक्रियाओं को अनुकरण करने के लिए एकीकृत किया जा सकता है।
हालांकि एमएम मॉडल ने विभिन्न प्रयोगात्मक संदर्भों में डीए न्यूरोट्रांसमिशन कैनेटीक्स की समझ में महत्वपूर्ण प्रगति की सुविधा प्रदान की है, लेकिन एमएम मॉडल सरल मूलभूत धारणाओं को बनाता है, जो कि एसएपी प्रतिक्रियाओं 2 , मिसाल के तौर पर, एमएम मॉडल केवल डीए प्रति संवेदनशील आकृतियों का अनुमान कर सकते हैं यदि वे उत्तल तरीके से बढ़ते हैं, लेकिन यह पृष्ठीय स्ट्रायलल क्षेत्रों 12 में पाया गया क्रमिक (अवतल) बढ़ती प्रतिक्रियाओं के लिए खाता नहीं रख सकता है। इस प्रकार, एमएम मॉडल की धारणाएं गतिशील रिलीज को सटीक रूप से नहीं पकड़ती हैं और उत्तेजित डीए न्यूरोट्रांसमिशन की प्रक्रियाओं को फिर से शुरू करती हैं।
एक यथार्थवादी क्वालिटी के अनुसार मॉडल प्रेरित डीए प्रतिक्रियाओं के लिएइटेटिव फ्रेमवर्क, पूरक अनुसंधान और प्रयोग 2 से प्राप्त उत्तेजित न्यूरोट्रांसमिशन कैनेटीक्स के सिद्धांतों के आधार पर मात्रात्मक तंत्रिका जीव विज्ञान (क्यूएन) ढांचे को विकसित किया गया था। न्यूरोट्रांसमिशन शोध की विभिन्न रेखाएं प्रदर्शित करती हैं कि (1) उत्तेजित न्यूरोट्रांसमीटर रिलीज एक गतिशील प्रक्रिया है जो उत्तेजना 14 के दौरान दर में घट जाती है, (2) रिहाई पोस्ट-उत्तेजना चरण में बिफसिक क्षय कैनेटीक्स 15 , और (3) डीए दोबारा उत्तेजना की अवधि 2 , 16 के दौरान उत्तरोत्तर दक्षता को धीरे-धीरे हिचकते हैं। ये तीन अवधारणाएं क्यूएन फ्रेमवर्क की नींव के रूप में काम करती हैं, और डीए रिलीज की गतिशीलता का वर्णन करते हुए 12 मापदंडों वाली तीन समीकरणों और फिर से शुरू करने ( तालिका 1 )। क्यूएन फ्रेमवर्क विषम प्रायोगिक डीए प्रतिक्रिया प्रकारों के साथ-साथ पी के समान रूप से अनुकरण कर सकता हैउत्तेजना मापदंडों और नशीली दवाओं के प्रशासन की प्रयोगात्मक जोड़तोड़ के प्रभाव का अनुमान लगाया गया 2 , 6 यद्यपि डेटा मॉडलिंग दृष्टिकोण को परिष्कृत करने के लिए आगे शोध आवश्यक है, भविष्य के प्रयोगों को इस न्यूरबायोलॉजिकल रूप से आधारित मॉडलिंग दृष्टिकोण से बहुत फायदा हो सकता है, जो प्रेरित डीए न्यूरोट्रांसमिशन पैराडाइम से निकाले गए संदर्भों में महत्वपूर्ण रूप से जोड़ता है।

तालिका 1: मॉडलिंग समीकरण और पैरामीटर इस आंकड़े के एक बड़े संस्करण को देखने के लिए कृपया यहां क्लिक करें
इस ट्यूटोरियल का वर्णन है कि कैसे डीए रिहाई का अनुमान लगाने और QNsim 1.0 का उपयोग कर कैनेटीक्स को फिर से शुरू करने के लिए प्रेरित डीए प्रतिक्रिया डेटा के मॉडल के बारे में। वास्तविक प्रयोगात्मक डेटा संग्रह और जनसंपर्कOcessing यहाँ वर्णित नहीं है और केवल अस्थायी डीए एकाग्रता डेटा की आवश्यकता है। क्यूएन रूपरेखा के सैद्धांतिक समर्थन और नींव को पहले 2 से बड़े पैमाने पर वर्णित किया गया है, लेकिन QA फ्रेमवर्क को लागू करने के लिए डीए प्रतिवेदन डेटा मॉडल पर व्यावहारिक दृष्टिकोण नीचे वर्णित है।
QN फ़्रेमवर्क मॉडल: 1) डायनेमिक डीए रिलीज़, 2) डीए पुनप्राप्ति, और 3) डीए प्रतिक्रिया डेटा से सार्थक गतिज जानकारी निकालने के लिए इन प्रक्रियाओं पर स्प्रैफिसियोलॉजिकल उत्तेजनाओं के प्रभावों के बीच गतिशील पारस्परिक क्रियाएं प्रदर्शित करता है। QN फ्रेमवर्क, लंबी अवधि ( उदा। 60 हर्ट्ज, 10 एस उत्तेजना) के अत्यधिक अनुक्रियात्मक उत्तेजनाओं का उपयोग करके प्राप्त एफएससीवी डेटा के मॉडलिंग के लिए सबसे उपयुक्त है, जो कि गतिशील विश्लेषण के लिए अनुकूल डीए प्रतिक्रियाओं का उत्पादन करती है। अंतर्निहित रिहाई के सही मॉडलिंग और प्रक्रियाओं को फिर से शुरू करने के बाद, मॉडल मापदंडों का उपयोग डीए की प्रतिक्रिया अनुकरण करने के लिए किया जा सकता है जो पूर्व के आकार का अनुमान लगाया जाना चाहिएपरिधि डीए प्रतिक्रिया
क्यूएन फ्रेमवर्क के समीकरण डीए रिलीज की दरों का वर्णन करते हैं और उत्तेजित डीए प्रतिक्रियाओं के दौरान पुनः आरंभ करते हैं। क्यूएन ढांचे उत्तेजक डीए रिलीज दर का उत्तेजना (टी stim ) की शुरुआत से समय के एक फ़ंक्शन के रूप में वर्णित करता है, जब डीए रिलीज़ दर उत्तेजना के दौरान तेजी से घट जाती है। यह अन्य रिपोर्ट ( समीकरण 2 ) 14 , 17 के समान, फंक्शंस पुनःपूर्ति के लिए खाते में एक स्थिर स्थिर-राज्य डीए रिलीज रेट (डीएआरएस) के साथ आसानी से रिलीज़ करने योग्य पूल की कमी के अनुरूप है।
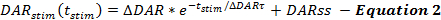
मणिपुण जो डीए जारी करने की दर को बढ़ाता है, जैसे बढ़ती Δ डीएआर, डीएआर τ , या डेस, डीए बनाम टाइम प्लॉट्स पर बढ़ी हुई उत्तरदायी प्रतिक्रियाओं के कारण आगे बढ़ते हैं। प्रत्येक पैरामेडडीए डीए प्रतिक्रिया आकार के लिए अलग-अलग योगदान देता है। डेस बढ़ाना और Δ डीएआर τ दोनों प्रतिक्रियाओं के बढ़ते चरण को अधिक रैखिक (कम उत्तल) बनाते हैं। घटते हुए Δ डीएआर τ उत्तलता को बढ़ावा देता है, जो कि डीएआर के परिमाण के द्वारा नियंत्रित होता है। मॉडलिंग अनुभव के आधार पर, डेस आम तौर पर 1/5 से कम डीएआर है; इस प्रकार, Δ डीएआर रिहाई पैरामीटर है जो प्राथमिक रूप से डीए प्रतिक्रिया के समग्र प्रतिक्रिया आयाम निर्धारित करता है।
उत्तेजना (टी पोस्ट ) के बाद समय के एक फ़ंक्शन के रूप में उत्तेजना के अंत (डीएआर ईएस ) के अंत से प्रेरित डीए रिलीज दर की निरंतरता के रूप में पोस्ट-उत्तेजना डीए रिलीज़ रेट समीकरण 3 द्वारा तैयार किया गया है। पोस्ट उत्तेजना डीए रिलीज दर एक बीफसिक क्षय पैटर्न का अनुसरण करती है, जैसा कि पहले 15 को वर्णित है, एक तीव्र घातीय क्षय चरण के साथ और दो कैलोरी मॉडल के लिए एक लंबा रेखीय क्षय चरणलसीम पर निर्भर न्यूरोट्रांसमीटर रिलीज प्रक्रियाएं
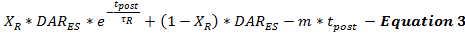
(तीव्र घातीय क्षय) (लंबे समय तक रेखीय क्षय)
यह निर्धारित करना संभव नहीं है कि पोस्ट-उत्तेजना डीए रिलीज़ कितना होता है। यह सीमा अलग-अलग उत्तेजनाओं का उपयोग करके एक ही रिकॉर्डिंग साइट से एकत्रित प्रायोगिक डीए प्रतिक्रियाओं के एक सेट के बाद पोस्ट-उत्तेजना डीए रिलीज के मॉडल के अनुमानों को न्यूनतम करने और मान्य करने से संबोधित किया जा सकता है। यह न्यूनीकरण उपयोगकर्ताओं को रिहाई के रूढ़िवादी अनुमान और पुन: उठाने की अनुमति देता है क्योंकि इलेक्ट्रिकल उत्तेजना कैल्शियम संचय के लिए पैदा होती है जो पोस्ट-उत्तेजना न्यूरोट्रांसमीटर रिलीज को बढ़ावा देती है, उत्तेजना की अवधि के बाद उत्तेजना न्यूरोट्रांस को प्रभावित करती हैमिटर रिलीज पैरामीटर 18 , 1 9 । मॉडलिंग के अनुभव के आधार पर, यह पाया गया कि उत्तेजना की अवधि बढ़ जाती है, τ आर बढ़ जाती है और एक्स आर कम हो जाती है, जो अधिक कैल्शियम संचय 20 के अनुमानित प्रभावों के अनुरूप है।
समीकरण 4 डीए पुन: आरंभ दर को एमएम फ्रेमवर्क के विस्तार के रूप में वर्णित करता है और एक गतिशील कश्मीर एम टर्म को समाहित करता है, जो स्प्रैफिसियोलॉजिकल उत्तेजनाओं 2 , 16 के कारण क्रमिक रूप से घटते हुए रीप्टेटेस दक्षता के मॉडल के लिए उत्तेजना के दौरान बढ़ जाता है। उत्तेजना के अंत में कश्मीर मीटर उत्तेजना (के एमईएस ) के अंत में के एम मान पर लगातार रखा जाता है।
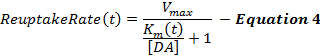
कहा पे,
<img alटी = "समीकरण 6" src = "/ files / ftp_upload / 55595 / 55595eq6.jpg" />
(उत्तेजना के दौरान) (उत्तेजना के बाद)
प्रेरित डीए प्रतिक्रियाओं, विशेष रूप से उदर-धक्कादायक क्षेत्रों से, अक्सर प्रारंभिक के मीटर मूल्य (के मी ) में परिवर्तन के लिए असंवेदनशील होती हैं, जो कश्मीर मील की समस्याओं को परिभाषित करता है। इस प्रकार, मूल एमएम फ्रेमवर्क की तरह, कश्मीर मील 0.1.0.4 μ एम पर डीए के नियंत्रण के लिए नियंत्रण अनुपचारित पशुओं से एकत्रित 12 अनुमानित है। Δ के एम शब्द उत्तेजना के दौरान प्राप्ति दक्षता परिवर्तन की सीमा निर्धारित करता है, जो हमारे अनुभव से लगभग 20 है81; एक 60-हर्ट्ज, 10-एस उत्तेजना के दौरान एम। कश्मीर और कश्मीर मिनफ मूल्य निर्धारित करते हैं कि समय के साथ कश्मीर में कितना बदलाव होता है, और इनमें से दोनों पदों में वृद्धि बढ़ती चरण की अंतराल को बढ़ावा देती है। वी मैक्स अधिकतम रिवेटेट रेट है जो आंशिक रूप से स्थानीय डीए ट्रांसपोर्टर घनत्व से संबंधित है, जो डोरसोलैटेज ग्रेडियेंट 21 के लिए वाटर्रोमेडियल दर्शाती है। तदनुसार, पृष्ठीय striatum (डी-स्ट्र) में अधिकतम अधिकतम मूल्य सामान्यतः 30 μM / s से अधिक होते हैं लेकिन आमतौर पर नाभिक accumbens (एनएसी) जैसे उदर क्षेत्रों में 30 μM / s से कम
उपरोक्त सामान्य दिशानिर्देश प्रायोगिक डीए प्रतिक्रिया डेटा के मॉडलिंग में सहायता कर सकते हैं, लेकिन प्रायोगिक डीए प्रतिक्रिया के अनुमान के अनुसार एक सिमुलेशन पैदा करने की आवश्यकता होती है जिसमें मॉडल पैरामीटर को समायोजित करना आवश्यक है। मॉडल मापदंडों की सटीकता को सुप्रात्रिकीय उत्तेजनाओं के लिए डीए के उत्तर प्राप्त करके सुधार किया जा सकता है जो प्रदान करते हैंसिमुलेशन के लिए एक मजबूत सब्सट्रेट, साथ ही पैरामीटरों की सटीकता को मान्य करने के लिए एक ही रिकॉर्डिंग साइट ( जैसे 60-हर्ट्ज, 5-एस और 10-एस उत्तेजनाओं) में अलग-अलग अवधियों के उत्तेजनाओं को प्राप्त करने और कई डीए प्रतिक्रियाओं को प्राप्त करने के द्वारा ( नमूना डेटा देखें)। प्रदर्शित करने के लिए, एक डाटासेट को सॉफ्टवेयर पैकेज के साथ शामिल किया गया है जिसमें रेजीसपेसिफिक प्रेरित डीए प्रतिक्रियाएं शामिल हैं, जो न्यूक्लियस अभिमान और पृष्ठीय स्ट्राटैम में एकत्र की जाती हैं, जो एक औषधीय चुनौती के पहले और बाद में थी जो पहले से ही QN फ़्रेमवर्क का उपयोग करके मॉडल किया गया था। विस्तार से, उपयोगकर्ता इस पद्धति को इसी तरह लागू कर सकते हैं कि डीए न्यूरोट्रांसमिशन के कैनेटीक्स को विभिन्न बीमारियों के संदर्भ और औषधीय जोड़तोड़ में दर्ज किया जा सकता है।
Protocol
Representative Results
Discussion
विवो में अध्ययन करने के लिए एफएससीवी के प्रयोग से 1 9 80 के दशक में उत्पन्न डीए न्यूरोट्रांसमेंट का विकास हुआ और अभी भी अद्वितीय स्थानिक और अस्थायी संकल्प के साथ विवो न्यूरोट्रांसमिशन डाटा का एक स?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
हम इस काम के समर्थन के लिए यूपीएमसी पुनर्वास संस्थान को स्वीकार करते हैं।
Materials
| MATLAB R2016a for Mac | Mathworks | ||
| QNsim1.0 | In house software package | Software to model FSCV data using the QN framework |
References
- Taylor, I. M., et al. Kinetic diversity of dopamine transmission in the dorsal striatum. J Neurochem. 133 (4), 522-531 (2015).
- Harun, R., Grassi, C. M., Munoz, M. J., Torres, G. E., Wagner, A. K. Neurobiological model of stimulated dopamine neurotransmission to interpret fast-scan cyclic voltammetry data. Brain Res. 1599, 67-84 (2015).
- Taylor, I. M., Jaquins-Gerstl, A., Sesack, S. R., Michael, A. C. Domain-dependent effects of DAT inhibition in the rat dorsal striatum. Journal of neurochemistry. 122 (2), 283-294 (2012).
- Garris, P. A., Ciolkowski, E. L., Wightman, R. M. Heterogeneity of evoked dopamine overflow within the striatal and striatoamygdaloid regions. Neuroscience. 59 (2), 417-427 (1994).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain Res. 487 (2), 311-320 (1989).
- Harun, R., et al. Fast-scan cyclic voltammetry demonstrates that L-DOPA produces dose-dependent regionally selective, bimodal effects on striatal dopamine kinetics in vivo. J Neurochem. , (2015).
- Jones, S. R., Garris, P. A., Wightman, R. M. Different effects of cocaine and nomifensine on dopamine uptake in the caudate-putamen and nucleus accumbens. The Journal of pharmacology and experimental therapeutics. 274 (1), 396-403 (1995).
- Budygin, E. A., John, C. E., Mateo, Y., Jones, S. R. Lack of cocaine effect on dopamine clearance in the core and shell of the nucleus accumbens of dopamine transporter knock-out mice. J Neurosci. 22 (10), RC222 (2002).
- Jones, S. R., et al. Loss of autoreceptor functions in mice lacking the dopamine transporter. Nat Neurosci. 2 (7), 649-655 (1999).
- Wagner, A. K., et al. Chronic methylphenidate treatment enhances striatal dopamine neurotransmission after experimental traumatic brain injury. J Neurochem. 108 (4), 986-997 (2009).
- Wagner, A. K., et al. Controlled cortical impact injury influences methylphenidate-induced changes in striatal dopamine neurotransmission. J Neurochem. 110 (3), 801-810 (2009).
- Wightman, R. M., et al. Real-time characterization of dopamine overflow and uptake in the rat striatum. Neuroscience. 25 (2), 513-523 (1988).
- Moquin, K. F., Michael, A. C. Tonic autoinhibition contributes to the heterogeneity of evoked dopamine release in the rat striatum. J Neurochem. 110 (5), 1491-1501 (2009).
- Pyott, S. J., Rosenmund, C. The effects of temperature on vesicular supply and release in autaptic cultures of rat and mouse hippocampal neurons. J Physiol. 539 (Pt 2), 523-535 (2002).
- Atluri, P. P., Regehr, W. G. Delayed release of neurotransmitter from cerebellar granule cells. J Neurosci. 18 (20), 8214-8227 (1998).
- Wang, S. R., et al. Role of vesicle pools in action potential pattern-dependent dopamine overflow in rat striatum in vivo. J Neurochem. 119 (2), 342-353 (2011).
- Taschenberger, H., von Gersdorff, H. Fine-tuning an auditory synapse for speed and fidelity: developmental changes in presynaptic waveform, EPSC kinetics, and synaptic plasticity. J Neurosci. 20 (24), 9162-9173 (2000).
- Goda, Y., Stevens, C. F. Two components of transmitter release at a central synapse. Proc Nat Acad of Sci U S A. 91 (26), 12942-12946 (1994).
- Yao, J., Gaffaney, J. D., Kwon, S. E., Chapman, E. R. Doc2 is a Ca2+ sensor required for asynchronous neurotransmitter release. Cell. 147 (3), 666-677 (2011).
- Hagler, D. J., Goda, Y. Properties of synchronous and asynchronous release during pulse train depression in cultured hippocampal neurons. J Neurophysiol. 85 (6), 2324-2334 (2001).
- Ciliax, B. J., et al. The dopamine transporter: immunochemical characterization and localization in brain. J Neurosci. 15 (3 Pt 1), 1714-1723 (1995).
- Volz, T. J., Farnsworth, S. J., Rowley, S. D., Hanson, G. R., Fleckenstein, A. E. Methylphenidate-induced increases in vesicular dopamine sequestration and dopamine release in the striatum: the role of muscarinic and dopamine D2 receptors. J Pharm Exp Ther. 327 (1), 161-167 (2008).
- Dresel, S. H., Kung, M. P., Plossl, K., Meegalla, S. K., Kung, H. F. Pharmacological effects of dopaminergic drugs on in vivo binding of [99mTc]TRODAT-1 to the central dopamine transporters in rats. Eur J Nucl Med. 25 (1), 31-39 (1998).
- Near, J. A., Bigelow, J. C., Wightman, R. M. Comparison of uptake of dopamine in rat striatal chopped tissue and synaptosomes. J Pharm Exp Ther. 245 (3), 921-927 (1988).
- Michael, A. C., Ikeda, M., Justice, J. B. Dynamics of the recovery of releasable dopamine following electrical stimulation of the medial forebrain bundle. Neurosci Lett. 76 (1), 81-86 (1987).
- Fierro, L., DiPolo, R., Llano, I. Intracellular calcium clearance in Purkinje cell somata from rat cerebellar slices. The Journal of physiology. 510 (Pt 2), 499-512 (1998).
- Sandoval, V., Riddle, E. L., Hanson, G. R., Fleckenstein, A. E. Methylphenidate redistributes vesicular monoamine transporter-2: role of dopamine receptors. J Neurosci. 22 (19), 8705-8710 (2002).
- Daws, L. C., et al. Cocaine increases dopamine uptake and cell surface expression of dopamine transporters. Biochem Biophys Res Commun. 290 (5), 1545-1550 (2002).
- Little, K. Y., Kirkman, J. A., Carroll, F. I., Clark, T. B., Duncan, G. E. Cocaine use increases [3H]WIN 35428 binding sites in human striatum. Brain Res. 628 (1-2), 17-25 (1993).
- Ewing, A. G., Bigelow, J. C., Wightman, R. M. Direct in vivo monitoring of dopamine released from two striatal compartments in the rat. Science. 221 (4606), 169-171 (1983).
- Janezic, S., et al. Deficits in dopaminergic transmission precede neuron loss and dysfunction in a new Parkinson model. Proc Natl Acad Sci U S A. 110 (42), E4016-E4025 (2013).
- Macdonald, P. A., Monchi, O. Differential effects of dopaminergic therapies on dorsal and ventral striatum in Parkinson’s disease: implications for cognitive function. Parkinsons Dis. 2011, 572743 (2011).
- Kile, B. M., et al. Optimizing the Temporal Resolution of Fast-Scan Cyclic Voltammetry. ACS Chem Neurosci. 3 (4), 285-292 (2012).
- Venton, B. J., Troyer, K. P., Wightman, R. M. Response times of carbon fiber microelectrodes to dynamic changes in catecholamine concentration. Anal Chem. 74 (3), 539-546 (2002).
- May, L. J., Wightman, R. M. Heterogeneity of stimulated dopamine overflow within rat striatum as observed with in vivo voltammetry. Brain research. 487 (2), 311-320 (1989).
- Wu, Q., Reith, M. E., Wightman, R. M., Kawagoe, K. T., Garris, P. A. Determination of release and uptake parameters from electrically evoked dopamine dynamics measured by real-time voltammetry. J Neurosci Methods. 112 (2), 119-133 (2001).

