Et hydroponisk samdyrkningssystem for samtidig og systematisk analyse av molekylære interaksjoner og signalering av plante / mikrobe
Summary
Det beskrevne hydroponiske kultiveringssystemet støtter intakte planter med metall mesh skjermer og cocultivates dem med bakterier. Plantevev, bakterier og utsöndrede molekyler kan deretter høstes separat for nedstrømsanalyser, samtidig som molekylære responsene fra både planteverter og interaktive mikrober eller mikrobiomer kan undersøkes.
Abstract
En eksperimentell design som etterligner naturlige plante-mikrobe-interaksjoner, er svært viktig for å avgrense de komplekse plantemikro signalering prosessene. Arabidopsis thaliana – Agrobacterium tumefaciens Gir et utmerket modellsystem for å studere bakteriell patogenese og planteinteraksjoner. Tidligere studier av plante- Agrobacterium- interaksjoner har i stor grad vært basert på plantecelle-suspensjonskulturer, kunstig såring av planter eller kunstig induksjon av mikrobielle virulensfaktorer eller plantebeskyttelse av syntetiske kjemikalier. Imidlertid er disse metodene forskjellig fra den naturlige signalering i planta , hvor planter og mikrober gjenkjenner og reagerer i romlig og tidsmessig oppførsel. Dette arbeidet presenterer et hydroponisk kultiveringssystem hvor intakte planter støttes av metallmasker og kultivert med Agrobacterium . I dette kultiveringssystemet finnes ingen syntetisk fytohormon eller kjemikalie som fremkaller mikrObial virulence eller planteforsvar er supplert. Det hydroponiske kultiveringssystemet ligner i stor grad naturlige plante-mikrobe-interaksjoner og signalering av homeostase i planta . Plantrøtter kan skilles fra mediet som inneholder Agrobacterium , og signalene og responsene fra både anleggets verter og de samvirkende mikrober kan undersøkes samtidig og systematisk. Ved et hvilket som helst tidspunkt / intervall kan plantevev eller bakterier høstes separat for ulike "omics" -analyser, som demonstrerer effekten og effekten av dette systemet. Det hydroponiske kultiveringssystemet kan lett tilpasses for å studere: 1) Gensidig signalering av forskjellige plante-mikrobe-systemer, 2) Signalisering mellom en planteverten og flere mikrobielle arter ( dvs. mikrobielle konsortier eller mikrobiomer), 3) hvordan næringsstoffer og kjemikalier er involvert I plante-mikrobe signalering, og 4) hvordan mikrober interagerer med plante verter og bidrar til plantetoleranse mot biotiske oR abiotiske stress.
Introduction
Planteassosierte mikrober spiller viktige roller i biogeokjemisk sykling, bioremediering, reduksjon av klimaendringer, plantevekst og helse og plantetoleranse mot biotiske og abiotiske påkjenninger. Mikroorganismer interagerer med planter både direkte gjennom plantecelleveggkontakt og indirekte via kjemisk sekresjon og signalering 1 , 2 , 3 . Som sessile organismer har planter utviklet direkte og indirekte mekanismer for å motstå infeksjon av patogener. Direkte forsvar inkluderer strukturelle forsvar og uttrykk for forsvarsproteiner, mens indirekte forsvar inkluderer sekundær plantemetabolittproduksjon og tiltrengning av organismer som er antagonistiske mot invaderende patogener 4 , 5 . Planteavledede rotutsprutninger, sekreter, slimhinner, mucigel og lysater forandrer de fysisk-kjemiske egenskapene til rhizosfæren for å tiltrekke seg eller frastøteMikrober mot sine verter 6 . Den kjemiske sammensetningen av rotsekresjon er artespesifikk, og derved tjener som et selektivt filter som tillater visse mikroorganismer som er i stand til å gjenkjenne slike forbindelser for å blomstre i rhizosfæren 6 . Således kan kompatible mikrobielle arter stimuleres til å aktivere og forbedre deres foreninger, enten til fordel for eller skade for planteverten 1 .
Forståelse av plante-mikrobe-interaksjoner i rhizosfæren er nøkkelen til å øke planteproduktiviteten og økosystemfunksjonen, siden et flertall av den mikrobielle og kjemiske eksponeringen forekommer ved rotstrukturen og jord-luftgrensesnittet 2 , 6 , 7 , 8 . Imidlertid har undersøkelsen av underjordiske plante-mikrobe-interaksjoner og gjensidige responser vært en utfordring på grunn av dens intrigerende Kompleks og dynamisk natur og mangel på egnede eksperimentelle modeller med naturlig rotstruktur og plantemorfologi under tett kontrollerbare vekstforhold. Som en av de mest studerte fytopathogenene, smitter Agrobacterium et bredt spekter av planter med landbruk og hagebruk, inkludert kirsebær, eple, pære, drue og rose 9 . Agrobacterium er en viktig modellorganisme for forståelse av plante-patogen-interaksjoner og er et kraftig verktøy i plantetransformasjon og anleggsteknologi 10 , 11 , 12 , 13 , 14 .
Molekylær plante- Agrobacterium- interaksjoner har blitt godt studert i flere tiår, og den nåværende forståelsen av Agrobacterium- patogenitet er omfattende 9 ,F.> 11 , 15 , 16. Agrobacterium- patogenitet er i stor grad tilskrevet sin evolusjonerte evne til å oppleve planteavledede signaler, noe som resulterer i finmoduleringen av dets virulensprogram og celle-til-cellekommunikasjon, såkalt quorum sensing 17 . Agrobacterium virulence-programmet er regulert av flere signaler tilgjengelig i rhizosfæren og involverer to sett med 2-komponentsystemer, ChvG / I-systemet og VirA / G-systemet. Syriske forhold i rhizosfæren aktiverer transkripsjonen av chvG / I , virA / G , Og flere andre gener involvert i Agrobacterium- patogenitet, inkludert virE0 , virE1 , virH1 , virH2 og gener av type VI-sekresjonssystemet (T6SS) 18. Plantavledede fenolforbindelser, inkludert acetosyringon (4'-hydroksy-3 ', 5 '-dimetoksyacetofenon), aktiver VIrA / G 2-komponentsystem gjennom fosforyleringssignalmekanismer 19 . VirA / G aktiverer så hele vir- regulonet, noe som resulterer i overføring og integrasjon av et 20 kb bakterielt DNA-fragment kalt overførings-DNA (T-DNA) fra sitt tumorinducerende (Ti) plasmid inn i plantekjernen 16 . T-DNA bærer gener ansvarlig for syntesen av plantehormonene indol-3-eddiksyre (IAA) ( iaaM og iaaH ) og cytokinin ( ipt ), og en gang uttrykt i planteceller, produseres store mengder av disse fytohormonene. Dette resulterer i unormal vevsproliferasjon og vekst i plantetumor, kjent som kronegangsykdom, som er et kronisk og resurgent problem for planter 9 , 11 , 20 . IAA virker også kollektivt med salisylsyre og gamma-amino smørsyre for å undertrykke Agrobacterium virulens eller å redusere Agrobacteriu M quorum sensing (QS) 17 , 21 , 22 . For å motvirke denne undertrykkelsen, bærer T-DNA også gener for opinbiosyntese, som aktiverer Agrobacterium quorum sensing for å fremme Agrobacterium- patogenitet og tjener også som næringsmiddelkilde for patogenet 22 , 23 .
Til tross for en generell dyp forståelse av Agrobacterium- planteinteraksjoner og den resulterende T-DNA-overføring til planteverten, er de komplekse signaleringshendelsene i den første fase av interaksjon mindre forstått. Dette skyldes delvis begrensningene av konvensjonelle tilnærminger for å undersøke Agrobacterium- plantesignalering. Plantecellesuspensjonskulturer og kunstig stedsspesifikke sår blir ofte brukt til å studere molekylære plante-mikrobe-interaksjoner 24 ,Ef "> 26 , 27. Imidlertid har cellesuspensjonene mangel på typisk plantemorfologi, spesielt plantesusjonsceller har ikke rotstrukturer og rotutsprutninger, noe som er svært viktig for aktivering av mikrobiell kjemotaks og virulens 28 , 29. Vedlikehold av plantemorfologi Og rotstruktur har blitt tatt opp av kunstig sårende planter, noe som letter tilstedsspesifikke infeksjoner, noe som resulterer i deteksjon av induserte planteforsvarrelaterte gener i direkte infisert plantevev 30 , 31. Imidlertid er kunstig sår betydelig forskjellig fra patogeninfeksjon i naturen , Særlig ettersom sår fører til akkumulering av jasmonisk syre (JA), som systematisk forstyrrer naturlig plantesignalering og -forsvar 26. I tillegg er syntetiske kjemikalier vanligvis brukt til kunstig framkalling av plantevertsresponserEller patogen virulens. Selv om tilskudd av slike kjemiske forbindelser som reflekterer konsentrasjoner i planta, er mulig, utgjør slik tillegg ikke diffusjonen av rotutsprutninger gradvis inn i den omkringliggende rhizosfæren, noe som genererer en kjemotaktisk gradient registrert av mikrober 28 , 32 . Gitt begrensningene ved konvensjonelle tilnærminger for å studere plante-mikrobe-interaksjoner, kan nøyaktigheten og dybden av de innhentede dataene bli hindret og restriktiv, og kunnskapen generert fra de konvensjonelle tilnærmingene kan ikke oversettes direkte i planta . Mange aspekter av plante- Agrobacterium- signalering er ennå ikke fullt ut forstått, særlig i det tidlige stadiet av interaksjoner, når sykdomssymptomene ennå ikke er utviklet.
For å endre grensene for konvensjonelle tilnærminger, presenterer dette arbeidet en billig, tett kontrollerbar og fleksibel hydroponisk cOdlingssystem som gjør det mulig for forskere å få dypere innblikk i de komplekse signal- og responsveiene ved første fase av molekylære plante-mikrobe-interaksjoner. Hydroponics har vært mye brukt til å studere plantenæringsstoffer, rotutsprutninger, vekstbetingelser og virkningen av metallisk toksisitet på planter 33 , 34 . Det finnes flere fordeler med hydroponiske modeller, inkludert de små romlige kravene, tilgjengeligheten til forskjellige plantevev, den tette kontrollen av næringsstoffer / miljøforhold og bekjempelse av skadedyr / sykdom. Hydroponiske systemer er også mindre begrensende for plantevekst i forhold til agar / phytoagar plating teknikker, som vanligvis begrenser veksten etter 2-3 uker. Viktig er at vedlikehold av helplantestrukturer letter den naturlige rotsekresjonen som er nødvendig for mikrobiell kjemotaks og virulensinduksjon 8 , 29 . SystembeskrivelsenSeng her er enklere og mindre arbeidsintensiv enn alternativene 33 , 34 . Den bruker færre deler og krever ikke andre verktøy enn standard saks. Den bruker metallnett (i motsetning til nylon 33 ) som en sterk støtte for plantevekst og en enkel metode for lufting under sterile forhold gjennom risting for å støtte mikrobiel vekst. I tillegg kan systemet bruke metallnett av forskjellige størrelser for å støtte plantevekst, som imøtekommer mangfoldige plantearter uten å begrense bredden på sine røtter.
I det hydroponiske kultiveringssystemet som presenteres her, dyrkes planter i et sterilt hydroponisk system hvor plantenavnene utskiller organiske forbindelser som støtter veksten av inokulerte bakterier. I dette kultiveringssystemet blir ingen kunstige kjemikalier, som plantehormoner, forsvarselektronik eller virulensinducerende kjemikalier, supplert, noe som reflekterer den naturlige cellenSignalerende homeostase under plante-mikrobe interaksjoner. Med dette hydroponiske kultiveringssystemet var det mulig å samtidig bestemme genuttrykk i Arabidopsis thaliana Col-0 rotvev på infeksjon av Agrobacterium , samt aktivering av Agrobacterium- gener ved kultivering med Arabidopsis . Det ble videre påvist at dette systemet er egnet til å studere Agrobacterium- vedlegg til planterøtter, så vel som planterotsekretomprofilen, ved kultivering (infeksjon) med Agrobacterium ( Figur 1 ).
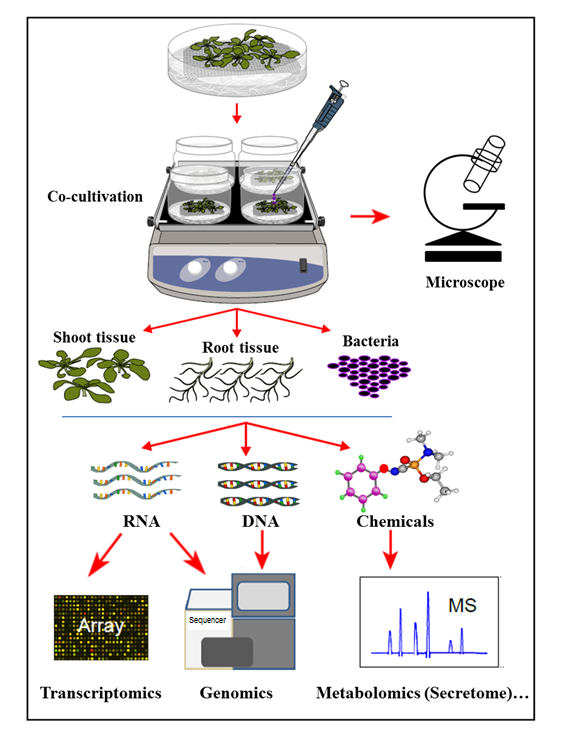
Figur 1: Oversikt over det hydroponiske kultiveringssystemet, med prøveanalyser. Planter dyrkes på toppen av masken (skudd over masken), med røttene nedsenket i hydroponisk medium som deretter inokuleres med bakterier fEller kultur. Plantevev og bakterier separeres deretter for samtidige ekstraksjoner og analyser. Denne figuren er endret fra referanse 35 .
Protocol
Representative Results
Discussion
Gitt den gradvise karakteren av rotsekresjon, forekommer konsentrasjonen av virulensfremkallende kjemikalier produsert i planta og deres virkninger på dynamiske vekselmikrobi-interaksjoner i romlige og temporale gradienter. I dette hydroponiske co-kultiveringssystemet er ingen syntetisk fytohormon eller kjemikalie som fremkaller mikrobiell virulens eller plantebeskyttelse, supplert. I motsetning til bruk av konvensjonelle tilnærminger skaper tilsetningen av syntetiske kjemikalier, slik som acetosyringon, en p…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi vil gjerne takke Brian Weselowski og Alexander W. Eastman for deres hjelp og nyttige diskusjon. Vi vil også takke Drs. Eugene W. Nester, Lingrui Zhang, Haitao Shen, Yuhai Cui og Greg Thorn for deres hjelp, nyttige diskusjoner og kritisk lesing av manuskriptet. Denne forskningen ble finansiert av Landbruk og Agri-Food Canada, Growing Forward-AgriFlex (RBPI nummer 2555) og Growing Forward II prosjekt nummer 1670, utført av forfatterne som en del av deres oppgaver. Denne studien ble også delvis finansiert av Canadian Science and Engineering Research Council (NSERC) Discovery Grant RGPIN-2015-06052 tildelt ZC Yuan.
Materials
| plant seeds (Arabidopsis thaliana Col-0) | Arabidopsis Biological Resource Centre | CS7000 | https://abrc.osu.edu/order-stocks |
| bacteria (Agrobacterium tumefaciens C58) | University of Washington | N/A | |
| labeled bacteria | in-house | optional, depends on downstream analyses | |
| vortex | (various) | ||
| microcentrifuge tubes | (various) | ||
| microcentrifuge | (various) | ||
| 5% sodium hypochlorite | (various) | ||
| double distilled water | (various) | ||
| autoclave | (various) | ||
| micropipette | (various) | ||
| 70 % ethanol | (various) | ||
| Murashige and Skoog (MS) basal salts | Sigma-Aldrich | M5524 | |
| sucrose | (various) | ||
| MES | (various) | ||
| B5 vitamin mix | Sigma-Aldrich | G1019 | |
| phytoagar | (various) | ||
| deep Petri dishes | (various) | ||
| stainless steel mesh | Ferrier Wire Goods Company Ltd | N/A | grade: 304; mesh count: 40 × 40; wire DIA: 0.01 |
| micropore tape, 1 inch | 3M | 1530-1 | |
| diurnal growth chamber | (various) | ||
| cylindrical glass tanks, 100 × 80 mm | Pyrex | 3250 | other sizes can be used, in which case liquid content may need adjustment |
| flow hood | (various) | ||
| forcepts | (various) | ||
| yeast extract | (various) | ||
| tryptone | (various) | ||
| MgSO4 | (various) | ||
| shaking incubator | (various) | ||
| spectrophotometer | (various) | ||
| NaCl | (various) | ||
| shaker | (various) | ||
| scissors | (various) | optional, depends on downstream analyses | |
| fluorescence microscope | (various) | optional, depends on downstream analyses | |
| microscope slides and cover slips | (various) | optional, depends on downstream analyses | |
| nail polish | (various) | optional, depends on downstream analyses | |
| Bacterial RNA extraction kit | (various) | optional, depends on downstream analyses | |
| plant RNA extraction kit (RNeasy Plant Mini Kit) | Qiagen | 74903 or 74904 | optional, depends on downstream analyses |
| material and equipment for RT-qPCR | (various) | optional, depends on downstream analyses | |
| material and equipment for microarray analysis | (various) | optional, depends on downstream analyses | |
| liquid nitrogen | (various) | optional, depends on downstream analyses | |
| mortar and pestle | (various) | optional, depends on downstream analyses | |
| 0.2 µm pore filter | (various) | optional, depends on downstream analyses | |
| 50 mL conical tubes | (various) | optional, depends on downstream analyses | |
| freeze dryer | (various) | optional, depends on downstream analyses | |
| sealable test tubes | (various) | optional, depends on downstream analyses | |
| ethyl acetate | (various) | optional, depends on downstream analyses | |
| nitrogen gas | (various) | optional, depends on downstream analyses | |
| material and equipment for HPLC | (various) | optional, depends on downstream analyses | |
| material and equipment for ESI-TOF-MS | (various) | optional, depends on downstream analyses |
References
- Lambers, H., Mougel, C., Jaillard, B., Hinsinger, P. Plant-microbe-soil interactions in the rhizosphere: An evolutionary perspective. Plant Soil. 321 (1), 83-115 (2009).
- Philippot, L., Raaijmakers, J. M., Lemanceau, P., vander Putten, W. H. Going back to the roots: The microbial ecology of the rhizosphere. Nat. Rev. Microbiol. 11 (11), 789-799 (2013).
- Somers, E., Vanderleyden, J., Srinivasan, M. Rhizosphere bacterial signalling: A Love Parade beneath our feet. Crit. Rev. Microbiol. 30 (4), 205-240 (2004).
- Barah, P., Winge, P., Kusnierczyk, A., Tran, D. H., Bones, A. M. Molecular signatures in Arabidopsis thaliana in response to insect attack and bacterial infection. PLoS ONE. 8 (3), (2013).
- Zhang, J., Zhou, J. -. M. Plant immunity triggered by microbial molecular signatures. Mol. Plant. 3 (5), 783-793 (2010).
- Paterson, E., Gebbing, T., Abel, C., Sim, A., Telfer, G. Rhizodeposition shapes rhizosphere microbial community structure in organic soil. New Phytol. 173 (3), 600-610 (2006).
- Hartmann, A., Schmid, M., van Tuinen, D., Berg, G. Plant-driven selection of microbes. Plant Soil. 321 (1-2), 235-257 (2008).
- Micallef, S. A., Shiaris, M. P., Colon-Carmona, A. Influence of Arabidopsis thaliana accessions on rhizobacterial communities and natural variation in root exudates. J. Exp. Bot. 60 (6), 1729-1742 (2009).
- Burr, T., Otten, L. Crown gall of grape: Biology and disease management. Annu. Rev. Phytopathol. 37, 53-80 (2001).
- Clough, S. J., Bent, A. F. Floral dip: A simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16 (6), 735-743 (1998).
- Binns, A. N., Costantino, P., Spaink, H. P., Kondorosi, A., Hooykaas, P. J. J. The Agrobacterium oncogenes. The Rhizobiaceae. , (1998).
- Gheysen, G., Angenon, G., Van Montagu, M., Lindsey, K. Agrobacterium-mediated plant transformation: a scientifically intriguing story with significant applications. Transgenic Plant Research. , (1998).
- Valvekens, D., Von Montagu, M. V., Van Lijsebettens, M. Agrobacterium tumefaciens-mediated transformation of Arabidopsis thaliana root explants by using kanamycin selection. Proc. Natl. Acad. Sci. USA. 85 (15), 5536-5540 (1988).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283 (1999).
- Chilton, M. D., et al. Stable incorporation of plasmid DNA into higher plant cells: The molecular basis of crown gall tumorigenesis. Cell. 11 (2), 263-271 (1977).
- Gelvin, S. B. Agrobacterium in the genomics age. Plant Physiol. 150 (4), 1665-1676 (2009).
- Subramoni, S., Nathoo, N., Klimov, E., Yuan, Z. -. C. Agrobacterium tumefaciens responses to plant-derived signaling molecules. Front. Plant Sci. 5, 322 (2014).
- Yuan, Z., Liu, P., Saenkham, P., Kerr, K., Nester, E. W. Transcriptome profiling and functional analysis of Agrobacterium tumefaciens reveals a general conserved response to acidic conditions (pH 5.5) and a complex acid-mediated signaling involved in Agrobacterium-plant interactions. J. Bacteriol. 190 (2), 494-507 (2008).
- Stachel, S. E., Messens, E., Van Montagu, M., Zambryski, P. Identification of the signal molecules produced by wounded plant cells that activate T-DNA transfer in Agrobacterium tumefaciens. Nature. 318 (6047), 624-629 (1985).
- Memelink, J., de Pater, B. S., Hoge, J. H. C., Schilperoort, R. A. T-DNA hormone biosynthetic genes: Phytohormones and gene expression in plants. Dev. Genet. 8 (5-6), 321-337 (1987).
- Yuan, Z. -. C., et al. The plant signal salicylic acid shuts down expression of the vir regulon and activates quormone-quenching genes in Agrobacterium. Proc. Natl. Acad. Sci. USA. 104 (28), 11790-11795 (2007).
- Yuan, Z. -. C., Haudecoeur, E., Faure, D., Kerr, K. F., Nester, E. W. Comparative transcriptome analysis of Agrobacterium tumefaciens in response to plant signal salicylic acid, indole-3-acetic acid and γ-amino butyric acid reveals signalling cross-talk and Agrobacterium-plant co-evolution. Cell. Microbiol. 10 (11), 2339-2354 (2008).
- Li, P. L., Farrand, S. K. The replicator of the nopaline-type Ti plasmid pTiC58 is a member of the repABC family and is influenced by the TraR-dependent quorum-sensing regulatory system. J. Bacteriol. 182 (1), 179-188 (2000).
- Atkinson, M. M., Huang, J., Knopp, J. A. Hypersensitivity of suspension-cultured tobacco cells to pathogenic bacteria. Phytopathology. 75 (11), 1270-1274 (1985).
- Veena, ., Jiang, H., Doerge, R. W., Gelvin, S. B. Transfer of T-DNA and Vir proteins to plant cells by Agrobacterium tumefaciens induces expression of host genes involved in mediating transformation and suppresses host defense gene expression. Plant J. 35 (2), 219-236 (2003).
- León, J., Rojo, E., Sanchez-Serrano, J. J. Wound signalling in plants. J. Exp. Bot. 52 (354), 1-9 (2001).
- Ditt, R. F., Kerr, K. F., de Figueiredo, P., Delrow, J., Comai, L., Nester, E. W. The Arabidopsis thaliana transcriptome in response to Agrobacterium tumefaciens. Mol. Plant Microbe In. 19 (6), 665-681 (2006).
- Mandimba, G., Heulin, T., Bally, R., Guckert, A., Balandreau, J. Chemotaxis of free-living nitrogen-fixing bacteria towards maize mucilage. Plant Soil. 90 (1-3), 129-139 (1986).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiol. 148 (3), 1547-1556 (2008).
- Lee, C. W., et al. Agrobacterium tumefaciens promotes tumor induction by modulating pathogen defense in Arabidopsis thaliana. Plant Cell. 21 (9), 2948-2962 (2009).
- Reymond, P., Weber, H., Damond, M., Farmer, E. E. Differential gene expression in response to mechanical wounding and insect feeding in Arabidopsis. Plant Cell. 12 (5), 707-720 (2000).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front. Plant Sci. 5, 252 (2014).
- Alatorre-Cobos, F., et al. An improved, low-cost, hydroponic system for growing Arabidopsis and other plant species under aseptic conditions. BMC Plant Biol. 14 (1), 69 (2014).
- Conn, S. J., et al. Protocol: Optimising hydroponic growth systems for nutritional and physiological analysis of Arabidopsis thaliana and other plants. Plant Methods. 9 (1), 4 (2013).
- Nathoo, N. . Identification of putative plant defense genes using a novel hydroponic co-cultivation technique for studying plant-pathogen interaction. , (2015).
- Shaner, N. C., Campbell, R. E., Steinbach, P. A., Giepmans, B. N., Palmer, A. E., Tsien, R. Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat. Biotechnol. 22 (12), 1567-1572 (2004).
- Wise, A. A., Liu, H., Binns, A. N. Nucleic acid extraction from Agrobacterium strains. Methods Mol. Bio. 343, 67-76 (2006).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat. Protoc. 1 (3), 1559-1582 (2006).
- Salter, M. G., Conlon, H. E. Extraction of plant RNA. Methods Mol. Bio. 362, 309-314 (2007).
- Bao, Y., Wang, S., Yang, X., Li, T., Xia, Y., Meng, X. Metabolomic study of the intervention effects of Shuihonghuazi Formula, a Traditional Chinese Medicinal formulae, on hepatocellular carcinoma (HCC) rats using performance HPLC/ESI-TOF-MS. J. Ethnopharmacol. 198, 468-478 (2017).
- Korves, T. M., Bergelson, J. A developmental response to pathogen infection in Arabidopsis. Plant Physiol. 133 (1), 339-347 (2003).
- Lyons, R., Rusu, A., Stiller, J., Powell, J., Manners, J. M., Kazan, K. Investigating the association between flowering time and defense in the Arabidopsis thaliana-Fusarium oxysporum interaction. PLoS ONE. 10 (6), e0127699 (2015).
- Badri, D. V., Weir, T. L., vander Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: Plant-microbe interactions. Curr. Opin. Biotechnol. 20 (6), 642-650 (2009).
- Baerson, S. R., et al. Detoxification and transcriptome response in Arabidopsis seedlings exposed to the allelochemical benzoxazolin-2(3H)-one. J. Biol. Chem. 280 (23), 21867-21881 (2005).

