Ett hydroponisk samodlingssystem för samtidig och systematisk analys av molekylära interaktioner och signalering av växt / mikrob
Summary
Det beskrivna hydroponiska odlingssystemet stöder intakta växter med metallnätskärmar och samverkar dem med bakterier. Växtvävnad, bakterier och utsöndrade molekyler kan sedan skördas separat för nedströmsanalyser samtidigt som molekylära reaktioner hos både växtvärdar och interaktiva mikrober eller mikrobiomer kan undersökas.
Abstract
En experimentell design som efterliknar naturliga växtmikro-interaktioner är väldigt viktigt för att avgränsa de komplexa processerna för växtmikro signalering. Arabidopsis thaliana – Agrobacterium tumefaciens Ger ett utmärkt modellsystem för att studera bakteriell patogenes och växelverkan. Tidigare studier av växt -Agrobacterium- interaktioner har i stor utsträckning åberopats på växtcellssuspensionskulturer, den artificiella sårningen av växter eller den artificiella induktionen av mikrobiella virulensfaktorer eller växtskydd med syntetiska kemikalier. Emellertid skiljer sig dessa metoder från den naturliga signalen i plantan , där växter och mikrober känner igen och svarar på rumsligt och temporärt sätt. Detta arbete presenterar ett hydroponiskt odlingssystem där intakta växter stöds av metallnätskärmar och odlas med Agrobacterium . I detta odlingssystem är ingen syntetisk fytohormon eller kemikalie som inducerar micrObial virulence eller växtförsvar kompletteras. Det hydroponiska kultiveringssystemet liknar väsentligen naturliga växtmikro-interaktioner och signalerande homeostas i plantan . Växtrötter kan separeras från mediet innehållande Agrobacterium , och signaleringen och svaren hos både växtvärdarna och de interaktiva mikroberna kan undersökas samtidigt och systematiskt. Vid en given tidpunkt / intervall kan växtvävnader eller bakterier skördas separat för olika "omics" -analyser som visar effekten och effekten av detta system. Det hydroponiska kultiveringssystemet kan enkelt anpassas för att studera: 1) Gensidig signalering av olika växtmikrobiosystem, 2) Signalering mellan en växt värd och flera mikrobiella arter ( dvs mikrobiella konsortier eller mikrobiomer), 3) Hur näringsämnen och kemikalier är inblandade I växtmikro signalering, och 4) hur mikrober interagerar med växtvärdar och bidrar till växt tolerans mot biotiska oR abiotiska påfrestningar.
Introduction
Växtassocierade mikrober spelar viktiga roller inom biogeokemisk cykling, bioremediering, minskning av klimatförändringar, växttillväxt och hälsa och växt tolerans mot biotiska och abiotiska påfrestningar. Mikroorganismer interagerar med växter både direkt genom växtcellsväggkontakt och indirekt via kemisk utsöndring och signalering 1 , 2 , 3 . Som sessila organismer har växter utvecklat direkta och indirekta mekanismer för att motstå infektion med patogener. Direkta försvar inkluderar strukturella försvar och uttryck av försvarproteiner, medan indirekta försvar inkluderar sekundär växtmetabolitproduktion och attraktion av organismer som är antagonistiska mot invaderande patogener 4 , 5 . Växthärdiga rotutsprutningar, sekret, mukilager, mucigel och lysater förändrar rhizosfärens fysikalisk-kemiska egenskaper för att locka till sig eller avvisaMikrober mot sina värdar 6 . Den kemiska sammansättningen av rotsekretion är artsspecifik och tjänar därigenom som ett selektivt filter som tillåter vissa mikroorganismer som kan känna igen sådana föreningar för att blomstra i rhizosfären 6 . Således kan kompatibla mikrobiella arter stimuleras för att aktivera och förbättra deras föreningar, antingen till fördel eller nackdel för växtvärden 1 .
Förstå växelmikroskopiska interaktioner i rhizosfären är nyckeln till att förbättra växtproduktiviteten och ekosystemets funktion, eftersom en majoritet av den mikrobiella och kemiska exponeringen förekommer vid rotstrukturen och markluftsgränssnittet 2 , 6 , 7 , 8 . Undersökningen av underjordiska växt-mikrobi-interaktioner och ömsesidiga svar har dock varit en utmaning på grund av dess intrigerande Komplex och dynamisk natur och bristen på lämpliga experimentella modeller med naturlig rotstruktur och växtmorfologi under tätt kontrollerbara tillväxtförhållanden. Som ett av de mest studerade fytopathogenerna infekterar Agrobacterium ett brett sortiment av växter med jordbruks- och trädgårdsbeteende, inklusive körsbär, äpple, päron, druva och ros 9 . Agrobacterium är en viktig modellorganisme för förståelse av växtpatogen-interaktioner och är ett kraftfullt verktyg vid växtomvandling och växtteknik 10 , 11 , 12 , 13 , 14 .
Molekylära växt- Agrobacterium- interaktioner har studerats väl i flera årtionden, och den nuvarande förståelsen av Agrobacterium- patogeniciteten är omfattande 9 ,F "> 11 , 15 , 16. Agrobacteriumpatogeniteten är till stor del hänförlig till dess utvecklade förmåga att uppleva växtgenererade signaler, vilket resulterar i finmoduleringen av dess virulensprogram och cell-till-cell-kommunikation, så kallad kvorumavkänning 17 . Agrobacterium virulence-programmet regleras av flera signaler som finns tillgängliga i rhizosfären och innefattar två uppsättningar av 2-komponentsystem, ChvG / I-systemet och VirA / G-systemet. Syrabetingelser i rhizosfären aktiverar transkriptionen av chvG / I , virA / G , Och flera andra gener som är involverade i Agrobacterium- patogenitet, inklusive virE0 , virE1 , virH1 , virH2 och gener av typ VI-sekretionssystemet (T6SS) 18. Växtgenererade fenoliska föreningar, innefattande acetosyringon (4'-hydroxi-3 ', 5 '-dimetoxiacetofenon), aktivera VIrA / G 2-komponentsystem genom fosforyleringssignalmekanismer 19 . VirA / G aktiverar sedan hela vir- regulon, vilket resulterar i överföring och integration av ett ~ 20 kb bakteriellt DNA-fragment som kallas överförings-DNA (T-DNA) från sin tumörinducerande (Ti) plasmid i växtkärnan 16 . T-DNA bär gener ansvarig för syntesen av växthormonerna indol-3-ättiksyra (IAA) ( iaaM och iaaH ) och cytokinin ( ipt ) och en gång uttryckt i växtceller produceras stora mängder av dessa fytohormoner. Detta resulterar i onormal vävnadsproliferation och utveckling av växttumörer, känd som krongallsjukdom, vilket är ett kroniskt och återkommande problem för växter 9 , 11 , 20 . IAA verkar också gemensamt med salicylsyra och gamma-amino-smörsyra för att undertrycka Agrobacterium virulens eller för att minska Agrobacteriu M kvorumavkänning (QS) 17 , 21 , 22 . För att motverka denna repression, bär T-DNA också gener för opinbiosyntes, vilken aktiverar agrobacteriumkvumumavkännande för att främja Agrobacterium- patogenicitet och tjänar också som en näringskälla för patogenen 22 , 23 .
Trots en övergripande djup förståelse för Agrobacterium- plant interaktioner och den resulterande T-DNA-överföringen i växtvärden är de komplexa signaleringshändelserna vid det inledande skedet av interaktion mindre väl förstådda. Detta beror delvis på begränsningarna av konventionella tillvägagångssätt för att undersöka Agrobacterium- plantsignalering. Växtcellssuspensionskulturer och artificiell platsspecifik sårning används vanligen för att studera molekylära växt-mikrobe-interaktioner 24 ,Ef "> 26 , 27. Cellsuspensioner saknar typiskt växtmorfologi, i synnerhet har plantesuspensionsceller inte rotstrukturer och rotutsöndringar, vilka är mycket viktiga för aktivering av mikrobiell kemotax och virulens 28 , 29. Behållandet av växtmorfologi Och rotstruktur har behandlats av artificiellt sårande växter, vilket underlättar platsspecifik infektion, vilket resulterar i detektion av inducerade växtförsvarsrelaterade gener i direkt infekterad vävnad 30 , 31. Men artificiell sårning skiljer sig signifikant från patogeninfektion i naturen , Speciellt som att sår leder till ackumulering av jasmonsyra (JA), som systemiskt stör naturligt växtsignalering och försvar 26. Dessutom används syntetiska kemikalier typiskt för att artificiellt inducera växtvärdesreaktionerEller patogen virulens. Även om tillägget av sådana kemiska föreningar som reflekterar koncentrationer i plantan är möjligt, svarar sådant tillskott inte för diffusion av rotutsprutning gradvis i den omgivande rhizosfären, vilken alstrar en kemotaktisk gradient som avkännes av mikrober 28 , 32 . Med tanke på begränsningarna av konventionella metoder för att studera växelmikroskopiska interaktioner kan noggrannheten och djupet hos de erhållna data hindras och begränsas, och kunskapen som genereras av konventionella metoder kan inte översättas direkt i plantan . Många aspekter av växt- Agrobacterium- signaleringen är ännu inte helt förstådda, särskilt i det tidiga skedet av interaktioner, när sjukdomssymptomerna ännu inte har utvecklats.
För att ändra gränserna för konventionella tillvägagångssätt presenterar detta arbete en billig, tätt kontrollerbar och flexibel hydroponisk cOdlingssystem som gör det möjligt för forskare att få djupare insikter i de komplexa signal- och reaktionsvägarna vid det inledande skedet av molekylära växtmikro-interaktioner. Hydroponics har använts i stor utsträckning för att studera växtnäringsämnen, rotutsöndringar, tillväxtförhållanden och effekterna av metallisk toxicitet på växter 33 , 34 . Det finns flera fördelar med hydroponiska modeller, inklusive de små rumsliga kraven, tillgången till olika vävnader, den täta kontrollen av näringsämnen / miljöförhållandena och skadedjursbekämpningen. Hydroponiska system är också mindre begränsande för växttillväxt i jämförelse med agar / fytoagarpläteringstekniker, som typiskt begränsar tillväxten efter 2-3 veckor. Viktigt är att underhållet av helplanta strukturer underlättar den naturliga rotsekretionen som är nödvändig för mikrobiell kemotax och virulensinduktion 8 , 29 . Systemet beskrivsSängen här är enklare och mindre arbetsintensiv än alternativen 33 , 34 . Det använder färre delar och kräver inga andra verktyg än standard sax. Det använder metallnät (i motsats till nylon 33 ) som ett starkt stöd för växttillväxt och en enkel metod för luftning under sterila betingelser genom att skaka för att stödja mikrobiell tillväxt. Dessutom kan systemet använda metallnät av olika storlekar för att stödja växttillväxt, vilket rymmer olika växtarter utan att begränsa bredden på sina rötter.
I det hydroponiska odlingssystemet som presenteras här odlas växter i ett sterilt hydroponiskt system där växtrötterna utsöndrar organiska föreningar som stöder tillväxten av inokulerade bakterier. I detta odlingssystem kompletteras inga konstgjorda kemikalier, såsom växthormoner, försvar elicitor eller virulence-inducerande kemikalier, vilket återspeglar den naturliga cellenSignalerande homeostas under interaktioner mellan växter och mikroorganismer. Med detta hydroponiska kultiveringssystem var det möjligt att samtidigt bestämma genuttryck i Arabidopsis thaliana Col-0-vävnad vid infektion med Agrobacterium , såväl som aktiveringen av Agrobacterium- gener vid odling med Arabidopsis . Det visades vidare att detta system är lämpligt att studera Agrobacterium- bindning till växtrotsar, liksom växtrodssekretomprofilen, vid odling (infektion) med Agrobacterium ( Figur 1 ).
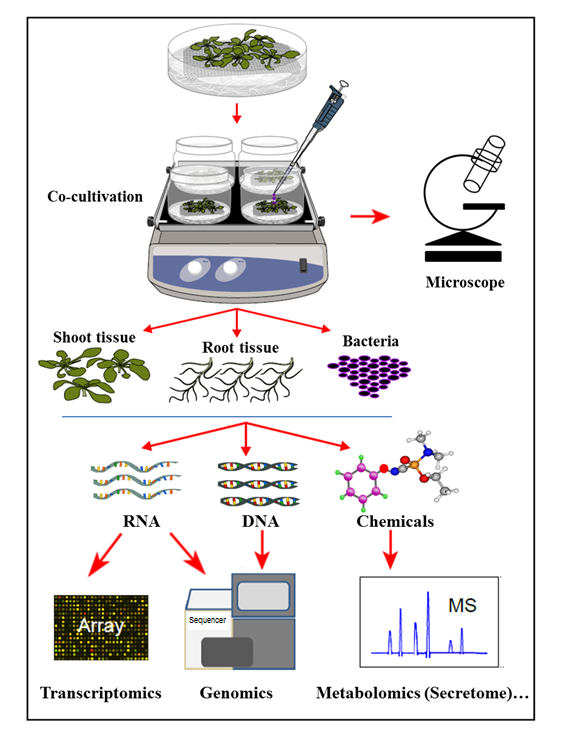
Figur 1: Översikt över det hydroponiska kultiveringssystemet, med provanalyser. Växter odlas på nätet (skott över nätet), med rötterna nedsänkta i hydroponiskt medium som sedan inokuleras med bakterier fEller odling. Växtvävnader och bakterier separeras sedan för samtidiga extraktioner och analyser. Denna siffra har ändrats från referens 35 .
Protocol
Representative Results
Discussion
Med tanke på den gradvisa karaktären av rotsekretion förekommer koncentrationen av virulensinducerande kemikalier som produceras i plantan och deras effekter på dynamiska växelmikro-interaktioner i rumsliga och temporala gradienter. I detta hydroponiska samodlingssystem kompletteras ingen syntetisk fytohormon eller kemikalie som inducerar mikrobiell virulens eller växtskydd. I motsats härtill skapar tillsatsen av syntetiska kemikalier, såsom acetosyringon, en plötslig artificiell spik i koncentrationer…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi vill tacka Brian Weselowski och Alexander W. Eastman för deras hjälp och användbara diskussioner. Vi vill också tacka Drs. Eugene W. Nester, Lingrui Zhang, Haitao Shen, Yuhai Cui och Greg Thorn för deras hjälp, användbara diskussioner och kritisk läsning av manuskriptet. Denna forskning finansierades av Agriculture and Agri-Food Canada, Growing Forward-AgriFlex (RBPI nummer 2555) och Growing Forward II-projekt nummer 1670, som författarna utför som en del av sina uppgifter. Denna studie finansierades också delvis av Canadian Science and Engineering Research Council (NSERC) Discovery Grant RGPIN-2015-06052 tilldelad ZC Yuan.
Materials
| plant seeds (Arabidopsis thaliana Col-0) | Arabidopsis Biological Resource Centre | CS7000 | https://abrc.osu.edu/order-stocks |
| bacteria (Agrobacterium tumefaciens C58) | University of Washington | N/A | |
| labeled bacteria | in-house | optional, depends on downstream analyses | |
| vortex | (various) | ||
| microcentrifuge tubes | (various) | ||
| microcentrifuge | (various) | ||
| 5% sodium hypochlorite | (various) | ||
| double distilled water | (various) | ||
| autoclave | (various) | ||
| micropipette | (various) | ||
| 70 % ethanol | (various) | ||
| Murashige and Skoog (MS) basal salts | Sigma-Aldrich | M5524 | |
| sucrose | (various) | ||
| MES | (various) | ||
| B5 vitamin mix | Sigma-Aldrich | G1019 | |
| phytoagar | (various) | ||
| deep Petri dishes | (various) | ||
| stainless steel mesh | Ferrier Wire Goods Company Ltd | N/A | grade: 304; mesh count: 40 × 40; wire DIA: 0.01 |
| micropore tape, 1 inch | 3M | 1530-1 | |
| diurnal growth chamber | (various) | ||
| cylindrical glass tanks, 100 × 80 mm | Pyrex | 3250 | other sizes can be used, in which case liquid content may need adjustment |
| flow hood | (various) | ||
| forcepts | (various) | ||
| yeast extract | (various) | ||
| tryptone | (various) | ||
| MgSO4 | (various) | ||
| shaking incubator | (various) | ||
| spectrophotometer | (various) | ||
| NaCl | (various) | ||
| shaker | (various) | ||
| scissors | (various) | optional, depends on downstream analyses | |
| fluorescence microscope | (various) | optional, depends on downstream analyses | |
| microscope slides and cover slips | (various) | optional, depends on downstream analyses | |
| nail polish | (various) | optional, depends on downstream analyses | |
| Bacterial RNA extraction kit | (various) | optional, depends on downstream analyses | |
| plant RNA extraction kit (RNeasy Plant Mini Kit) | Qiagen | 74903 or 74904 | optional, depends on downstream analyses |
| material and equipment for RT-qPCR | (various) | optional, depends on downstream analyses | |
| material and equipment for microarray analysis | (various) | optional, depends on downstream analyses | |
| liquid nitrogen | (various) | optional, depends on downstream analyses | |
| mortar and pestle | (various) | optional, depends on downstream analyses | |
| 0.2 µm pore filter | (various) | optional, depends on downstream analyses | |
| 50 mL conical tubes | (various) | optional, depends on downstream analyses | |
| freeze dryer | (various) | optional, depends on downstream analyses | |
| sealable test tubes | (various) | optional, depends on downstream analyses | |
| ethyl acetate | (various) | optional, depends on downstream analyses | |
| nitrogen gas | (various) | optional, depends on downstream analyses | |
| material and equipment for HPLC | (various) | optional, depends on downstream analyses | |
| material and equipment for ESI-TOF-MS | (various) | optional, depends on downstream analyses |
References
- Lambers, H., Mougel, C., Jaillard, B., Hinsinger, P. Plant-microbe-soil interactions in the rhizosphere: An evolutionary perspective. Plant Soil. 321 (1), 83-115 (2009).
- Philippot, L., Raaijmakers, J. M., Lemanceau, P., vander Putten, W. H. Going back to the roots: The microbial ecology of the rhizosphere. Nat. Rev. Microbiol. 11 (11), 789-799 (2013).
- Somers, E., Vanderleyden, J., Srinivasan, M. Rhizosphere bacterial signalling: A Love Parade beneath our feet. Crit. Rev. Microbiol. 30 (4), 205-240 (2004).
- Barah, P., Winge, P., Kusnierczyk, A., Tran, D. H., Bones, A. M. Molecular signatures in Arabidopsis thaliana in response to insect attack and bacterial infection. PLoS ONE. 8 (3), (2013).
- Zhang, J., Zhou, J. -. M. Plant immunity triggered by microbial molecular signatures. Mol. Plant. 3 (5), 783-793 (2010).
- Paterson, E., Gebbing, T., Abel, C., Sim, A., Telfer, G. Rhizodeposition shapes rhizosphere microbial community structure in organic soil. New Phytol. 173 (3), 600-610 (2006).
- Hartmann, A., Schmid, M., van Tuinen, D., Berg, G. Plant-driven selection of microbes. Plant Soil. 321 (1-2), 235-257 (2008).
- Micallef, S. A., Shiaris, M. P., Colon-Carmona, A. Influence of Arabidopsis thaliana accessions on rhizobacterial communities and natural variation in root exudates. J. Exp. Bot. 60 (6), 1729-1742 (2009).
- Burr, T., Otten, L. Crown gall of grape: Biology and disease management. Annu. Rev. Phytopathol. 37, 53-80 (2001).
- Clough, S. J., Bent, A. F. Floral dip: A simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16 (6), 735-743 (1998).
- Binns, A. N., Costantino, P., Spaink, H. P., Kondorosi, A., Hooykaas, P. J. J. The Agrobacterium oncogenes. The Rhizobiaceae. , (1998).
- Gheysen, G., Angenon, G., Van Montagu, M., Lindsey, K. Agrobacterium-mediated plant transformation: a scientifically intriguing story with significant applications. Transgenic Plant Research. , (1998).
- Valvekens, D., Von Montagu, M. V., Van Lijsebettens, M. Agrobacterium tumefaciens-mediated transformation of Arabidopsis thaliana root explants by using kanamycin selection. Proc. Natl. Acad. Sci. USA. 85 (15), 5536-5540 (1988).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283 (1999).
- Chilton, M. D., et al. Stable incorporation of plasmid DNA into higher plant cells: The molecular basis of crown gall tumorigenesis. Cell. 11 (2), 263-271 (1977).
- Gelvin, S. B. Agrobacterium in the genomics age. Plant Physiol. 150 (4), 1665-1676 (2009).
- Subramoni, S., Nathoo, N., Klimov, E., Yuan, Z. -. C. Agrobacterium tumefaciens responses to plant-derived signaling molecules. Front. Plant Sci. 5, 322 (2014).
- Yuan, Z., Liu, P., Saenkham, P., Kerr, K., Nester, E. W. Transcriptome profiling and functional analysis of Agrobacterium tumefaciens reveals a general conserved response to acidic conditions (pH 5.5) and a complex acid-mediated signaling involved in Agrobacterium-plant interactions. J. Bacteriol. 190 (2), 494-507 (2008).
- Stachel, S. E., Messens, E., Van Montagu, M., Zambryski, P. Identification of the signal molecules produced by wounded plant cells that activate T-DNA transfer in Agrobacterium tumefaciens. Nature. 318 (6047), 624-629 (1985).
- Memelink, J., de Pater, B. S., Hoge, J. H. C., Schilperoort, R. A. T-DNA hormone biosynthetic genes: Phytohormones and gene expression in plants. Dev. Genet. 8 (5-6), 321-337 (1987).
- Yuan, Z. -. C., et al. The plant signal salicylic acid shuts down expression of the vir regulon and activates quormone-quenching genes in Agrobacterium. Proc. Natl. Acad. Sci. USA. 104 (28), 11790-11795 (2007).
- Yuan, Z. -. C., Haudecoeur, E., Faure, D., Kerr, K. F., Nester, E. W. Comparative transcriptome analysis of Agrobacterium tumefaciens in response to plant signal salicylic acid, indole-3-acetic acid and γ-amino butyric acid reveals signalling cross-talk and Agrobacterium-plant co-evolution. Cell. Microbiol. 10 (11), 2339-2354 (2008).
- Li, P. L., Farrand, S. K. The replicator of the nopaline-type Ti plasmid pTiC58 is a member of the repABC family and is influenced by the TraR-dependent quorum-sensing regulatory system. J. Bacteriol. 182 (1), 179-188 (2000).
- Atkinson, M. M., Huang, J., Knopp, J. A. Hypersensitivity of suspension-cultured tobacco cells to pathogenic bacteria. Phytopathology. 75 (11), 1270-1274 (1985).
- Veena, ., Jiang, H., Doerge, R. W., Gelvin, S. B. Transfer of T-DNA and Vir proteins to plant cells by Agrobacterium tumefaciens induces expression of host genes involved in mediating transformation and suppresses host defense gene expression. Plant J. 35 (2), 219-236 (2003).
- León, J., Rojo, E., Sanchez-Serrano, J. J. Wound signalling in plants. J. Exp. Bot. 52 (354), 1-9 (2001).
- Ditt, R. F., Kerr, K. F., de Figueiredo, P., Delrow, J., Comai, L., Nester, E. W. The Arabidopsis thaliana transcriptome in response to Agrobacterium tumefaciens. Mol. Plant Microbe In. 19 (6), 665-681 (2006).
- Mandimba, G., Heulin, T., Bally, R., Guckert, A., Balandreau, J. Chemotaxis of free-living nitrogen-fixing bacteria towards maize mucilage. Plant Soil. 90 (1-3), 129-139 (1986).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiol. 148 (3), 1547-1556 (2008).
- Lee, C. W., et al. Agrobacterium tumefaciens promotes tumor induction by modulating pathogen defense in Arabidopsis thaliana. Plant Cell. 21 (9), 2948-2962 (2009).
- Reymond, P., Weber, H., Damond, M., Farmer, E. E. Differential gene expression in response to mechanical wounding and insect feeding in Arabidopsis. Plant Cell. 12 (5), 707-720 (2000).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front. Plant Sci. 5, 252 (2014).
- Alatorre-Cobos, F., et al. An improved, low-cost, hydroponic system for growing Arabidopsis and other plant species under aseptic conditions. BMC Plant Biol. 14 (1), 69 (2014).
- Conn, S. J., et al. Protocol: Optimising hydroponic growth systems for nutritional and physiological analysis of Arabidopsis thaliana and other plants. Plant Methods. 9 (1), 4 (2013).
- Nathoo, N. . Identification of putative plant defense genes using a novel hydroponic co-cultivation technique for studying plant-pathogen interaction. , (2015).
- Shaner, N. C., Campbell, R. E., Steinbach, P. A., Giepmans, B. N., Palmer, A. E., Tsien, R. Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat. Biotechnol. 22 (12), 1567-1572 (2004).
- Wise, A. A., Liu, H., Binns, A. N. Nucleic acid extraction from Agrobacterium strains. Methods Mol. Bio. 343, 67-76 (2006).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat. Protoc. 1 (3), 1559-1582 (2006).
- Salter, M. G., Conlon, H. E. Extraction of plant RNA. Methods Mol. Bio. 362, 309-314 (2007).
- Bao, Y., Wang, S., Yang, X., Li, T., Xia, Y., Meng, X. Metabolomic study of the intervention effects of Shuihonghuazi Formula, a Traditional Chinese Medicinal formulae, on hepatocellular carcinoma (HCC) rats using performance HPLC/ESI-TOF-MS. J. Ethnopharmacol. 198, 468-478 (2017).
- Korves, T. M., Bergelson, J. A developmental response to pathogen infection in Arabidopsis. Plant Physiol. 133 (1), 339-347 (2003).
- Lyons, R., Rusu, A., Stiller, J., Powell, J., Manners, J. M., Kazan, K. Investigating the association between flowering time and defense in the Arabidopsis thaliana-Fusarium oxysporum interaction. PLoS ONE. 10 (6), e0127699 (2015).
- Badri, D. V., Weir, T. L., vander Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: Plant-microbe interactions. Curr. Opin. Biotechnol. 20 (6), 642-650 (2009).
- Baerson, S. R., et al. Detoxification and transcriptome response in Arabidopsis seedlings exposed to the allelochemical benzoxazolin-2(3H)-one. J. Biol. Chem. 280 (23), 21867-21881 (2005).

