In Vitro Coltivazione dell'ovulo per Live cell Imaging di zigote polarizzazione e Patterning di embrione in Arabidopsis thaliana
Summary
Questo manoscritto descrive un in vitro dell’ovulo metodo di coltivazione che permette l’imaging di cellule vive di Arabidopsis zigoti ed embrioni. Questo metodo viene utilizzato per visualizzare le dinamiche intracellulare durante la polarizzazione di zigote e la specifica di destino delle cellule nello sviluppo di embrioni.
Abstract
Nella maggior parte delle piante da fiore, lo zigote ed embrione sono nascosti nel profondo del tessuto di madre, e così è stato a lungo un mistero di come si sviluppano in modo dinamico; ad esempio, come lo zigote polarizza per stabilire l’asse del corpo e come l’embrione specifica vari destini delle cellule durante la formazione dell’organo. Questo manoscritto descrive un in vitro dell’ovulo cultura metodo per eseguire la formazione immagine di cellule vive di sviluppare zigoti ed embrioni di Arabidopsis thaliana. Il medium di coltivazione ottimizzato permette di zigoti o embrioni in anticipo a crescere nelle piante fertili. Attraverso la combinazione con un dispositivo di matrice micropillar poly(dimethylsiloxane) (PDMS), l’ovulo si svolge nel liquido di coltura nella stessa posizione. Questo sistema di fissaggio è fondamentale per osservare l’ovulo stesso sotto un microscopio per diversi giorni dalla divisione zygotic per la fine della fase embrionale. L’imaging di vivere-cella risultante consente di monitorare le dinamiche in tempo reale di polarizzazione di zigote, quali migrazione nucleare e riarrangiamento del citoscheletro e anche i tempi di divisione cellulare e specifica di destino delle cellule durante il patterning di embrione. Inoltre, questo sistema di coltivazione dell’ovulo possa essere combinato con trattamenti inibitore per analizzare gli effetti di vari fattori per lo sviluppo dell’embrione e con ottiche manipolazioni come rottura di laser per esaminare il ruolo della comunicazione cellula-cellula.
Introduction
Il piano di base del corpo di un organismo si sviluppa da uno zigote unicellulare. Nella maggior parte delle piante da fiore, divisione zygotic genera un apicale e delle cellule basali, che si sviluppano nella radice, rispettivamente1e sparare. Pertanto, è importante capire come il corpo di pianta si forma durante l’embriogenesi, ma non c’è stato uno strumento efficace per osservare direttamente le dinamiche della vita zigoti ed embrioni perché si sviluppano nel profondo il fiore. In varie specie di monocotiledoni, come mais e riso, un metodo di fecondazione in vitro è stato stabilito2,3. In questo metodo, le cellule uovo e dello sperma isolato sono fuse elettricamente o chimicamente, e la cella generata può svilupparsi in una pianta fertile. Tuttavia, nelle piante dicotiledoni, non c’è nessun in vitro fertilizzazione metodo che può produrre embrioni corretta, presumibilmente a causa dello stato non sincronizzate ciclo cellulare di gameti maschili e femminili4,5. Inoltre, il tessuto che circonda embrione (endosperma) svolge i ruoli importanti nell’embrione di sviluppo6.
In una specie di modello dicotilene, a. thaliana, un metodo di coltivazione in vitro è stato sviluppato focalizzando l’attenzione sull’ovulo intero, che contiene l’embrione e l’endosperma7. Questo sistema è stato usato con successo per analizzare gli effetti di vari agenti chimici su embriogenesi, ma non è adatto per l’imaging di time-lapse perché ha un basso tasso di sopravvivenza. Di conseguenza, un sistema di coltivazione del ovulo romanzo in vitro è stato sviluppato al fine di avviare più presto la stadio di zigote e producono piante fertili in un alto rapporto8. Dopo varie prove, è stato trovato quel mezzo di Nitsch e trealosio ha migliorato significativamente il tasso di sopravvivenza di ovuli8. Inoltre, perché l’ovulo si espande come cresce e così spesso si sposta lontano dal campo di osservazione del microscopio, un dispositivo PDMS è stato sviluppato per risolvere l’ovulo in media9. Il dispositivo PDMS abilitato l’imaging a lungo termine per 3-4 giorni, che è sufficiente per tracciare lo sviluppo da uno zigote, un embrione di cuore-fase. Utilizzando questo metodo, diventa possibile visualizzare le dinamiche di polarizzazione di zigote ed embrione patterning, non solo in condizioni normali, ma anche in presenza di inibitori chimici o in vari ambiti di provenienza mutante8,10 ,11.
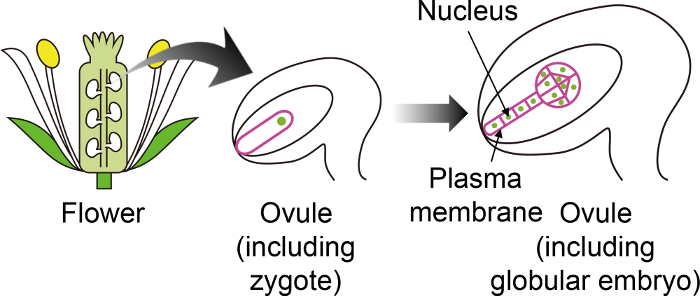
Figura 1: Diagramma schematico dei marcatori fluorescenti specifici utilizzati per visualizzare zigoti ed embrioni attraverso l’ovulo.
Lo zigote Arabidopsis si sviluppa in un embrione nell’ovulo, che viene generato profondo all’interno del fiore. In questo sistema in vitro coltura, lo zigote ed embrione sono osservati attraverso l’ovulo, e quindi è importante utilizzare marcatori fluorescenti specifici che non sono espressi in altri tessuti dell’ovulo. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Questo manoscritto presenta un semplice in vitro dell’ovulo coltivazione protocollo che è efficiente per l’uso nell’imaging di cellule vive di sviluppare zigoti e degli embrioni.
Il design del dispositivo PDMS potrebbe bisogno di ottimizzazione secondo allo stadio embrionale. Il primo dispositivo sviluppato era una gamma di microcage per regolare l’orientamento e per fissare la posizione di ovuli9, e quindi un dispositivo di micropillar è stato costruito per …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Microscopia in questo lavoro è stato condotto presso l’Istituto di Transformative Bio-molecole (WPI-ITbM) dell’Università di Nagoya e supportata dal Giappone Advanced Plant Science Network. Questo lavoro è stato sostenuto da sovvenzioni dal Japan Science and Technology Agency (progetto ERATO T.H. e M.U.) e la Japan Society per la promozione della scienza: una sovvenzione per la ricerca scientifica in settori innovativi (Nos. JP24113514, JP26113710, JP15H05962 e JP15H05955 per M.U. e Nos. JP16H06465, JP16H06464 e JP16K21727 per Tartaglia), una sovvenzione per giovani scienziati (B, Nos. JP24770045 e JP26840093 per M.U.) e una sovvenzione per impegnativa ricerca esplorativa (No. JP16K14753 per M.U.).
Materials
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
References
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).

