Vitro Zigot polarizasyon, Live-hücre görüntüleme ve Arabidopsis thaliana embriyo desenlendirme için ovule ekimi
Summary
Bu el yazması Arabidopsis zigotları ve embriyo canlı hücre görüntüleme sağlar bir vitro ovule yetiştirme yöntemini açıklar. Bu yöntem sırasında zigot polarizasyon hücre içi dinamikleri ve gelişmekte olan embriyo hücre kader belirtimi görselleştirmek için kullanılmaktadır.
Abstract
Çoğu çiçekli bitkiler, zigot ve embriyo anne dokuda derin gizlenir ve böylece uzun nasıl dinamik olarak geliştirmek bir gizem olmuştur; Örneğin, nasıl vücut eksen kurmak için zigot polarizes ve nasıl embriyo organ oluşumu sırasında çeşitli hücre kaderi belirtir. Bu el yazması bir vitro ovule kültür yöntemi zigotları ve embriyoların Arabidopsis thalianageliştirme canlı hücre görüntüleme gerçekleştirmek için açıklar. En iyi duruma getirilmiş ekimi orta zigotları veya erken embriyo bereketli bitkiler büyümek için izin verir. Poly(dimethylsiloxane) (PDMS) micropillar dizi aygıtı ile birleştirerek, ovule aynı konumda sıvı ortamda tutulur. Bu fiksasyon bir mikroskop altında aynı ovule geç embriyo aşamasına zygotic bölümden birkaç gün gözlemlemek çok önemlidir. Elde edilen canlı hücre görüntüleme zigot polarizasyon, nükleer geçiş ve sitoiskeleti düzenlenmesi ve aynı zamanda hücre bölünmesi zamanlama ve hücre kader belirtimi embriyo desenlendirme sırasında gibi gerçek zamanlı dinamikleri izlemek için kullanılabilir. Ayrıca, bu ovule yetiştirme sistemi çeşitli faktörlerin etkilerini embriyo gelişimini incelemek için önleyici tedaviler ile ve hücre-hücre iletişim rolü incelemek için lazer bozulma gibi optik manipülasyonlar ile birleştirilebilir.
Introduction
Bir organizmanın temel vücut planı tek hücreli bir zigot geliştirir. Çoğu çiçekli bitkilerde bir apikal ve ateş ve kök, sırasıyla1geliştirmek bir Bazal Hücre zygotic bölümü oluşturur. Bu nedenle, bitki vücut embriyogenez sırasında nasıl oluştuğunu anlamak önemlidir, ancak değil onlar derin çiçek geliştirmek çünkü doğrudan oturma zigotları ve embriyo dinamiklerini gözlemlemek için etkili bir araç olmuştur. Mısır ve pirinç, gibi birçok monocot türü bir vitro fertilizasyon yöntemi kurulan2,3olmuştur. Bu yöntemde, izole sperm ve yumurta hücreleri elektriksel olarak veya kimyasal olarak erimiş ve oluşturulan hücre bereketli bir bitki gelişebilir. Ancak, dicot bitkiler, uygun embriyolar, muhtemelen kadın ve erkek gamet4,5senkronize olmayan hücre döngüsü durumu nedeniyle üretebilir yok vitro fertilizasyon yöntemi yoktur. Buna ek olarak, embriyo çevreleyen doku (endosperm) embriyo gelişimi6‘ önemli rol oynar.
Bir modeli dicot tür, A. thaliana, vitro ekimi yöntemi embriyo ve endosperm7içeren tüm ovule üzerinde odaklanarak tarafından geliştirilmiştir. Bu sistem başarıyla embriyogenez çeşitli kimyasal reaktifler etkilerini çözümlemek için kullanılan, ancak düşük sağkalım oranı olduğundan zaman hata görüntüleme için uygun değildir. Bu nedenle, bir roman vitro ovule yetiştirme sistemi zigot sahne olarak erken başlamak ve yüksek oranı8bereketli bitkiler üretmek amacıyla geliştirilmiştir. Çeşitli denemeler sonra o Nitsch orta bulundu ve trehalose ovules8survival oranı önemli ölçüde geliştirilmiş. Buna ek olarak, bu büyür ve bu nedenle sık sık mikroskop gözlem alanı uzak taşır ovule genişletir çünkü PDMS aygıt ovule orta9‘ düzeltmek için geliştirilmiştir. PDMS aygıt bir zigot geliştirmeden kalp-sahne embriyo için izlemek yeterli için 3-4 gün, uzun vadeli görüntüleme etkin. Bu yöntemi kullanarak, zigot polarizasyon ve biçimlenme, sadece normal koşullar altında ama aynı zamanda kimyasal inhibitörleri varlığında veya çeşitli mutant arka planlar8,10 embriyo dinamiklerini görselleştirmek mümkün olur ,11.
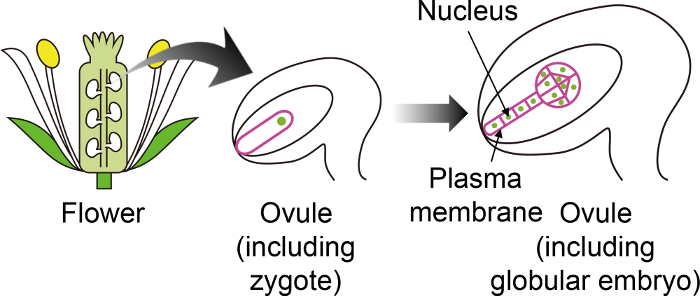
Resim 1: Belirli floresan zigotları görselleştirmek ve Ovule aracılığıyla embriyolar için kullanılan veri işaretleyicilerini şematik diyagramı.
Derin çiçek içinde oluşturulan ovule bir embriyo içine Arabidopsis zigot geliştirir. Bu vitro yetiştirme sisteminde zigot ve embriyo ile ovule gözlenir ve böylece diğer ovule dokularda ifade değil belirli floresan işaretçileri kullanmak önemlidir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Protocol
Representative Results
Discussion
Bu el yazması zigotları ve embriyo geliştirme canlı hücre görüntülemede etkilidir bir basit vitro ovule ekimi protokol tanıttı.
PDMS aygıt tasarım optimizasyonu embriyo sahne göre gerekebilir. Bir microcage dizi yönlendirmesini ayarlamak için ve ovules9konumunu düzeltmek için ilk geliştirilen cihaz olduğunu ve o zaman micropillar aygıt ovules daha verimli bir şekilde yakalamak için inşa edilmiş8. Ayrıca, micropil…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu çalışmada mikroskobu Enstitüsü, dönüştürücü biyo-molekülleri, (TEFE-ITbM) Nagoya Üniversitesi yapıldı ve Japonya gelişmiş bitki bilim şebeke tarafından desteklenmesi. Bu eser bilim promosyon için hibe Japonya bilim ve teknoloji Ajansı (ERATO T.H. ve M.U. projeye) ve Japonya toplum tarafından desteklenmiştir: yenilikçi alanlar (‘ları üzerinde bilimsel araştırma için bir Grant-in-Aid JP24113514, JP26113710, JP15H05962 ve JP15H05955 M.U. ve Nos için. JP16H06465, JP16H06464 ve JP16K21727-T.H için), bir Grant-in-Aid genç bilim adamları (B, Nos. JP24770045 ve JP26840093 M.U. için) ve bir Grant-in-Aid zorlu araştırmacı araştırma (No. M.U. için JP16K14753).
Materials
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
References
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).

