Facile Protocol voor de synthese van het zelf monteren van Peptide Polyamine gebaseerde amfifielen (PPA) en verwante biomaterialen
Summary
De synthese van peptide polyamine gebaseerde amfifielen (PPA) is een grote uitdaging wegens de aanwezigheid van meerdere amine stikstofatomen, waarvoor oordeelkundig gebruik om groepen te maskeren deze reactieve functionaliteiten te beschermen. In deze paper beschrijven we een facile methode voor de bereiding van deze nieuwe klasse van zelfassemblerende moleculen.
Abstract
Polyamine gebaseerde Peptide amfifielen (PPA) zijn een nieuwe klasse van zelfassemblerende amfifiele verband houden met biomaterialen naar de peptide amfifielen (BK). Traditionele PAs bezitten geladen aminozuren als solubilizing groepen (lysine, arginine), die rechtstreeks zijn verbonden met een lipide-segment of een regio van de linker gemaakt van neutrale aminozuren kunnen bevatten. Afstemmen van de peptide opeenvolging van PAs kan diverse morphologies opleveren. Evenzo PPA een hydrofobe segment en neutrale aminozuren bezitten, maar bevatten ook polyamine moleculen als water (hydrofiel) groepen solubilizing. Zoals het geval met PAs, kunnen PPA ook zelf samenstellen in diverse morphologies, waaronder kleine staven, gedraaide nano-linten en gesmolten nano-bladen, wanneer opgelost in water. Echter uitdaging de aanwezigheid van zowel de primaire als de secundaire amines op een enkele polyamine molecuul een aanzienlijke als synthese van de PPA. In deze paper tonen we een eenvoudig protocol, op basis van literatuur precedenten, om een facile synthese van PPA met behulp van solid-phase peptide synthese (SPPS). Dit protocol kan worden uitgebreid tot de synthese van PAs en andere soortgelijke systemen. We illustreren ook de stappen die nodig zijn voor splijten van de hars, identificatie en zuivering.
Introduction
Zelfassemblerende peptide amfifielen (BK) vormen een klasse van biomaterialen meestal bestaat uit de volgende segmenten: (a) de hydrofiele kop, (b) de linker regio en (c) hydrofobe staart. Meeste PAs in de literatuur beschreven bezitten een hydrofiele kop bestaat uit geladen of polar aminozuur residuen1,2,3,4. PAs heb een brede waaier van toepassingen in biologie met inbegrip van de levering van de drug, diagnose van de ziekte, regeneratieve geneeskunde, etc.5. Op basis van de volgorde van hun aminozuur, kan PAs een grote verscheidenheid van nanostructuren waaronder sferische micellen en nano-filamenten vormen. We hebben onlangs gemeld dat een klasse van hybride peptide polyamine gebaseerde amfifielen, PPA6genoemd. De morphologies, zelfassemblerende kinetiek en metabole afbraak, van deze biomaterialen, bleken te worden gerelateerd aan hun solubilizing hoofd groep. Bovendien, de PPA nanostructuren toonde geen toxiciteit naar zoogdiercellen (MiaPaCa2 en HeLa cellen lijnen) bij de geteste concentraties. PPA gebaseerde nanocarriers zijn aantrekkelijke drug-leverende voertuigen omdat: (1) polyamine opname en metabolisme is aangetoond dat de kankercellen worden verhoogd, (2) kationische nanostructuren kunt bereiken endosomal escape7,8, wat leidt tot hogere verkeer en het verblijf binnen een cel, en (3) zij moeten een verschillende metabole profiel in vergelijking met PA; bijvoorbeeld, zullen zij meer stabiele naar proteasen gevonden in het menselijk lichaam (hoewel ze misschien gevoelig voor andere enzymen, zoals amine oxidasen)9,10. Ook PPA gevonden te hebben uiteenlopende morphologies, fysisch-chemische eigenschappen, nanoparticle stijfheid en kinetiek van de assemblage afhankelijk van de lengte en kosten van individuele PPA molecuul6. Hierin beschrijven we een gedetailleerd protocol voor de synthese, identificatie en zuivering van de ppa die kunnen ook worden toegepast aan de voorbereiding van de PAs of soortgelijke hybride peptide moleculen.
Omdat polyaminen zijn niet algemeen verkrijgbare in hun beschermde vormen, en omdat het beschermen van de primaire en secundaire amines van polyaminen is van het grootste belang voor het conjugating hen met aminozuren en andere moleculen, we hebben geschetst de synthetische stappen om te komen tot hun bescherming. Het algemene doel van dit protocol is bedoeld als een eenvoudige methode voor het conjugating van polyaminen aminozuren. Polyaminen ontbreken een carboxylic groep; Dus, ze kunnen niet worden gekoppeld aan Rink Amide of Wang harsen. In plaats daarvan, harsen zoals 2-chlorotrityl chloride worden aanbevolen voor het synthetische protocol. De belangrijkste uitdaging voor de synthese van de PPA is de aanwezigheid van primaire en secundaire amine functionele groepen. Voor onze doeleinden beschermd we alle de secundaire amines in de polyamine terwijl de primaire aminogroep op de polyamine gratis toe de reactie van de koppeling. De reactie werd gedaan op een stevige steun na de principes van vaste fase peptide synthese (SPPS) om de werk-up na elke stap koppeling en deprotection. Het volgende protocol is voor zowel de handmatige en geautomatiseerde synthese van ppa (hoewel de verificatie van het aantal stappen zal worden uitdagend in een geautomatiseerd systeem). De synthese van deze moleculen kan ook worden verricht op een geautomatiseerde synthesizer of met behulp van een magnetron-reactor (automatische of semi-automatisch). De reactie-regeling heeft is samengevat in Figuur 1.
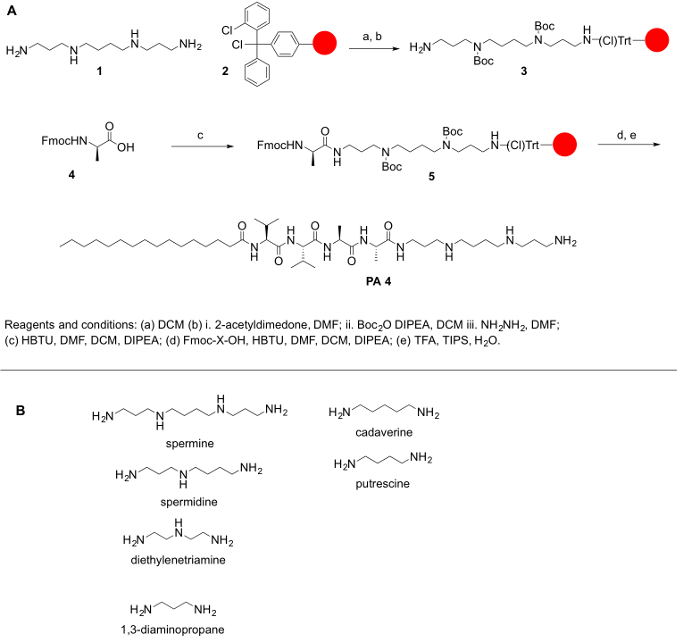
Figuur 1: (A) A algemene reactie regeling voor de synthese van de PPA. (B) vertegenwoordiger Polyaminen, die kunnen worden gebruikt om gesynthetiseerd PPA hier beschreven. Klik hier voor een grotere versie van dit cijfer.
Protocol
Representative Results
Discussion
De hier beschreven protocollen kunnen worden gebruikt voor het synthetiseren van de PPA zoals wells als PAs en gerelateerde peptide gebaseerde molecules (zoals hybride PA-peptoids). Hoewel de synthese van peptiden met behulp van de SPPS een eenvoudige procedure is, is de synthese van peptiden met biologische homing moleculen kunnen bijzonder uitdagend. Polyaminen zoals spermine, spermidine, diethyelenetriamine, enz., kunnen functioneren als homing moleculen voor het targeten van kanker cellen13…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit project werd gefinancierd door de Universiteit van Nebraska Medical Center (Start-up fondsen, MC-S); NIH-COBRE, 5P20GM103480 (T. Bronich) en de American Chemical Society, PRF-# 57434-DNI7(MC-S).
Materials
| 2-Chlorotrityl chloride resin | AappTec | RTZ001 | |
| SynthwareTM synthesis vessel | Aldrich | SYNP120050M | |
| Dichloromethane | Acros | AC406920250 | Fisher Sci. Catalogue # |
| Wrist Shaker | Boekel Scientific | 401000-2 | |
| Kaiser test kit | Sigma-Aldrich | 60017 | |
| 2-[(4,4-dimethyl-2,6-dioxocyclohex-1-ylidene)ethyl-amino]-ethanol | Sigma-Aldrich | CDS004772 | |
| Anhydrous Methanol | Acros | AC610981000 | Fisher Sci. Catalogue # |
| Chloranil test kit | TCI | TCC1771-KIT | VWR Catalogue # |
| Di-tert butyl di-carbonate | Acros | AC194670250 | Fisher Sci. Catalogue # |
| Dimethylformamide | Fisher Scientific | BP1160-4 | |
| Hydrazine | Acros | AC296815000 | FIsher Sci. Catalogue # |
| (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate) | p3biosystems | 31001 | |
| 4-methyl piperidine | Acros | AC127515000 | FIsher Sci. Catalogue # |
| Trifluoroacetic Acid | AappTec | CXZ035 | |
| Triisopropyl Silane | Sigma-Aldrich | 233781 | |
| Ether | Fisher Scientific | E138-1 | |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | C8982 | |
| 9-Aminoacridine | Sigma-Aldrich | 92817 | |
| Fisherbrand Syringe Filters: PTFE Membrane | Fisher Scientific | 09-730-21 |
References
- Cui, H., Pashuck, E. T., Velichko, Y. S., Weigand, S. J., Cheetham, A. G., Newcomb, C. J., Stupp, S. I. Spontaneous and x-ray-triggered crystallization at long range in self-assembling filament networks. Science. 327, 555-559 (2010).
- Pashuck, E. T., Cui, H., Stupp, S. I. Tuning supramolecular rigidity of peptide fibers through molecular structure. Journal of the American Chemical Society. 132, 6041-6046 (2010).
- Stupp, S. I., Zha, R. H., Palmer, L. C., Cui, H., Bitton, R. Self-assembly of biomolecular soft matter. Faraday Discussions. 166, 9-30 (2013).
- Conda-Sheridan, M., Lee, S. S., Preslar, A. T., Stupp, S. I. Esterase-activated release of naproxen from supramolecular nanofibres. Chemical Communications. 50, 13757-13760 (2014).
- Mata, A., Palmer, L., Tejeda-Montes, E., Stupp, S. I. Design of biomolecules for nanoengineered biomaterials for regenerative medicine. Nanotechnology in Regenerative Medicine. , 39-49 (2012).
- Samad, M. B., Chhonker, Y. S., Contreras, J. I., McCarthy, A., McClanahan, M. M., Murry, D. J., Conda-Sheridan, M. Developing Polyamine-Based Peptide Amphiphiles with Tunable Morphology and Physicochemical Properties. Macromolecular bioscience. 17, (2017).
- Nel, A. E., Mädler, L., Velegol, D., Xia, T., Hoek, E. M., Somasundaran, P., Klaessig, F., Castranova, V., Thompson, M. Understanding biophysicochemical interactions at the nano-bio interface. Nature Materials. 8, 543 (2009).
- Gujrati, M., Malamas, A., Shin, T., Jin, E., Sun, Y., Lu, Z. -. R. Multifunctional cationic lipid-based nanoparticles facilitate endosomal escape and reduction-triggered cytosolic siRNA release. Molecular Pharmaceutics. 11, 2734-2744 (2014).
- Zhu, Y., Li, J., Kanvinde, S., Lin, Z., Hazeldine, S., Singh, R. K., Oupický, D. Self-immolative polycations as gene delivery vectors and prodrugs targeting polyamine metabolism in cancer. Molecular Pharmaceutics. 12, 332-341 (2014).
- Planas-Portell, J., Gallart, M., Tiburcio, A. F., Altabella, T. Copper-containing amine oxidases contribute to terminal polyamine oxidation in peroxisomes and apoplast of Arabidopsis thaliana. BMC Plant Biology. 13, 109 (2013).
- Nash, I. A., Bycroft, B. W., Chan, W. C. Dde – A selective primary amine protecting group: A facile solid phase synthetic approach to polyamine conjugates. Tetrahedron Letters. 37, 2625-2628 (1996).
- Ralhan, K., KrishnaKumar, V. G., Gupta, S. Piperazine and DBU: a safer alternative for rapid and efficient Fmoc deprotection in solid phase peptide synthesis. RSC Advances. 5, 104417-104425 (2015).
- Casero, R. A., Marton, L. J. Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases. Nature Reviews Drug Discovery. 6, 373 (2007).
- Wuts, P. G. M., Greene, T. W. . Protection for the Amino Group. In Greene’s Protective Groups in Organic Synthesis. , 696-926 (2006).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. Journal of Peptide Science. 13, 143-148 (2007).

