Facile protocollo per la sintesi di auto-assemblaggio basato su poliammina Peptide anfifili (PPA) e biomateriali correlate
Summary
La sintesi delle poliammine-basato del peptide anfifili (PPA) è una sfida significativa per la presenza di multiple azoti ammina, che richiede l’uso giudizioso di proteggere i gruppi per mascherare queste funzionalità reattive. In questo articolo, descriviamo un metodo facile per la preparazione di questi nuova classe di molecole autoassemblanti.
Abstract
Basato su poliammina Peptide anfifili (PPA) sono una nuova classe di autoassemblanti anfifilici biomateriali-relazionati con il peptide anfifili (PAs). Tradizionale PAs possiedono caricate aminoacidi come solubilizzanti gruppi (lisina, arginina), che sono direttamente collegati ad un segmento del lipido o possono contenere una regione linker fatta di amminoacidi neutri. Messa a punto la sequenza del peptide di PAs può produrre diverse morfologie. Allo stesso modo, PPA possieda un segmento idrofobo e aminoacidi neutri, ma contenga anche molecole di poliammine come acqua solubilizzanti (idrofili) gruppi. Come è il caso con PAs, PPA anche possibile auto-assemblarsi in morfologie diverse, tra cui asticelle, nano-nastri intrecciati e nano-fogli di fuse, quando disciolto in acqua. Tuttavia, la presenza di ammine primarie e secondarie su una molecola singola poliammina pone una sfida significativa quando sintetizzando PPA. In questa carta, indichiamo un protocollo semplice, basato su precedenti di letteratura, di raggiungere una sintesi facile di PPA utilizzando sintesi del peptide di fase solida (SPPS). Questo protocollo può essere esteso alla sintesi di PAs e altri sistemi simili. Abbiamo anche illustrare i passaggi che sono necessari per la scissione da resina, identificazione e purificazione.
Introduction
Autoassemblanti peptide anfifili (PAs) sono una classe di biomateriali in genere composto da segmenti seguenti: (a) idrofilo testa, regione linker (b) e (c) idrofobo. La maggior parte PAs descritti nella letteratura possiedono una testa idrofila composta da cariche o polare dell’amminoacido residui1,2,3,4. PAs hanno trovato una vasta gamma di applicazioni nel campo della biomedicina tra cui la consegna della droga, malattia diagnostica, medicina rigenerativa, ecc5. Base alla loro sequenza dell’amminoacido, PAs può formare un’ampia varietà di nanostrutture tra cui micelle sferiche e nano-filamenti. Recentemente abbiamo segnalato una classe di ibridi basati su poliammina peptide anfifili, chiamato PPA6. Le morfologie, autoassemblanti cinetica e degradazione metabolica, di questi biomateriali, sono stati trovati per essere collegati al loro gruppo testa solubilizzante. Inoltre, le nanostrutture di PPA non hanno mostrato tossicità verso le cellule di mammiferi (linee MiaPaCa2 e delle cellule HeLa) alle concentrazioni testate. Nanovettori basati su PPA sono veicoli di consegna della droga attraente perché: (1) della poliammina assorbimento ed il metabolismo è stato indicato per essere aumentato in cellule cancerogene, nanostrutture (2) cationico può raggiungere endosomal fuga7,8, che conduce alla più alta circolazione e soggiorno all’interno di una cella e (3) dovrebbero avere un distinto profilo metabolico se confrontato con il PA; ad esempio, essi saranno più stabile verso proteasi trovate nel corpo umano (anche se essi forse sensibili ad altri enzimi, quali ammino ossidasi)9,10. Inoltre, PPA è stati trovati per avere diverse morfologie, proprietà fisico-chimiche, rigidità delle nanoparticelle e cinetica di assemblaggio a seconda della lunghezza e carica di singoli PPA molecola6. Qui, descriviamo un protocollo dettagliato per la sintesi, la identificazione e la purificazione di PPA che può essere applicato anche alla preparazione di PAs o simili molecole del peptide ibride.
Perché poliamine non sono comunemente disponibili in commercio nelle loro forme protette, e perché proteggere le ammine primarie e secondarie delle poliamine è della massima importanza per loro coniugazione con amminoacidi e altre molecole, che abbiamo descritto il procedura sintetica per raggiungere la loro protezione. L’obiettivo generale del presente protocollo è quello di fornire un metodo semplice per coniugazione poliamine agli aminoacidi. Poliammine mancano un gruppo carbossilico; così, essi non possono essere accoppiate a Rink ammide o resine Wang. Invece, resine come cloruro di 2-chlorotrityl sono raccomandate per il protocollo sintetico. La sfida principale per la sintesi di PPA è la presenza di gruppi funzionali di ammina primaria e secondaria. Per i nostri scopi, abbiamo protetto tutte le ammine secondarie nella poliammina, mantenendo il gruppo amminico primario sulla poliammina libera per consentire la reazione di accoppiamento. La reazione è stato fatto su un supporto solido, seguendo i principi della sintesi del peptide di fase solida (SPPS) per facilitare il work-up dopo ogni passaggio di accoppiamento e deprotezione. Il seguente protocollo è per entrambi la sintesi manuale e automatizzata di PPA (anche se sarà difficile la verifica di alcuni passi in un sistema automatizzato). La sintesi di queste molecole possono anche essere effettuata su un sintetizzatore automatico o con l’ausilio di un reattore a microonde (automatico o semi-automatica). Lo schema di reazione è stata riassunta nella Figura 1.
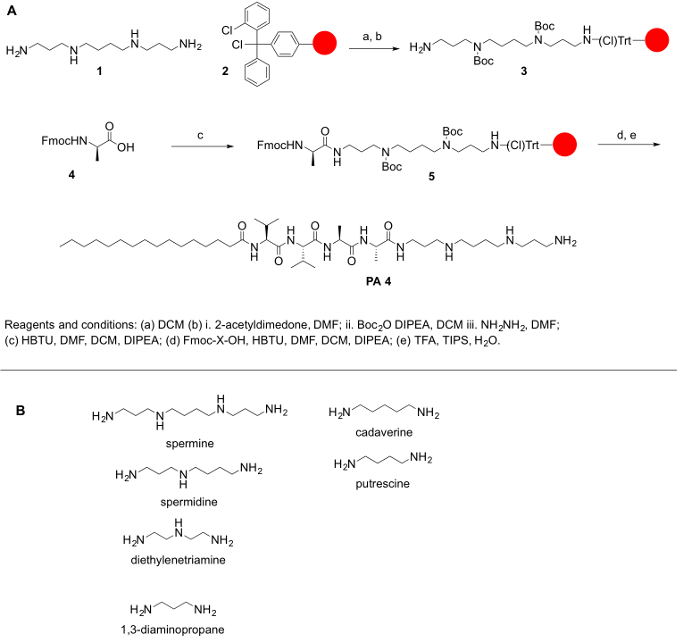
Figura 1: (A) A regime di reazione generale per la sintesi di PPA. Poliammine rappresentativo (B) che possono essere utilizzati per sintetizzato PPA descritto qui. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
I protocolli descritti qui possono essere utilizzati per sintetizzare PPA come pozzi come PAs e relative molecole peptidici (ad esempio di ibrido PA-peptoids). Anche se la sintesi di peptidi utilizzando SPPS è una procedura semplice, la sintesi di peptidi contenenti molecole biologiche homing può essere particolarmente impegnativa. Poliammine come spermina, spermidina, diethyelenetriamine, ecc., possono funzionare come molecole homing per il targeting cancro cellule13. Il PPA possa asse…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questo progetto è stato finanziato dall’Università del Nebraska Medical Center (fondi di Start-up, MC-S); NIH-COBRE, 5P20GM103480 (T. jakzrobic) e l’American Chemical Society, PRF # 57434-DNI7(MC-S).
Materials
| 2-Chlorotrityl chloride resin | AappTec | RTZ001 | |
| SynthwareTM synthesis vessel | Aldrich | SYNP120050M | |
| Dichloromethane | Acros | AC406920250 | Fisher Sci. Catalogue # |
| Wrist Shaker | Boekel Scientific | 401000-2 | |
| Kaiser test kit | Sigma-Aldrich | 60017 | |
| 2-[(4,4-dimethyl-2,6-dioxocyclohex-1-ylidene)ethyl-amino]-ethanol | Sigma-Aldrich | CDS004772 | |
| Anhydrous Methanol | Acros | AC610981000 | Fisher Sci. Catalogue # |
| Chloranil test kit | TCI | TCC1771-KIT | VWR Catalogue # |
| Di-tert butyl di-carbonate | Acros | AC194670250 | Fisher Sci. Catalogue # |
| Dimethylformamide | Fisher Scientific | BP1160-4 | |
| Hydrazine | Acros | AC296815000 | FIsher Sci. Catalogue # |
| (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate) | p3biosystems | 31001 | |
| 4-methyl piperidine | Acros | AC127515000 | FIsher Sci. Catalogue # |
| Trifluoroacetic Acid | AappTec | CXZ035 | |
| Triisopropyl Silane | Sigma-Aldrich | 233781 | |
| Ether | Fisher Scientific | E138-1 | |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | C8982 | |
| 9-Aminoacridine | Sigma-Aldrich | 92817 | |
| Fisherbrand Syringe Filters: PTFE Membrane | Fisher Scientific | 09-730-21 |
References
- Cui, H., Pashuck, E. T., Velichko, Y. S., Weigand, S. J., Cheetham, A. G., Newcomb, C. J., Stupp, S. I. Spontaneous and x-ray-triggered crystallization at long range in self-assembling filament networks. Science. 327, 555-559 (2010).
- Pashuck, E. T., Cui, H., Stupp, S. I. Tuning supramolecular rigidity of peptide fibers through molecular structure. Journal of the American Chemical Society. 132, 6041-6046 (2010).
- Stupp, S. I., Zha, R. H., Palmer, L. C., Cui, H., Bitton, R. Self-assembly of biomolecular soft matter. Faraday Discussions. 166, 9-30 (2013).
- Conda-Sheridan, M., Lee, S. S., Preslar, A. T., Stupp, S. I. Esterase-activated release of naproxen from supramolecular nanofibres. Chemical Communications. 50, 13757-13760 (2014).
- Mata, A., Palmer, L., Tejeda-Montes, E., Stupp, S. I. Design of biomolecules for nanoengineered biomaterials for regenerative medicine. Nanotechnology in Regenerative Medicine. , 39-49 (2012).
- Samad, M. B., Chhonker, Y. S., Contreras, J. I., McCarthy, A., McClanahan, M. M., Murry, D. J., Conda-Sheridan, M. Developing Polyamine-Based Peptide Amphiphiles with Tunable Morphology and Physicochemical Properties. Macromolecular bioscience. 17, (2017).
- Nel, A. E., Mädler, L., Velegol, D., Xia, T., Hoek, E. M., Somasundaran, P., Klaessig, F., Castranova, V., Thompson, M. Understanding biophysicochemical interactions at the nano-bio interface. Nature Materials. 8, 543 (2009).
- Gujrati, M., Malamas, A., Shin, T., Jin, E., Sun, Y., Lu, Z. -. R. Multifunctional cationic lipid-based nanoparticles facilitate endosomal escape and reduction-triggered cytosolic siRNA release. Molecular Pharmaceutics. 11, 2734-2744 (2014).
- Zhu, Y., Li, J., Kanvinde, S., Lin, Z., Hazeldine, S., Singh, R. K., Oupický, D. Self-immolative polycations as gene delivery vectors and prodrugs targeting polyamine metabolism in cancer. Molecular Pharmaceutics. 12, 332-341 (2014).
- Planas-Portell, J., Gallart, M., Tiburcio, A. F., Altabella, T. Copper-containing amine oxidases contribute to terminal polyamine oxidation in peroxisomes and apoplast of Arabidopsis thaliana. BMC Plant Biology. 13, 109 (2013).
- Nash, I. A., Bycroft, B. W., Chan, W. C. Dde – A selective primary amine protecting group: A facile solid phase synthetic approach to polyamine conjugates. Tetrahedron Letters. 37, 2625-2628 (1996).
- Ralhan, K., KrishnaKumar, V. G., Gupta, S. Piperazine and DBU: a safer alternative for rapid and efficient Fmoc deprotection in solid phase peptide synthesis. RSC Advances. 5, 104417-104425 (2015).
- Casero, R. A., Marton, L. J. Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases. Nature Reviews Drug Discovery. 6, 373 (2007).
- Wuts, P. G. M., Greene, T. W. . Protection for the Amino Group. In Greene’s Protective Groups in Organic Synthesis. , 696-926 (2006).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. Journal of Peptide Science. 13, 143-148 (2007).

