Легковесные протокол для синтеза самостоятельной сборки на основе амидов кислых пептидные Amphiphiles (ППД) и связанных с ними биоматериалов
Summary
Синтез amphiphiles на основе амидов кислых пептида (ППД) является важной задачей благодаря наличию нескольких Амин nitrogens, который требует разумного использования защиты групп, чтобы замаскировать этим реактивного функций. В настоящем документе мы описываем снисходительный метод для подготовки этих новых класса самостоятельной сборки молекул.
Abstract
На основе амидов кислых пептидные Amphiphiles (ППД) являются новый класс самостоятельной сборки амфифильных биоматериалов, относящиеся к amphiphiles пептид (ССА). Традиционные PAs обладают заряженные аминокислоты как растворяющие групп (лизин, аргинин), которые подключены непосредственно к сегменту липидов или может содержать область компоновщик из нейтральных аминокислот. Тюнинг пептид последовательность PAs может принести различные морфологии. Аналогично ППД обладают сегмент гидрофобных и нейтральных аминокислот, но также содержат полиаминовых молекулы воды, растворяющие (гидрофильных) групп. Как и в случае с PAs, ППД могут также самостоятельно собрать в разнообразных морфологии, в том числе малые стержни, витой нано ленты и плавленого нано листы, при растворении в воде. Однако наличие первичных и вторичных аминов на молекуле одного полиаминовых представляет значительную проблему при синтезировать ППД. В этой статье мы покажем простой протокол, основанный на прецеденты литературы, для достижения снисходительный синтез энергомощностей с использованием твердой фазы пептидного синтеза (ППУ). Этот протокол может быть продлен для синтеза PAs и других подобных систем. Мы также иллюстрируют шаги, которые необходимы для расщепления от смолы, идентификации и очистки.
Introduction
Самостоятельной сборки пептидные amphiphiles (ССА) являются класс биоматериалов, обычно состоит из следующих сегментов: () гидрофильные голова, (b) компоновщика региона и (c) гидрофобная хвост. Большинство описанных в литературе PAs обладают гидрофильные голова состоит из заряженных или полярных аминокислотных остатков1,2,3,4. ССА нашли широкий спектр приложений в биомедицине, в том числе Доставка лекарств, диагностики заболеваний, восстановительной медицины, и т.д.5. На основе их аминокислотных последовательностей, ПА может сформировать широкий спектр наноструктур, включая сферических мицелл и нано волокна. Недавно мы сообщили класс гибрид на основе амидов кислых пептидные amphiphiles, называют ППД6. Морфологии, самостоятельной сборки кинетики и метаболических деградации, эти биоматериалов, были найдены быть связано с их solubilizing начальник группы. Кроме того PPA наноструктур не показывают токсичности к mammalian клеток (линии MiaPaCa2 и клеток HeLa) в концентрациях, протестированных. PPA-основанные nanocarriers являются привлекательными наркотиков-доставки, потому что: (1) полиаминовых поглощение и метаболизм было показано увеличение раковых клеток, (2) Катионный наноструктур можно добиться от англ побег7,8, что приводит к более циркуляции и жительства в пределах ячейки и (3), они должны иметь собственный метаболизм профиль, когда по сравнению с ПА; Например, они будут более стабильными направлении протеаз, найти в человеческом теле (хотя они может быть чувствительным к другие ферменты, такие как Амин оксидазы)9,10. Кроме того иметь разнообразные морфологии, физико-химических свойств, наночастиц жесткость и Ассамблея кинетики в зависимости от длины и заряд отдельных PPA молекулы6были найдены ППД. Здесь мы описываем подробный протокол для синтеза, идентификации и очистки ППД, которые также могут быть применены к подготовке Пас или аналогичных гибридные пептидных молекул.
Потому что Полиамины обыкновенно не коммерчески доступных в их защищенных форм, и потому, что защита первичные и вторичные амины Полиамины имеет первостепенное значение для спрягать их с аминокислот и других молекул, мы наметили синтетические шаги для обеспечения их защиты. Общая цель настоящего Протокола заключается в обеспечивают простой метод для спрягать полиаминов в аминокислоты. Полиамины отсутствие карбоксильные группы; Таким образом они не могут сочетаться каток амидной или Ван смол. Вместо этого смолы, например 2-chlorotrityl хлорид рекомендуются для синтетических протокола. Основной задачей для синтеза PPA является наличие первичных и вторичных аминов функциональных групп. Для наших целей мы защитили все вторичные амины в полиаминовых сохраняя основной амино-группы на полиаминовых свободной соединительной реакции. Реакция была сделана на прочную поддержку принципам твердой фазы пептидного синтеза (ППУ) для облегчения работы вверх после каждого шага муфтой и deprotection. Следующий протокол предназначен для ручного и автоматизированного синтеза ПРП (хотя проверка некоторых шагов будет сложным в автоматизированной системе). Синтез этих молекул может также осуществляться на автоматизированных синтезатор или с помощью микроволновой реактора (автоматические или полуавтоматические). Схему реакции подведены на рисунке 1.
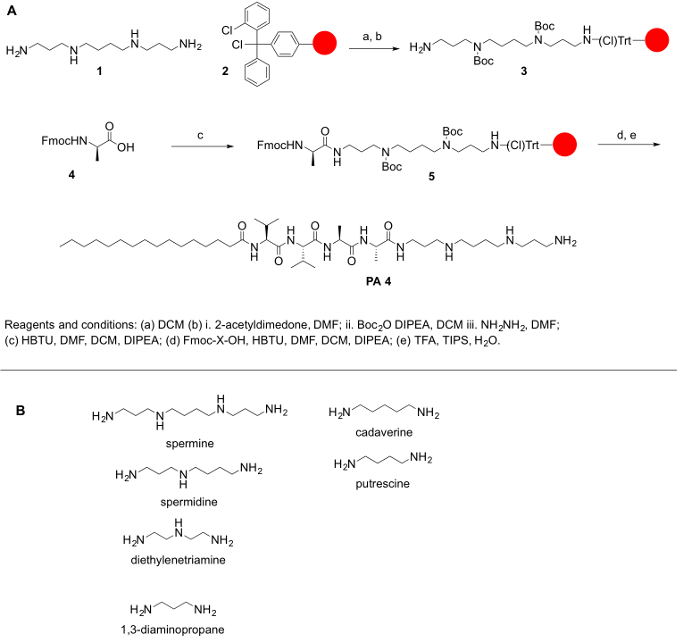
Рисунок 1: (A) A общей реакции схема для синтеза ППД. (B) представитель Полиамины, которые могут быть использованы для синтезированных ППД, описанных здесь. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Protocol
Representative Results
Discussion
Протоколы, описанные здесь может использоваться для синтеза ППД скважин как PAs и связанных пептидной основе молекул (таких, как гибридные PA-peptoids). Хотя синтез пептидов, используя ППУ является простой процедурой, синтез пептидов, содержащие биологические молекулы самонаведения может бы?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Этот проект финансировался медицинский центр университета штата Небраска (Запуск средства, MC-S); НИЗ КОБРЕ, 5P20GM103480 (т. Бронич) и американского химического общества, PRF # 57434-DNI7(MC-S).
Materials
| 2-Chlorotrityl chloride resin | AappTec | RTZ001 | |
| SynthwareTM synthesis vessel | Aldrich | SYNP120050M | |
| Dichloromethane | Acros | AC406920250 | Fisher Sci. Catalogue # |
| Wrist Shaker | Boekel Scientific | 401000-2 | |
| Kaiser test kit | Sigma-Aldrich | 60017 | |
| 2-[(4,4-dimethyl-2,6-dioxocyclohex-1-ylidene)ethyl-amino]-ethanol | Sigma-Aldrich | CDS004772 | |
| Anhydrous Methanol | Acros | AC610981000 | Fisher Sci. Catalogue # |
| Chloranil test kit | TCI | TCC1771-KIT | VWR Catalogue # |
| Di-tert butyl di-carbonate | Acros | AC194670250 | Fisher Sci. Catalogue # |
| Dimethylformamide | Fisher Scientific | BP1160-4 | |
| Hydrazine | Acros | AC296815000 | FIsher Sci. Catalogue # |
| (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate) | p3biosystems | 31001 | |
| 4-methyl piperidine | Acros | AC127515000 | FIsher Sci. Catalogue # |
| Trifluoroacetic Acid | AappTec | CXZ035 | |
| Triisopropyl Silane | Sigma-Aldrich | 233781 | |
| Ether | Fisher Scientific | E138-1 | |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | C8982 | |
| 9-Aminoacridine | Sigma-Aldrich | 92817 | |
| Fisherbrand Syringe Filters: PTFE Membrane | Fisher Scientific | 09-730-21 |
References
- Cui, H., Pashuck, E. T., Velichko, Y. S., Weigand, S. J., Cheetham, A. G., Newcomb, C. J., Stupp, S. I. Spontaneous and x-ray-triggered crystallization at long range in self-assembling filament networks. Science. 327, 555-559 (2010).
- Pashuck, E. T., Cui, H., Stupp, S. I. Tuning supramolecular rigidity of peptide fibers through molecular structure. Journal of the American Chemical Society. 132, 6041-6046 (2010).
- Stupp, S. I., Zha, R. H., Palmer, L. C., Cui, H., Bitton, R. Self-assembly of biomolecular soft matter. Faraday Discussions. 166, 9-30 (2013).
- Conda-Sheridan, M., Lee, S. S., Preslar, A. T., Stupp, S. I. Esterase-activated release of naproxen from supramolecular nanofibres. Chemical Communications. 50, 13757-13760 (2014).
- Mata, A., Palmer, L., Tejeda-Montes, E., Stupp, S. I. Design of biomolecules for nanoengineered biomaterials for regenerative medicine. Nanotechnology in Regenerative Medicine. , 39-49 (2012).
- Samad, M. B., Chhonker, Y. S., Contreras, J. I., McCarthy, A., McClanahan, M. M., Murry, D. J., Conda-Sheridan, M. Developing Polyamine-Based Peptide Amphiphiles with Tunable Morphology and Physicochemical Properties. Macromolecular bioscience. 17, (2017).
- Nel, A. E., Mädler, L., Velegol, D., Xia, T., Hoek, E. M., Somasundaran, P., Klaessig, F., Castranova, V., Thompson, M. Understanding biophysicochemical interactions at the nano-bio interface. Nature Materials. 8, 543 (2009).
- Gujrati, M., Malamas, A., Shin, T., Jin, E., Sun, Y., Lu, Z. -. R. Multifunctional cationic lipid-based nanoparticles facilitate endosomal escape and reduction-triggered cytosolic siRNA release. Molecular Pharmaceutics. 11, 2734-2744 (2014).
- Zhu, Y., Li, J., Kanvinde, S., Lin, Z., Hazeldine, S., Singh, R. K., Oupický, D. Self-immolative polycations as gene delivery vectors and prodrugs targeting polyamine metabolism in cancer. Molecular Pharmaceutics. 12, 332-341 (2014).
- Planas-Portell, J., Gallart, M., Tiburcio, A. F., Altabella, T. Copper-containing amine oxidases contribute to terminal polyamine oxidation in peroxisomes and apoplast of Arabidopsis thaliana. BMC Plant Biology. 13, 109 (2013).
- Nash, I. A., Bycroft, B. W., Chan, W. C. Dde – A selective primary amine protecting group: A facile solid phase synthetic approach to polyamine conjugates. Tetrahedron Letters. 37, 2625-2628 (1996).
- Ralhan, K., KrishnaKumar, V. G., Gupta, S. Piperazine and DBU: a safer alternative for rapid and efficient Fmoc deprotection in solid phase peptide synthesis. RSC Advances. 5, 104417-104425 (2015).
- Casero, R. A., Marton, L. J. Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases. Nature Reviews Drug Discovery. 6, 373 (2007).
- Wuts, P. G. M., Greene, T. W. . Protection for the Amino Group. In Greene’s Protective Groups in Organic Synthesis. , 696-926 (2006).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. Journal of Peptide Science. 13, 143-148 (2007).

