自己組織化ペプチドのポリアミンによる両親媒性物質 (Ppa の) と関連生体材料の合成のための安易なプロトコル
Summary
両親媒性ペプチドのポリアミン ベース (Ppa の) の合成は、これらの事後対応型の機能をマスクするグループを保護するための賢明な使用を必要とする複数のアミン窒素の存在のために重要な課題です。本稿では自己組織化分子のこれらの新しいクラスの準備のための安易な方法をについて説明します。
Abstract
ポリアミンによるペプチド両親媒性 (Ppa の) は、自己組織化両親媒性ペプチド両親媒性物質 (PAs) に生体材料関連の新しいクラスです。伝統的な PAs では、荷電アミノ酸 (リジン、アルギニン)、脂質セグメントに直接接続されている、または中性のアミノ酸のリンカー領域を含めることができますグループを可として所有しています。PAs のペプチッド シーケンスのチューニングは多様な形態をもたらすことができます。同様に、Ppa は疎水性セグメントと中性アミノ酸を有するがまた水 (親水性) グループを可としてポリアミンの分子が含まれています。PAs の場合と同様に、Ppa を小さな棒、ツイスト ナノリボンと融合ナノ-シート、水に溶けるなどを含む、多様な形態に自己組み立てるもできます。ただし、単一のポリアミンの分子にプライマリとセカンダリの両方のアミンの存在は、Ppa を合成する場合、重要な課題を生じます。本稿では Ppa の固相ペプチド合成 (SPP) を使用しての簡易合成を達成するために、文献の判例に基づく単純なプロトコルを紹介します。このプロトコルは、PAs と他の類似システムの合成を拡張できます。また樹脂や同定、精製から胸の谷間に必要な手順を示します。
Introduction
自己組織化ペプチド両親媒性物質 (PAs) は、通常次のセグメントから成る生体材料のクラス: (a) 親水性頭部、(b) リンカーの地域、および (c) 疎水性尾。文献で説明されているほとんどの PAs では、あるいは極性アミノ酸残基1,2,3,4から成る親水性頭部を所有しています。PAs は、ドラッグデリバリー、病気診断、再生医療など5など生物医学アプリケーションの広い範囲を発見しました。そのアミノ酸配列に基づく、PAs は、ナノ球状ミセル ナノ フィラメントなどのさまざまなを形成できます。我々 は最近のハイブリッド ポリアミンによるペプチド媒、Ppa の6と呼ばれるクラスを報告しています。その混ぜ合わせたヘッド グループに関連する形態、自己組織化の動力学、これら生体の代謝の分解が見つかりました。また、PPA ナノ構造はテストされた濃度で哺乳類細胞 (MiaPaCa2、HeLa 細胞線) に向けて毒性を示さなかった。PPA ベース ナノキャリアは、魅力的なドラッグデリバリー車: (1) ポリアミン吸収及び代謝は癌細胞で増加する示されている、(2) カチオン性ナノ構造体はエンドソーム脱出7、8を達成することが高い循環と、セルと PA; と比較して異なる代謝プロファイルが必要 (3) 内にあるレジデンスにつながるたとえば、彼らは人間の体は、プロテアーゼの方安定する (ただし彼らのアミン酸化酵素など、他の酵素に多分敏感)9,10。また、Ppa は、多様な形態と物理化学的特性、ナノ粒子剛性、および長さと個々 の PPA 分子6の料金に応じてアセンブリ動態に発見されています。ここで、合成、識別、そして PAs 又は同様のハイブリッド ペプチド分子の調製にも適用できる Ppa の浄化のための詳しいプロトコルについて述べる。
ポリアミンが市販の保護されたフォームで一般的でないため、記載されているアミノ酸と他の分子、それらの活用の大切はポリアミンの第一次および二次アミンを保護するため、合成ステップの保護を達成するために。このプロトコルの全体的な目標は、アミノ酸にポリアミンの活用の簡単な方法を提供します。ポリアミンがないカルボン酸官能基;したがって、スケート リンク アミドまたは王樹脂に結合されることはできません。代わりに、2 chlorotrityl 塩化物などの樹脂は合成プロトコルに適しています。PPA 合成の主な課題は、第一次および二次アミン官能基の存在です。我々 の目的はカップリング反応を許可する無料のポリアミンをプライマリのアミノ グループを維持しながら、ポリアミンの第二級アミンを保護されています。反応は、各結合と脱保護手順の後仕事を容易にするために固相ペプチド合成 (SPP) の原則に従ってしっかりサポートで行われました。次のプロトコルは、Ppa の手動および自動合成 (ただし、いくつかの手順の検証は自動化されたシステムに挑戦すること) です。自動化されたシンセサイザーまたはマイクロ ウェーブ合成装置の助けを借りて、これらの分子の合成することができますアウト実施も (自動または半自動)。反応機構は、図 1に要約されています。
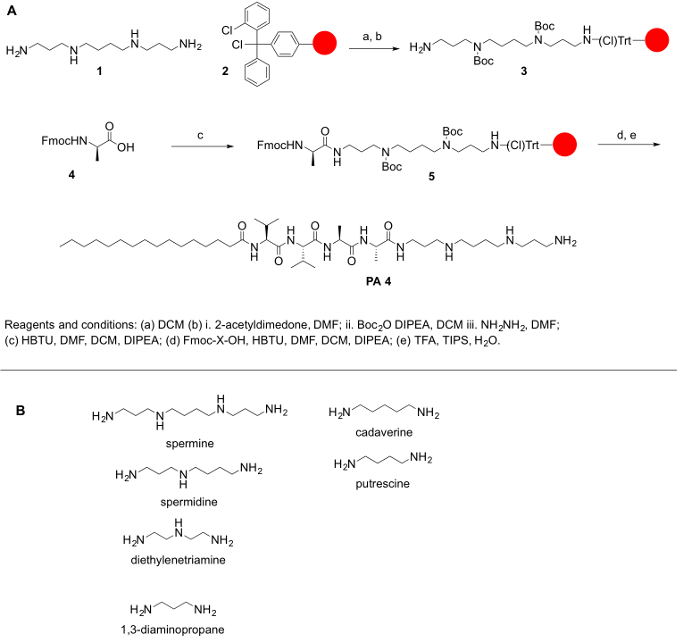
図 1:(A) A の一般的な反応スキーム Ppa の合成。ために使用することができます (B) の代表的なポリアミン合成 Ppa のここで説明します。この図の拡大版を表示するのにはここをクリックしてください。
Protocol
Representative Results
Discussion
ここで説明されているプロトコルは、Ppa の PAs として井戸と関連ペプチドを用いた分子 (ハイブリッド PA ペプチド) などを合成する使用ことができます。によるペプチドの合成では、簡単な手順ですが、生体ホーミングの分子を含むペプチドの合成が特に困難になることができます。スペルミン、スペルミジン、diethyelenetriamine等のようなポリアミンは、対象化、がん細胞1…
Disclosures
The authors have nothing to disclose.
Acknowledgements
このプロジェクト資金が供給されたネブラスカ大学医療センター (スタートアップ資金、MC S);5P20GM103480、NIH COBRE (T. Bronich) とアメリカの化学社会、PRF # 57434-DNI7(MC-S)。
Materials
| 2-Chlorotrityl chloride resin | AappTec | RTZ001 | |
| SynthwareTM synthesis vessel | Aldrich | SYNP120050M | |
| Dichloromethane | Acros | AC406920250 | Fisher Sci. Catalogue # |
| Wrist Shaker | Boekel Scientific | 401000-2 | |
| Kaiser test kit | Sigma-Aldrich | 60017 | |
| 2-[(4,4-dimethyl-2,6-dioxocyclohex-1-ylidene)ethyl-amino]-ethanol | Sigma-Aldrich | CDS004772 | |
| Anhydrous Methanol | Acros | AC610981000 | Fisher Sci. Catalogue # |
| Chloranil test kit | TCI | TCC1771-KIT | VWR Catalogue # |
| Di-tert butyl di-carbonate | Acros | AC194670250 | Fisher Sci. Catalogue # |
| Dimethylformamide | Fisher Scientific | BP1160-4 | |
| Hydrazine | Acros | AC296815000 | FIsher Sci. Catalogue # |
| (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate) | p3biosystems | 31001 | |
| 4-methyl piperidine | Acros | AC127515000 | FIsher Sci. Catalogue # |
| Trifluoroacetic Acid | AappTec | CXZ035 | |
| Triisopropyl Silane | Sigma-Aldrich | 233781 | |
| Ether | Fisher Scientific | E138-1 | |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | C8982 | |
| 9-Aminoacridine | Sigma-Aldrich | 92817 | |
| Fisherbrand Syringe Filters: PTFE Membrane | Fisher Scientific | 09-730-21 |
References
- Cui, H., Pashuck, E. T., Velichko, Y. S., Weigand, S. J., Cheetham, A. G., Newcomb, C. J., Stupp, S. I. Spontaneous and x-ray-triggered crystallization at long range in self-assembling filament networks. Science. 327, 555-559 (2010).
- Pashuck, E. T., Cui, H., Stupp, S. I. Tuning supramolecular rigidity of peptide fibers through molecular structure. Journal of the American Chemical Society. 132, 6041-6046 (2010).
- Stupp, S. I., Zha, R. H., Palmer, L. C., Cui, H., Bitton, R. Self-assembly of biomolecular soft matter. Faraday Discussions. 166, 9-30 (2013).
- Conda-Sheridan, M., Lee, S. S., Preslar, A. T., Stupp, S. I. Esterase-activated release of naproxen from supramolecular nanofibres. Chemical Communications. 50, 13757-13760 (2014).
- Mata, A., Palmer, L., Tejeda-Montes, E., Stupp, S. I. Design of biomolecules for nanoengineered biomaterials for regenerative medicine. Nanotechnology in Regenerative Medicine. , 39-49 (2012).
- Samad, M. B., Chhonker, Y. S., Contreras, J. I., McCarthy, A., McClanahan, M. M., Murry, D. J., Conda-Sheridan, M. Developing Polyamine-Based Peptide Amphiphiles with Tunable Morphology and Physicochemical Properties. Macromolecular bioscience. 17, (2017).
- Nel, A. E., Mädler, L., Velegol, D., Xia, T., Hoek, E. M., Somasundaran, P., Klaessig, F., Castranova, V., Thompson, M. Understanding biophysicochemical interactions at the nano-bio interface. Nature Materials. 8, 543 (2009).
- Gujrati, M., Malamas, A., Shin, T., Jin, E., Sun, Y., Lu, Z. -. R. Multifunctional cationic lipid-based nanoparticles facilitate endosomal escape and reduction-triggered cytosolic siRNA release. Molecular Pharmaceutics. 11, 2734-2744 (2014).
- Zhu, Y., Li, J., Kanvinde, S., Lin, Z., Hazeldine, S., Singh, R. K., Oupický, D. Self-immolative polycations as gene delivery vectors and prodrugs targeting polyamine metabolism in cancer. Molecular Pharmaceutics. 12, 332-341 (2014).
- Planas-Portell, J., Gallart, M., Tiburcio, A. F., Altabella, T. Copper-containing amine oxidases contribute to terminal polyamine oxidation in peroxisomes and apoplast of Arabidopsis thaliana. BMC Plant Biology. 13, 109 (2013).
- Nash, I. A., Bycroft, B. W., Chan, W. C. Dde – A selective primary amine protecting group: A facile solid phase synthetic approach to polyamine conjugates. Tetrahedron Letters. 37, 2625-2628 (1996).
- Ralhan, K., KrishnaKumar, V. G., Gupta, S. Piperazine and DBU: a safer alternative for rapid and efficient Fmoc deprotection in solid phase peptide synthesis. RSC Advances. 5, 104417-104425 (2015).
- Casero, R. A., Marton, L. J. Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases. Nature Reviews Drug Discovery. 6, 373 (2007).
- Wuts, P. G. M., Greene, T. W. . Protection for the Amino Group. In Greene’s Protective Groups in Organic Synthesis. , 696-926 (2006).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. Journal of Peptide Science. 13, 143-148 (2007).

