FACILE protokol til syntese af selvstændige montage Polyamine-baserede peptid Amphiphiles (elkøbsaftalerne) og relaterede biomaterialer
Summary
Syntesen af polyamine-baseret peptid amphiphiles (elkøbsaftalerne) er en betydelig udfordring på grund af tilstedeværelsen af flere Amin nitrogens, som kræver fornuftig anvendelse for at beskytte grupper for at maskere disse reaktive funktionaliteter. I dette papir beskriver vi en letkøbt metode til forberedelse af disse nye klasse af selvsamlende molekyler.
Abstract
Polyamine-baserede peptid Amphiphiles (elkøbsaftalerne) er en ny klasse af selvsamlende amphiphilic biomaterialer-relateret til peptid amphiphiles (PAs). Traditionelle PAs besidder opladet aminosyrer som solubilizing grupper (lysin, arginin), som er direkte forbundet til et lipid segment eller kan indeholde en linker region af neutrale aminosyrer. Tuning peptid sekvens af PAs kan give forskellige morfologier. Ligeledes elkøbsaftalerne besidder en hydrofobe segment og neutrale aminosyrer, men også indeholder polyamine molekyler som vand solubilizing (hydrofile) grupper. Som er tilfældet med PAs, kan elkøbsaftalerne Self også samles til forskellige morfologier, herunder små stænger, snoet nano-bånd og sammenvokset nano-sheets, når opløst i vand. Men tilstedeværelsen af både primære og sekundære aminer på en enkelt polyamine molekyle udgør en betydelig udfordring når syntese elkøbsaftalerne. I dette papir viser vi en enkel protokol, baseret på litteratur fortilfælde, at opnå en letkøbt syntese af elkøbsaftalerne ved hjælp af faste fase faststadie peptidsyntese (SPP’ER). Denne protokol kan udvides til syntese af PAs og andre tilsvarende systemer. Vi også illustrere de trin, der er nødvendige for kavalergang fra harpiks, identifikation og rensning.
Introduction
Selvsamlende peptid amphiphiles (PAs) er en klasse af biomaterialer typisk består af følgende segmenter: (a) hydrofile hoved, (b) linker region og c hydrofobe hale. De fleste PAs beskrevet i litteraturen besidder en hydrofil hoved består af ladede eller polar aminosyre rester1,2,3,4. PAs har fundet en bred vifte af applikationer i biomedicin herunder medicinafgivelse, sygdom diagnostik og regenerativ medicin etc.5. Baseret på deres aminosyresekvens, kan PAs danne en bred vifte af nanostrukturer herunder sfæriske micelles og nano-filamenter. Vi har for nylig rapporteret en klasse af hybrid polyamine-baserede peptid amphiphiles, betegnes elkøbsaftalerne6. Morfologier, selvsamlende kinetik og metaboliske nedbrydning af disse biomaterialer, fandtes at være relateret til deres solubilizing hoved gruppe. Derudover udviste PPA nanostrukturer ikke toksicitet mod pattedyrceller (MiaPaCa2 og HeLa celler linjer) på de testede koncentrationer. PPA-baserede nanocarriers er attraktive medicinafgivelse køretøjer fordi: (1) polyamine udbredelse og metabolisme har vist sig at være steget i kræftceller, (2) kationiske nanostrukturer kan opnå endosomal undslippe7,8, hvilket fører til højere omsætning og bopæl inden for en celle, og (3) de skal have en særskilt metaboliske profil sammenlignet med PA; for eksempel, de bliver mere stabile mod proteaser findes i den menneskelige krop (selv om de måske følsomme andre enzymer, som Amin oxidases)9,10. Også, elkøbsaftalerne har vist sig for at have forskellige morfologier, fysisk-kemiske egenskaber, nanopartikel stivhed og forsamling kinetik længde og beregning af individuelle PPA molekyle6. Heri, beskriver vi en detaljeret protokol for syntese, identifikation og rensning af elkøbsaftaler, der også kan anvendes til forberedelse af PAs eller lignende hybrid peptid molekyler.
Fordi polyaminer ikke er almindeligt kommercielt tilgængelige i deres beskyttede former, og fordi at beskytte de primære og sekundære aminer i polyaminer er af allerstørste betydning for de tråddannende dem med aminosyrer og andre molekyler, vi har skitseret den syntetisk skridt til at opnå deres beskyttelse. Det overordnede mål med denne protokol er at give en enkel metode til de tråddannende polyaminer til aminosyrer. Polyaminer mangler en carboxylic gruppe; således, de kan ikke være koblet til Rink akrylamid eller Wang harpiks. I stedet, harpiks såsom 2-chlorotrityl chlorid anbefales syntetisk protokollen. Den største udfordring for PPA syntese er tilstedeværelsen af primær og sekundær Amin funktionelle grupper. Til vores formål beskyttet vi alle de sekundære aminer i polyamine mens du holder den primære amino gruppe på polyamine gratis at give koblingen reaktion. Reaktionen var gjort på en solid støtte efter principperne for faste fase faststadie peptidsyntese (SPP’ER) til at lette det arbejde op efter hver kobling og deprotection trin. Følgende protokol er for både manuel og automatiseret syntese af elkøbsaftalerne (selv om verifikation af nogle trin vil være en udfordring i et automatiseret system). Syntesen af disse molekyler kan også udføres på en automatiseret synthesizer eller ved hjælp af en mikrobølgeovn reaktor (automatiske eller halvautomatiske). Ordningen reaktionen har summeret i figur 1.
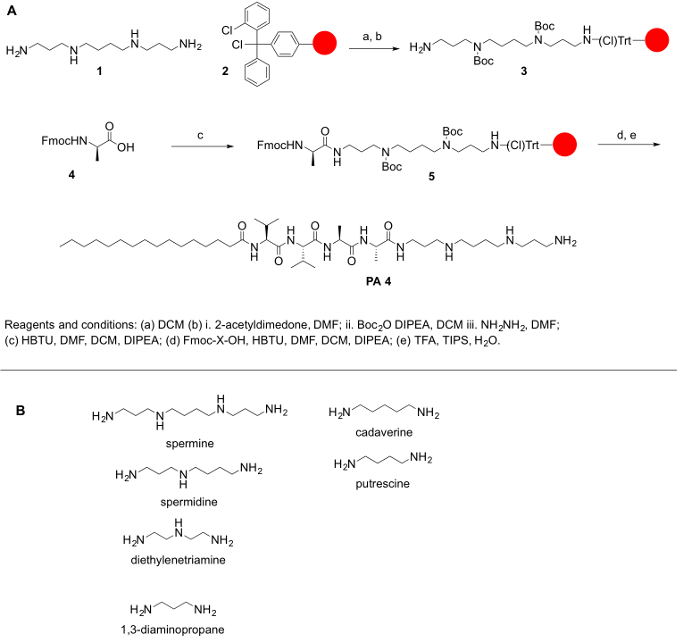
Figur 1: (A) A generelle reaktion ordningen for syntese af aftalerne. (B) repræsentative polyaminer, der kan bruges til syntetiseret elkøbsaftalerne beskrevet her. Venligst klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
De protokoller er beskrevet her kan bruges til at syntetisere elkøbsaftalerne, som brønde som PAs og relateret peptid-baserede molekyler (såsom hybrid PA-peptoids). Selv om syntesen af peptider ved hjælp af SPP’ER er en enkel procedure, kan syntesen af peptider der indeholder biologiske homing molekyler være særligt udfordrende. Polyaminer som Spermin, spermidine, diethyelenetriamine, osv., kan fungere som målsøgende molekyler til at målrette kræft celler13. Aftalerne kan selv s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette projekt blev finansieret ved University of Nebraska Medical Center (opstart midler, MC-S); NIH-COBRE, 5P20GM103480 (T. Bronich) og American Chemical Society, PRF # 57434-DNI7(MC-S).
Materials
| 2-Chlorotrityl chloride resin | AappTec | RTZ001 | |
| SynthwareTM synthesis vessel | Aldrich | SYNP120050M | |
| Dichloromethane | Acros | AC406920250 | Fisher Sci. Catalogue # |
| Wrist Shaker | Boekel Scientific | 401000-2 | |
| Kaiser test kit | Sigma-Aldrich | 60017 | |
| 2-[(4,4-dimethyl-2,6-dioxocyclohex-1-ylidene)ethyl-amino]-ethanol | Sigma-Aldrich | CDS004772 | |
| Anhydrous Methanol | Acros | AC610981000 | Fisher Sci. Catalogue # |
| Chloranil test kit | TCI | TCC1771-KIT | VWR Catalogue # |
| Di-tert butyl di-carbonate | Acros | AC194670250 | Fisher Sci. Catalogue # |
| Dimethylformamide | Fisher Scientific | BP1160-4 | |
| Hydrazine | Acros | AC296815000 | FIsher Sci. Catalogue # |
| (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate) | p3biosystems | 31001 | |
| 4-methyl piperidine | Acros | AC127515000 | FIsher Sci. Catalogue # |
| Trifluoroacetic Acid | AappTec | CXZ035 | |
| Triisopropyl Silane | Sigma-Aldrich | 233781 | |
| Ether | Fisher Scientific | E138-1 | |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | C8982 | |
| 9-Aminoacridine | Sigma-Aldrich | 92817 | |
| Fisherbrand Syringe Filters: PTFE Membrane | Fisher Scientific | 09-730-21 |
References
- Cui, H., Pashuck, E. T., Velichko, Y. S., Weigand, S. J., Cheetham, A. G., Newcomb, C. J., Stupp, S. I. Spontaneous and x-ray-triggered crystallization at long range in self-assembling filament networks. Science. 327, 555-559 (2010).
- Pashuck, E. T., Cui, H., Stupp, S. I. Tuning supramolecular rigidity of peptide fibers through molecular structure. Journal of the American Chemical Society. 132, 6041-6046 (2010).
- Stupp, S. I., Zha, R. H., Palmer, L. C., Cui, H., Bitton, R. Self-assembly of biomolecular soft matter. Faraday Discussions. 166, 9-30 (2013).
- Conda-Sheridan, M., Lee, S. S., Preslar, A. T., Stupp, S. I. Esterase-activated release of naproxen from supramolecular nanofibres. Chemical Communications. 50, 13757-13760 (2014).
- Mata, A., Palmer, L., Tejeda-Montes, E., Stupp, S. I. Design of biomolecules for nanoengineered biomaterials for regenerative medicine. Nanotechnology in Regenerative Medicine. , 39-49 (2012).
- Samad, M. B., Chhonker, Y. S., Contreras, J. I., McCarthy, A., McClanahan, M. M., Murry, D. J., Conda-Sheridan, M. Developing Polyamine-Based Peptide Amphiphiles with Tunable Morphology and Physicochemical Properties. Macromolecular bioscience. 17, (2017).
- Nel, A. E., Mädler, L., Velegol, D., Xia, T., Hoek, E. M., Somasundaran, P., Klaessig, F., Castranova, V., Thompson, M. Understanding biophysicochemical interactions at the nano-bio interface. Nature Materials. 8, 543 (2009).
- Gujrati, M., Malamas, A., Shin, T., Jin, E., Sun, Y., Lu, Z. -. R. Multifunctional cationic lipid-based nanoparticles facilitate endosomal escape and reduction-triggered cytosolic siRNA release. Molecular Pharmaceutics. 11, 2734-2744 (2014).
- Zhu, Y., Li, J., Kanvinde, S., Lin, Z., Hazeldine, S., Singh, R. K., Oupický, D. Self-immolative polycations as gene delivery vectors and prodrugs targeting polyamine metabolism in cancer. Molecular Pharmaceutics. 12, 332-341 (2014).
- Planas-Portell, J., Gallart, M., Tiburcio, A. F., Altabella, T. Copper-containing amine oxidases contribute to terminal polyamine oxidation in peroxisomes and apoplast of Arabidopsis thaliana. BMC Plant Biology. 13, 109 (2013).
- Nash, I. A., Bycroft, B. W., Chan, W. C. Dde – A selective primary amine protecting group: A facile solid phase synthetic approach to polyamine conjugates. Tetrahedron Letters. 37, 2625-2628 (1996).
- Ralhan, K., KrishnaKumar, V. G., Gupta, S. Piperazine and DBU: a safer alternative for rapid and efficient Fmoc deprotection in solid phase peptide synthesis. RSC Advances. 5, 104417-104425 (2015).
- Casero, R. A., Marton, L. J. Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases. Nature Reviews Drug Discovery. 6, 373 (2007).
- Wuts, P. G. M., Greene, T. W. . Protection for the Amino Group. In Greene’s Protective Groups in Organic Synthesis. , 696-926 (2006).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. Journal of Peptide Science. 13, 143-148 (2007).

