القياس الكمي لثلاثه آفات الحمض النووي عن طريق قياس الطيف الكتلي وتقييم مستوياتها في انسجه الفئران المعرضة للجسيمات الدقيقة المحيطة
Summary
ونحن هنا وصف طرق لتحديد الكمية الحساسة ودقيقه من آلافات 8-oxo-7 ، 8-ديهيدرو-2’غوانوسين (8-oxodGuo) ، 1 ،ن6-ايثينو-2 ‘-ديوكسينونونوسين (1 ،ن6-dado) و 1 ،n– غوانوسين (1,N2-DGUO) في الحمض النووي. وقد طبقت الطرق علي تقييم اثار الجسيمات الدقيقة المحيطة (PM2.5) في الانسجه (الرئة والكبد والكلي) من الفئران المكشوفة A/J.
Abstract
الحمض النووي والأحماض النووية المؤكسدة هي أمثله من آفات الحمض النووي التي هي مفيده العلامات الحيوية لتقييم السمية من المواد التي هي الكتروفيريك ، توليد الكهربائية رد الفعل علي التحول الإحيائي ، أو الحث علي الاكسده. من بين النيوبيواسات المؤكسدة ، والأكثر دراسة واحد هو 8-oxo-7 ، 8-ديهيدروجوانيني (8-oxoGua) أو 8-اوكسو-7 ، 8-ديهيدرو-2 ‘-غوانوسين (8-oxodGuo) ، وهو البيولوجية من الضرر قاعده المستحثة بشكل مؤكسد في الحمض النووي. الديهيديس و ابكسييلديهيديس الناتجة عن عمليه الاكسده الدهنية هي جزيئات كهربية قادره علي تشكيل أنابيب الحمض النووي المتحولة وراثيا ، مثل القناات etheno 1 ،n2-etheno-2′-غوانوسين (1 ،n2– εdGuo) و 1,n6-ايثينو-2 ‘-ديوكسينونوسين (1,ن6-εdado), التي تم اقتراحها كمؤشرات الحيوية المحتملة في الفيزيولوجيا المرضية للالتهاب. والأساليب الانتقائية والحساسة لقياسها في الحمض النووي ضرورية لوضع استراتيجيات وقائية لإبطاء معدلات طفرة الخلايا وتطور الامراض المزمنة (مثل السرطان والامراض التنكسية العصبية). ومن بين الطرق الحساسة المتاحة للكشف عنها (اللوني السائل عاليه الأداء إلى جانب كاشفات الطيف الكهروكيميائية أو ترادفية ، فحص المذنب ، اختبارات المناعة ، 32P-التسميات البريدية) ، والأكثر انتقائية هي تلك التي تستند علي اللوني السائل عالي الأداء إلى جانب الطيف الكتلي الترادفي (HPLC-ESI-MS/MS). الانتقائية هي ميزه أساسيه عند تحليل العينات البيولوجية المعقدة و HPLC-ESI-MS/MS تطورت كمعيار الذهب للقياس الكمي من النيونوسيدس المعدلة في المصفوفات البيولوجية ، مثل الحمض النووي والبول والبلازما واللعاب. ويضيف استخدام المعايير الداخلية المسمية بالنظائر ميزه التصحيحات المتعلقة بخسائر الجزيئات اثناء التحلل بالحمض النووي والخطوات التحليلية للتحليل ، فضلا عن الاختلافات في التاين التحليلي بين العينات. كما انه يساعد في تحديد ذروه الكروماتوغرافي الصحيحة عند وجود أكثر من ذروه واحده.
نقدم هنا التحقق من صحة حساسة ودقيقه ودقيقه HPLC-ESI-MS/MS الأساليب التي تم تطبيقها بنجاح لتحديد الكمية من 8-oxodGuo ، 1 ،ن6-dado و 1 ،n2-dado في الرئة والكبد والكلي الحمض النووي للفئران A/J تقييم اثار التعرض المحيطة PM2.5 .
Introduction
بعض أنواع الأكسجين التفاعلية (ROS) قادره علي أكسده الروابط المزدوجة الكربون من قواعد الحمض النووي وبعض الكربونات في moiety ديوكسيريبوز ، وتوليد القواعد المؤكسدة وفواصل حبلا الحمض النووي1. كجزيء مشحونة سلبا الغنية في ذرات النيتروجين والأكسجين ، والحمض النووي هو أيضا هدف للمجموعات الكهربائية التي تتفاعل بشكل تساهميا مع المواقع النونويه (النيتروجين والأكسجين) ، وإعطاء المنتجات التي تسمي الحمض النووي القناات2. لذلك ، الحمض النووي الأنابيب والأحماض النووية المؤكسدة هي أمثله من آفات الحمض النووي التي هي مفيده العلامات الحيوية لتقييم السمية من المواد التي هي الكتروفيريك ، توليد الكهربائية رد الفعل علي التحول الإحيائي ، أو الحث علي الاكسده1، 2– علي الرغم من ان قواعد الحمض النووي المعدلة يمكن ازالتها من الحمض النووي عن طريق إصلاح الاستئصال القاعدي أو النوكليوتيد (BER أو NER) ، فان التحريض علي عدم التوازن بين توليد وأزاله آفات الحمض النووي لصالح السابق يؤدي إلى زيادة صافيه في مستوياتها في العمل الإضافي للحمض النووي3 . النتائج هي زيادة معدلات طفرة الحمض النووي ، وانخفاض التعبير الجيني ، وتقلص النشاط البروتين2،4،5،6،7، والآثار التي ترتبط ارتباطا وثيقا تطور الامراض. قد تؤثر طفرات الحمض النووي علي وظائف خلوية متنوعة ، مثل إشارات الخلايا ، ودوره الخلايا ، وسلامه الجينوم ، واستقرار التيتيمير ، والنعوت ، وهيكل الكروماتين ، والربط الريبي ، وتوازن البروتين ، والأيض ، والخلايا المبرمجة ، وتمايز الخلية8 ،9. استراتيجيات لإبطاء معدلات الطفرة الخلية وتطوير الامراض المزمنة (مثل السرطان, امراض الأعصاب) تمر من خلال معرفه مصادر الطفرة, من بينها, آفات الحمض النووي وأسبابها.
ومن الأسباب الهامه للضرر الجزيء ، بما في ذلك الحمض النووي وتلف الدهون ، الاصابه بالامراض المزمنة بسبب التعرض للتلوث ، والتهابالمستمر ، والمرض الباثولوجي المرضي (مثل مرض السكري) ، وما إلى ذلك. وعلي سبيل المثال ، فان الراديكالية الهيدروكسيل عاليه التفاعل (OH) شكلت من H2O2 الحد من خلال الانتقال أيونات المعادن (Fe2 +، Cu +) أكسده قواعد الحمض النووي ، والحمض النووي السكر شارده والأحماض الدهنية غير المشبعة في السيطرة علي انتشار معدلات10. من بين 80 التي تتميز بالفعل النيوبواسات المؤكسدة3، والأكثر دراسة واحد هو 8-oxo-7 ، 8-ديهيدروجوانيني (8-oxoGua) أو 8-oxo-7 ، 8-ديهيدرو-2’غوانوسين (8-oxodGuo ، الشكل 1) ، وهي آلافه التي هي قادره علي الحث GT transversions خلايا الثدييات10،11. يتم تشكيلها من قبل أحاديه الاكسده الكترونيه من الغوانين ، أو بواسطة الهيدروكسيل الراديكالية أو الهجوم الأكسجين قميص من الغوانين في الحمض النووي1. الأحماض الدهنية غير المشبعة هي الأهداف الهامه الأخرى للاكسده عاليه التفاعل, مثل •آوه, التي تبدا عمليه الاكسده الدهنية1,12. فانه يعطي ارتفاعا إلى أكاسيد الهيدروجين الأحماض الدهنية التي قد تتحلل لالالديهيدات الكهربائية و ابكسييلديهيديس, مثل مالونوديهايد, 4-هيدروكسي-2-نونينال, 2, 4-ديكادينال, 4, 5-الايبوكسي-(2ه)-ديسينال, hexenal, اكرولاين, كروتونالديهيد, وهي قادره علي تشكيل مغيرات الحمض النووي المبيدات الوراثية ، مثل مالونوديهايد-، propano-، أو etheno ادوكتس1،12،13. القناات etheno 1,n2-etheno-2 ‘-غوانوسين (1,n2-εdguo, الشكل 1) و 1,n6-ايثينو-2 ‘-ديوكسينونوسين (1,ن6-εdado, الشكل 1 ) وقد اقترح كالمؤشرات الحيوية المحتملة في الفيزيولوجيا المرضية للالتهاب14،15.
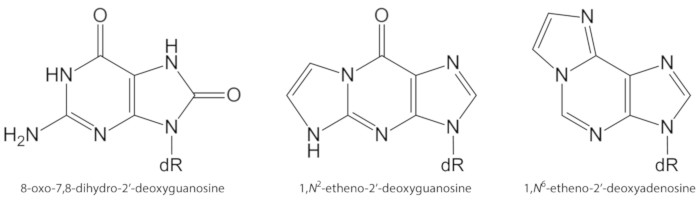
الشكل 1 الهياكل الكيميائية للآفات الحمض النووي الكمية في هذه الدراسة. الدكتور = 2 ‘ ديوكسيريبوز. وقد تم تعديل هذا الرقم من اوليفيرا وآخرون34. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
سمحت الدراسات التي أجريت في أوائل الثمانينات بالكشف الحساس ل 8-oxodGuo بواسطة اللوني السائل عالي الأداء إلى جانب الكشف الكهروكيميائي (HPLC-نماء الطفولة المبكرة). القياس الكمي من 8-oxodguo بواسطة hplc-النماء في الطفولة الباكرة في العديد من النظم البيولوجية التي خضعت لظروف مؤكسده أدت إلى الاعتراف 8-oxodguo كمؤشر حيوي من الضرر قاعده المستحثة بالاكسده في الحمض النووي1,16. علي الرغم من ان قويه والسماح للقياس الكمي من 8-oxodGuo في نطاق fmol منخفضه17, قياسات hplc-النماء في مرحله الطفولة المتوسطة تعتمد علي دقه الوقت الاحتفاظ التحليلية لتحديد التحليل وعلي القرار اللوني لتجنب التدخلات من مكونات عينه أخرى. كما يتطلب الكشف الكهروكيميائية استخدام الملح (علي سبيل المثال ، فوسفات البوتاسيوم ، خلات الصوديوم) في المرحلة المتنقلة ، والحفاظ علي الظروف التحليلية المناسبة يحتاج العمود الروتيني والمعدات وقت التنظيف.
بدلا من ذلك ، فان استخدام الحمض النووي البكتيرية إصلاح الانزيم الحمض النووي الجليكوسيلاسي (fpg) و ، بعد ذلك ، الإنسان 8-oxoguanine جليكوسيلاسي 1 (hOGG1) ، للكشف عن وأزاله 8-oxogua من الحمض النووي ، برزت كوسيلة لتحريض الحمض النووي القلوي عطوب مواقع. يتم تحويل المواقع القلوية عطوب إلى فواصل حبلا الحمض النووي والسماح للقياس الدقيق غير المباشر عاليه جدا من 8-oxogua القلوية خليه واحده هلام الكهربائي (“فحص المذنب”). الحساسية العالية وإنجاز التحاليل دون الحاجة إلى استخراج الحمض النووي الخلوي هي المزايا الرئيسية لهذا النوع من الفحص. فانه يعطي ادني مستويات الحالة الثابتة من 8-oxoGua في الحمض النووي ، عاده 7-10 مرات اقل من المستويات التي تم الحصول عليها من قبل الأساليب التحليلية الحيوية علي أساس HPLC. ومع ذلك ، فمن قياس غير مباشر من 8-oxogua وبعض العيوب هي عدم وجود خصوصية أو الكفاءة غير معروفه لانزيمات الإصلاح المستخدمة1،16،18.
اختبارات المناعية هي مجموعه أخرى من الأساليب المستخدمة للكشف عن 8-oxoGua1 و adducts الحمض النووي exocyclic, مثل 1,n6-dado و 1,n2-dado12. علي الرغم من الحساسية ، والقصور في استخدام الأجسام المضادة للكشف عن آفات الحمض النووي هو عدم وجود خصوصية بسبب التفاعل التبادلي إلى مكونات أخرى من العينات البيولوجية ، بما في ذلك قواعد الحمض النووي الطبيعي1،12. ويمكن أيضا الكشف عن الحمض النووي المبيدات ، بما في ذلك 1 ،n6-Dado و 1 ،n2-dado ، وتحديدها كميا من قبل 32حساسة للغاية المقايسات P-postlabeling12. حساسية عاليه من 32P-التسمية البريدية يسمح باستخدام كميات صغيره جدا من الحمض النووي (علي سبيل المثال ، 10 ميكروغرام) للكشف عن حوالي 1 معقد إضافي لكل 10 10 قواعد طبيعيه19. ومع ذلك ، فان استخدام المواد الكيميائية الراديويه ، وعدم وجود خصوصية كيميائية وانخفاض الدقة هي بعض العيوب19،20.
والتقييد المشترك للأساليب المذكورة أعلاه هو الانتقائية أو التحديد المنخفض للكشف عن الجزيئات المطلوبة. في هذا السيناريو ، HPLC بالاضافه إلى التاين بالكهرباء بالتوازي الطيف الكتلي (HPLC-ESI-MS/MS و HPLC-MS3) تطورت كمعيار الذهب للقياس الكمي من النيونوسيدس المعدلة في المصفوفات البيولوجية ، مثل الحمض النووي والبول والبلازما واللعاب 1 , 19 , 20. مزايا HPLC-ESI-MS/ms طرق هي حساسية (عاده في نطاق fmol منخفضه) والخصوصية العالية التي قدمتها ط) الانفصال الكروماتوغرافي ، الثاني) السمة والمعروفة نمط من تجزئه جزيء داخل كتله مطياف الاصطدام الغرفة ، والثالث) القياس الدقيق للكتلة المحددة لتهمه نسبه (m/z) في رد فعل متعددة وضع الرصد1،19. ويضيف استخدام المعايير الداخلية المسمية بالنظائر ميزه التصحيحات المتعلقة بخسائر الجزيئات اثناء التحلل بالحمض النووي والخطوات التحليلية للتحليل ، فضلا عن الاختلافات في التاين التحليلي بين العينات. هو أيضا [ايدس] في التحديد من ال يصح [كروغرفيك] قمة عندما أكثر من واحده قمة يكون حاضره1,12,19,20.
وقد استخدمت عده طرق علي أساس hplc-ESI-ms/ms للقياس الكمي من 8-oxodguo, 1,n6-dado و 1,n2-dado في الحمض النووي المستخرج من عينات بيولوجية مختلفه12,15,20 ،21،22،23،24،25،26،27،28،29 . الجسيمات الدقيقة (PM2.5) تحمل المواد الكيميائية العضوية وغير العضوية ، مثل الهيدروكربونات العطرية متعددة الدوريات ، نيترو-pahs ، الديهيديس ، كيتون ، والأحماض الكربوكسيليه ، الكينولين ، والمعادن ، والأيونات القابلة للذوبان في الماء ، والتي قد تحفز التهاب الاكسده ، والظروف التي تحبذ حدوث الضرر جزيء والمرض30،31،32،33. نقدم هنا التحقق من صحة HPLC-ESI-MS/MS الأساليب التي تم تطبيقها بنجاح للقياس الكمي من 8-oxodGuo ، 1 ،n6-Dado و 1 ،n2-dado في الرئة والكبد والكلي الحمض النووي من الفئران A/J لتقييم اثار المحيطة PM2.5 التعرض34.
Protocol
Representative Results
Discussion
مشكله كبيره وجدت في تحليلات 8-oxodguo من قبل أساليب hplc هو الاستقراء المحتمل لتشكيلها خلال إجراءات العمل من استخراج الحمض النووي ، التحلل الحمضي النووي ، وتركيز الحمض النووي والايزولات22،38. من أجل التقليل من مشكله التشكيل 8-oxodGuo المادية ، فمن المستحسن أضافه ديفيك…
Disclosures
The authors have nothing to disclose.
Acknowledgements
FAPESP (Fundação de الحماية الدستورية 2012/22190-3 و 2012/08616-8) ، CNPq (Proc. 454214/2014-6 و 429184/2016-6) ، الرؤوس ، PRPUSP (Pró-Reitoria de Pesquisa da جامعه de São Paulo) ، INCT INAIRA (MCT/CNPq/FAPESP/الرؤوس/ FAPEMIG/Fابيرج/FAPESP; 573813/2008-6) ، INCT ريدوكورم (FAPESP/CNPq/الرؤوس ؛ 573530/2008-4) ، برنامج العمل الوطني (PRPUSP; 2011.1.9352.1.8) و CEPID ريدوكوما (FAPESP; Proc. 2013/07937-8). وتلقي ت. ف. اوليفيرا و ا. ا. و. اوليفيرا منحا دراسية من FAPESP (2012/21636-8 ، 2011/09891-0 ، 2012/08617-4) والرؤوس (Coordenação دي ابيرفيتشونتو دي بسال دي نيفل سوبيريور). وقد حصل علي زمالات من الشركة المذكورة ، وهي السيدة م. ح. ج. ميديروس ، وب. دي ماسسيو ، وب. ح. ن. سالديفا ، والسيد ا. م. لورييرو.
وقد نشرت في الأصل بعض الأرقام والجداول الموجودة في هذا العمل في اوليفيرا A.A.F. et al. السمية الجينية والآثار السمية الجينية في الفئران المعرضة لماده الجسيمات الدقيقة المحيطة المركزة (PM2.5) من مدينه ساو باولو ، البرازيل. الجسيمات وألياف السموم. 15, 40 (2018).
Materials
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
References
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2′-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2′-deoxyguanosine in human cells. Biochemistry. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2′-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2′-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure?. Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2′-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2′-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson’s disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, &. #. 1. 9. 3. ;., Escobar, J. 7,8-Hydroxy-2′-deoxyguanosine/2′-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. . Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40 (2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2′-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2′-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2′-deoxyguanosine and 1,N2-propano-2′-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).

