Количественное определение трех поражений ДНК с помощью масс-спектрометрии и оценки их уровней в тканях мышей, подвергшихся воздействию мелких твердых частиц
Summary
Мы описываем здесь методы для чувствительной и точной количественной оценки поражений 8-оксо-7, 8-дигидро-2′-дезоксигуанозин (8-Окродго), 1,n6-этено-2′-дезоксиаденозин (1,n6-Дадо) и 1,n2– этено-2′-дезоксигуаньзин (1,N2-ДГО) в ДНК. Эти методы применялись при оценке воздействия мелких твердых частиц (ТЧ2,5) в тканях (легких, печени и почек) подвергшихся воздействию A/J мышей.
Abstract
ДНК-протоки и окисленные базы ДНК являются примерами повреждений ДНК, которые являются полезными биомаркерами для оценки токсичности веществ, которые электрофильные, генерировать реактивные электрофилы при биотрансформации, или индуцировать окислительный стресс. Среди окисленных нуклеобаз наиболее изученной является 8-оксо-7, 8-дигидрогуанин (8-Оксигуа) или 8-оксо-7, 8-дгидро-2′-дезоксигуаньзин (8-Окродго), биомаркер окислительно индуцированного базового повреждения в ДНК. Альдегиды и эпоксидииды в результате процесса перекисного окисления липидов являются электрофильными молекулами, способными образовывать мутагенные экзоциклические ДНК-протоки, такие как эгенские аддукты 1,n2-этено-2′-дезоксигуанозин (1,n2– в) и 1,n6-этено-2′-дезоксиаденозин (1,n6-на-в), которые были предложены в качестве потенциальных биомаркеров в патофизиологии воспаления. Селективные и чувствительные методы для их количественной оценки в ДНК необходимы для разработки профилактических стратегий для замедления темпов мутации клеток и развития хронических болезней (например, рака, нейродегенеративных заболеваний). Среди чувствительных методов их обнаружения (высокопроизводительного жидкостного хроматографии в сочетании с электрохимическим или тандем масс-спектрометрических детекторов, кометы анализ, иммуноанализы, 32P-постмаркировки), наиболее избирательным являются те, основанные на высокой производительности жидких хроматографии в сочетании с тандем масс-спектрометрии (HPLC-ЭСИ-МС/МС). Селективность является существенным преимуществом при анализе сложных биологических образцов и HPLC-НЕЗИ-МС/МС превратилась в золотой стандарт для количественной оценки модифицированных нуклеолы в биологических матрицах, таких как ДНК, моча, плазма и слюна. Польза изотопно чистых маркированные внутренне стандарты добавляет преимущество коррекций для потерь молекулы во время этапов гидролиза дна и анализата обогащения, также, как для разницы анализирована ионизации между образцами. Это также помогает в идентификации правильной хроматографической пик, когда более чем один пик присутствует.
Мы представляем здесь проверены чувствительной, точной и точной HPLC-НЕЗИ-MS/MS методы, которые были успешно применены для количественной оценки 8-oxodGuo, 1,N6-Дадо и 1,n2-ДГО в легких, печень и почки ДНК A/J мышей для Оценка воздействия окружающей среды ТЧ2,5 .
Introduction
Некоторые активные виды кислорода (ROS) способны окислять двойные углеродные связи баз ДНК и некоторые углероды в дезоксирибозе, создавая окисленные базы и разрывы ДНК-нити1. В качестве отрицательно заряженной молекулы, богатой атомами азота и кислорода, ДНК также является мишенью для электрофильных групп, которые ковалентно реагируют с нуклеофильных участков (азота и кислорода), давая продукты, которые называются ДНК аддуктов2. Таким образом, ДНК-аддукты и окисленные базы ДНК являются примерами повреждений ДНК, которые являются полезными биомаркерами для оценки токсичности веществ, которые электрофильные, генерировать реактивные электрофилы при биотрансформации, или индуцировать окислительный стресс1, 2. Хотя модифицированные базы ДНК могут быть удалены из ДНК с помощью базы или эксцизии нуклеотидов (BER или NER), индукция дисбаланса между генерацией и удалением поражений ДНК в пользу первого приводит к чистому увеличению их уровней в сверхурочных ДНК3 . Результаты являются увеличение скорости мутации ДНК, снижение экспрессии генов, и уменьшилась активность белка2,4,5,6,7, эффекты, которые тесно связаны с развития болезней. Мутации ДНК могут влиять на различные клеточные функции, такие как клеточная сигнализация, клеточный цикл, целостность генома, стабильность теломер, эпигеном, Структура хроматина, РНК-сплайсинг, протеиновый гомеостаз, метаболизм, апоптоз и клеточная дифференциация8 ,9. Стратегии, направленные на замедление темпов мутации клеток и развитие хронических заболеваний (например, рак, нейродегенеративные заболевания) проходят через знание источников мутации, среди них, поражения ДНК и их причины.
ROS генерируемые эндогенно в избытке, из-за воздействия загрязнителей, стойкие воспаления, патофизиологии болезни (например, диабет) и т.д., являются важными причинами био повреждения, включая ДНК и повреждение липидов1. В качестве примера, Высокореактивные гидроксильные радикальные (OH) формируется из H2O2 уменьшение переходных ионов металлов (Fe2 +, Cu+) окисляет ДНК баз, ДНК сахара Моисея и полиненасыщенных жирных кислот при диффузии контролируемых ставки10. Среди 80 уже охарактеризовано окисленные нуклеобазы3, наиболее изученное из них-8-оксо-7, 8-дигидрогуанин (8-оксигуа) или 8-оксо-7, 8-diгидро-2′-дезоксигуаньозин (8-Окродго, рис. 1 клетки млекопитающих10,11. Он формируется моноэлектронным окислением гуанина, или гидроксильных радикалами или сингзным кислородной атакой гуанина в ДНК1. Полиненасыщенные жирные кислоты являются другими важными целями высокореактивных окислители, такие как •Oh, которые инициируют процесс перекисного окисления липидов1,12. Он порождает гидропероксиды жирных кислот, которые могут разлагаться на электрофильные альдегиды и эпоксидииды, такие, как малондиалдегид, 4-гидрокси-2-нонеал, 2, 4-decadienal, 4, 5-эпоксидной-(2е)-decenal, гексенал, акролейн, кротональдегид, которые являются способны образовывать мутагенное экзоцикловую ДНК-аддукты, такие как малондиалдегид-, пропано-, или этено аддукс1,12,13. Этено-аддукты 1,n2-этоно-2′-дезокгугуаньозин (1,n2-в., рис. 1) и 1,n6-Этоно-2′-дезоксиаденозин (1,n6-, на рисунке 1 ) были предложены в качестве потенциальных биомаркеров в патофизиологии воспаления14,15.
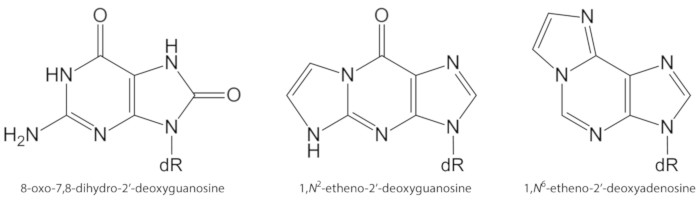
На рисунке 1. В настоящем исследовании количественно определены химические структуры повреждений ДНК. dR = 2 ́-дезоксирибоза. Эта цифра была изменена с Оливейра et al.34. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
Исследования, проведенные в начале 1980-х годов, позволили чувствительное обнаружение 8-Окродго высокой производительностью жидкой хроматографии, связанной с электрохимическим обнаружением (HPLC-РДРВ). Количественное определение 8-окродго путем HPLC-РДРВ в нескольких биологических системах, подвергшихся окислительной конъюнкции, привело к распознаванию 8-окродго как биомаркера оксидативно индуцированного базового повреждения в ДНК1,16. Несмотря на прочность и возможность количественной оценки 8-oxodGuo в низком диапазоне17, HPLC-РДРВ измерений полагаться на точность анализатор времени удержания для анализа идентификации и на разрешение хроматографии, чтобы избежать помех других составляющих выборки. Поскольку для электрохимического обнаружения требуется использование соли (например, фосфата калия, ацетат натрия) на подвижной фазе, поддержание адекватных аналитических условий требует регулярной очистки времени и оборудования.
С другой стороны, использование бактериального ДНК репарации фермента формаламидина ДНК гликозилазы (ФПГ) и, впоследствии, человеческий 8-оксигуанин гликозиназы 1 (hOGG1), для обнаружения и удаления 8-Oxoгуа из ДНК, возникла как способ для индукции ДНК щелочных лабильных Сайтов. Щелочные лабильные узлы преобразуются в разрывы в ДНК и позволяют очень высоко чувствительным косвенным количественному измерению 8-oxoGua путем щелочного электрофореза одноклеточного геля (“анализ кометы”). Высокая чувствительность и выполнение анализов без необходимости клеточной экстракции ДНК являются основными преимуществами этого типа анализа. Он дает самые низкие устойчивые-государственные уровни 8-oxoGua в ДНК, как правило, 7-10 раз ниже, чем уровни, полученные биоаналитическими методами, основанными на HPLC. Однако, это косвенное измерение 8-oxogua и некоторые недостатки являются отсутствие специфики или неизвестной эффективности ремонтных ферментов, используемых1,16,18.
Иммуноанализы представляют собой другой набор методов, используемых для обнаружения 8-Оксикогуа1 и экзоцикликс ДНК-аддуктов, таких как 1,n6-Дадо и 1,n2-ДГО12. Несмотря на чувствительность, недостатком использования антител для выявления повреждений ДНК является отсутствие специфики из-за перекрестной реактивности других компонентов биологических образцов, в том числе нормальных баз ДНК1,12. ДНК экзоциклика, в том числе 1,n6-Дадо и 1,n2-ДГО, также могут быть обнаружены и количественно по высокочувствительным 32P-postlabeling анализ12. Высокая чувствительность 32P-постмаркировки позволяет использовать очень небольшое количество ДНК (например, 10 мкг) для обнаружения около 1 аддода на 1010 нормальных баз19. Однако использование радиохимикатов, отсутствие химической специфичности и низкая точность являются некоторыми недостатками19,20.
Общим ограничением указанных выше методов является низкая избирательность или специфичность для обнаружения желаемых молекул. В этом сценарии, HPLC в сочетании с электрораспылителем ионизации тандем масс-спектрометрии (HPLC-ЭСИ-МС/МС и HPLC-MS3) превратилась в золотой стандарт для количественной оценки модифицированных нуклеолы в биологических матрицах, таких как ДНК, моча, плазма и слюна 1 , в 19 , 20. преимуществами HPLC-ЭСИ-МС/МС являются чувствительность (как правило, в низком диапазоне фмоль) и высокая специфичность, предоставляемая i) Хроматографическое разделение, II) Характеристика и известный образец фрагментации молекул внутри массы спектрометр столкновение камеры, и III) точное измерение выбранной массы для зарядки соотношение (m/z) в нескольких режиме мониторинга реакции1,19. Польза изотопно чистых маркированные внутренне стандарты добавляет преимущество коррекций для потерь молекулы во время этапов гидролиза дна и анализата обогащения, также, как для разницы анализирована ионизации между образцами. Он также помогает в определении правильного хроматографического пика, когда более чем один пик присутствует1,12,19,20.
Несколько методов, основанных на хплс-Нези-МС/МС были использованы для количественной оценки 8-окродго, 1,N6-Дадо и 1,N2-ДГО в ДНК, извлеченные из различных биологических образцов12,15,20 ,21,22,23,24,25,26,27,28,29 . Мелкие частицы (PM2,5) несут органические и неорганические химические вещества, такие как полициклические ароматические углеводороды (ПАУ), нитро-ПАУ, альдегиды, кетоны, карбокфильные кислоты, хинолинов, металлы и водорастворимые ионы, которые могут вызывать воспаление и окислительный стресс, условия, благоприятствуют возникновению био повреждений и заболеваний30,31,32,33. Мы представляем здесь подтверждены HPLC-НЕЗИ-МС/МС методы, которые были успешно применены для количественной оценки 8-oxodGuo, 1,N6-Дадо и 1,N2-ДГО в легких, печени и почек ДНК A/J мышей для Оценка воздействия окружающего PM2,5 экспозиции34.
Protocol
Representative Results
Discussion
Основная проблема, найденная в 8-окродго анализы методами HPLC является возможная индукция его образования во время обследование процедур извлечения ДНК, ДНК-гидролиза, и концентрация ДНК-гидролизатов22,38. Для минимизации проблемы 8-Оксодго артифактологич?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
FAPESP (Фундасао де ампаро à Пескиса ду Сан-Паулу, proc. 2012/22190-3 и 2012/08616-8), CNPq (proc. 454214/2014-6 и 429184/2016-6), накидки, PRPUSP (про-Рейториа де Пескиса Da Universidade de Сан-Паулу), ИНКТ ИНАРА (ПРМ/CNPq/ННКТ/МЫСЫ/ FAPEMIG/FАПЕРJ/FAPESP; Proc. 573813/2008-6), ИНКТ (FAPESP/CNPq/МЫСЫ; Proc. 573530/2008-4), НПД Реддоксома (ПРПУПП; Proc. 2011.1.9352.1.8) и СЕПИД Ресдокома (FAPESP; Proc. 2013/07937-8). Т. ф. Оливейра и а. а. ф. Оливейра получил стипендии от FAPESP (proc. 2012/21636-8, 2011/09891-0, 2012/08617-4) и МЫСОВ (coordenação de Аперфечоаменту де Пессоаль де Нивель). Стипендиаты из CNPq получили м. х. г. Медейрос, Пи ди Массио, P. H. N. Saldiva и а. м. Лурейро.
Некоторые цифры и таблицы, присутствующие в этой работе были первоначально опубликованы в Оливейра А.А.Ф. et al. генотоксические и эпигентоксические эффекты у мышей, подверженных воздействию концентрированных окружающих мелких твердых частиц (PM2,5) из города Сан-Паулу, Бразилия. Частица и клетчатка токсикологии. 15, 40 (2018).
Materials
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
References
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2′-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2′-deoxyguanosine in human cells. Biochemistry. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2′-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2′-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure?. Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2′-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2′-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson’s disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, &. #. 1. 9. 3. ;., Escobar, J. 7,8-Hydroxy-2′-deoxyguanosine/2′-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. . Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40 (2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2′-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2′-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2′-deoxyguanosine and 1,N2-propano-2′-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).

