Quantificação de três lesões de DNA por espectrometria de massas e avaliação de seus níveis em tecidos de camundongos expostos a material particulado fino ambiente
Summary
Nós descrevemos aqui métodos para a quantificação sensível e exata das lesões 8-oxo-7,8-dihydro-2 ‘-deoxyguanosine (8-oxodGuo), 1,n6-etheno-2 ‘-deoxyadenosine (1,n6-dAdo) e 1,n2– etheno-2′-deoxyguanosine (1,N2-DGUO) no ADN. Os métodos foram aplicados na avaliação dos efeitos da matéria particulada fina ambiente (PM2,5) nos tecidos (pulmão, fígado e rim) de camundongos a/J expostos.
Abstract
Os adutos do DNA e as bases oxidadas do ADN são exemplos das lesões do ADN que são biomarcadores úteis para a avaliação da toxicidade das substâncias que são electrophilic, geram eletrófilos reactivos em cima da biotransformação, ou induzem o stress oxidativo. Dentre as nucleobases oxidadas, a mais estudada é a 8-oxo-7,8-dihidroguanina (8-oxoGua) ou 8-oxo-7,8-dihidro-2 ‘-Desoxiguanosina (8-oxodGuo), um biomarcador de dano base oxidativamente induzido no DNA. Os aldeídos e os epoxyaldehydes resultantes do processo da peroxidação do lipido são as moléculas substituição capazes de dar forma aos adutos exocíclicas mutagénicas do ADN, tais como os adutos 1,n2-eteno-2′-deoxyguanosine do eteno (1,n2– εdGuo) e 1,n6-etheno-2 ‘-deoxyadenosine (1,n6-εdado), que foram sugeridos como biomarcadores potenciais na fisiopatologia da inflamação. Métodos seletivos e sensíveis para sua quantificação no DNA são necessários para o desenvolvimento de estratégias preventivas para retardar as taxas de mutação celular e o desenvolvimento crônico da doença (por exemplo, câncer, doenças neurodegenerativas). Entre os métodos sensíveis disponíveis para sua detecção (cromatografia líquida de alta eficiência acoplada a detectores de espectrometria de massas eletroquímicas ou em tandem, ensaio cometa, imunoensaios, 32P-pós-rotulagem), os mais seletivos são aqueles baseados em cromatografia líquida de alta eficiência acoplada à espectrometria de massas em tandem (HPLC-ESI-MS/MS). A seletividade é uma vantagem essencial na análise de amostras biológicas complexas e a HPLC-ESI-MS/MS evoluiu como padrão-ouro para quantificação de nucleosídeos modificados em matrizes biológicas, como DNA, urina, plasma e saliva. O uso de padrões internos isotopicamente rotulados acrescenta a vantagem de correções para perdas de moléculas durante a hidrólise do DNA e as etapas de enriquecimento do analito, bem como para as diferenças da ionização do analito entre as amostras. Também auxilia na identificação do pico cromatográfico correto quando mais de um pico está presente.
Nós apresentamos aqui métodos sensíveis, exatos e precisos da HPLC-ESI-MS/MS validados que foram aplicados com sucesso para a quantificação de 8-oxodGuo, 1,n6-DAdo e 1,n2-dguo no ADN do pulmão, do fígado e do rim de ratos de A/J para a avaliação dos efeitos da exposição ambiental PM2,5 .
Introduction
Algumas espécies reativas de oxigênio (ROS) são capazes de oxidar ligações duplas de carbono de bases de DNA e alguns carbonos na fração desoxirribose, gerando bases oxidadas e quebras de fio de DNA1. Como uma molécula carregada negativamente rica em átomos de nitrogênio e oxigênio, o DNA também é um alvo para grupos eletrofílicos que reagem covalentemente com os sítios nucleofílicos (nitrogênio e oxigênio), dando produtos que são chamados de adutos de DNA2. Assim, os adutos do ADN e as bases oxidadas do ADN são exemplos de lesões do ADN que são biomarcadores úteis para a avaliação da toxicidade das substâncias que são electrofílicas, geram eletrófilos reactivos em cima da biotransformação, ou induzem o stress oxidativo1, o 2. Embora as bases modificadas do ADN possam ser removidas do ADN pela base ou pelo reparo da excisão do nucleotide (BER ou NER), a indução de um desequilíbrio entre a geração e a remoção de lesões do ADN em favor do anterior conduz a um aumento líquido de seus níveis no tempo estipulado do ADN3 . Os resultados são o aumento das taxas de mutação do DNA, a redução da expressão gênica e a diminuição da atividade protéica2,4,5,6,7, efeitos que estão intimamente relacionados com a desenvolvimento de doenças. As mutações do DNA podem afetar diversas funções celulares, como sinalização celular, ciclo celular, integridade do genoma, estabilidade do telômero, epigenome, estrutura da cromatina, splicing de RNA, homeostase proteica, metabolismo, apoptose e diferenciação celular8 ,9. Estratégias para retardar as taxas de mutação celular e o desenvolvimento crônico da doença (por exemplo, câncer, doenças neurodegenerativas) passam pelo conhecimento das fontes de mutação, entre elas, as lesões do DNA e suas causas.
ROS gerados endogenamente em excesso, devido à exposição ao poluente, inflamação persistente, fisiopatologia da doença (por exemplo, diabetes), etc., são causas importantes de dano da biomolécula, incluindo o DNA e o dano lipídico1. Como exemplo, o radical hidroxila altamente reativo (OH) formado a partir de H2O2 redução por íons metálicos de transição (FE2 +,+ +) oxida as bases de DNA, a fração de açúcar de DNA e os ácidos graxos poliinsaturados em controle de difusão taxas de10. Entre os 80 já caracterizados nucleobases oxidadas3, o mais estudado é 8-oxo-7,8-diidroguanina (8-oxoGua) ou 8-oxo-7,8-dihidro-2 ‘-Desoxiguanosina (8-oxodGuo, Figura 1), uma lesão que é capaz de induzir transversões gt em células mamíferas10,11. É formado pela oxidação eletrônica mono da guanina, ou pelo ataque de oxigênio radical hidroxila ou singlet de guanina no DNA1. Os ácidos graxos poliinsaturados são outros alvos importantes de oxidantes altamente reativos, como •Oh, que iniciam o processo de peroxidação lipídica1,12. Ele dá origem a hidroperóxidos de ácidos graxos que podem se decompor a aldeídos eletrofílicos e epoxialdeídos, tais como malondialdeído, 4-hidroxi-2-nonenal, 2,4-decadienal, 4, 5-epóxi-(2E)-decenal, hexenal, acroleína, crotonaldeído, que são capaz de formar adutos de DNA exocílicos mutagénicos, como os adutos de malondialdeído, propano ou eteno1,12,13. Os adutos de eteno 1,n2-eteno-2′-deoxyguanosine (1,n2-εdguo , Figura 1) e 1,n6-eteno-2 ‘-deoxyadenosine (1,n6-εdado, Figura 1 ) têm sido sugeridas como potenciais biomarcadores na fisiopatologia da inflamação14,15.
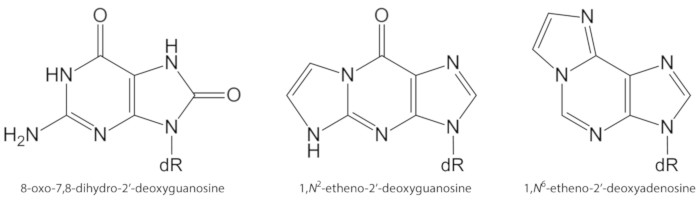
Figura 1. Estruturas químicas das lesões de DNA quantificadas no presente estudo. dR = 2 ́-desoxirribose. Este número foi modificado de Oliveira et al.34. Por favor clique aqui para ver uma versão maior desta figura.
Estudos realizados no início da década de 1980 permitiram a detecção sensível de 8-oxodGuo por cromatografia líquida de alta eficiência acoplada à detecção eletroquímica (HPLC-ECD). A quantificação de 8-oxodguo por HPLC-ECD em diversos sistemas biológicos sujeitados às circunstâncias oxidantes conduziu ao Recognition de 8-oxodguo como um biomarcador de dano de base oxidativamente induzido no ADN1,16. Embora robusto e permitindo a quantificação de 8-oxodguo na escala baixa de fmol17, as medidas do HPLC-ECD confiam na exatidão do tempo da retenção do analito para a identificação do analito e na definição da cromatografia para evitar interferências de outros constituintes da amostra. Como a detecção eletroquímica requer o uso de sal (por exemplo, fosfato de potássio, acetato de sódio) na fase móvel, a manutenção de condições analíticas adequadas precisa de rotina de coluna e tempo de limpeza do equipamento.
Alternativamente, o uso do DNA bacteriano da enzima de reparo do ADN glicosilase do formamidopyrimidine (fpg) e, mais tarde, o glicolisase 1 do humano 8-oxoguanine (hOGG1), para a deteção e a remoção de 8 oxogua do ADN, emergiu como uma maneira para a indução do lábil do alcalóide do ADN Sites. Os locais lábeis do alcalóide são convertidos às rupturas da costa do ADN e permitem a quantificação indireta muito elevada sensível de 8 oxoGua pela electroforese alcalina do gel da única pilha (“ensaio do cometa”). A alta sensibilidade e a realização das análises sem a necessidade de extração de DNA celular são as principais vantagens deste tipo de ensaio. Dá os níveis os mais baixos do estado estacionário de 8 oxoGua no ADN, tipicamente 7-10 vezes mais baixos do que os níveis obtidos por métodos bioanalíticos baseados no HPLC. No entanto, é uma medida indireta de 8-oxogua e algumas desvantagens são a falta de especificidade ou a eficiência desconhecida das enzimas de reparo utilizadas1,16,18.
Os imunoensaios são outro conjunto de métodos utilizados para a detecção de 8-oxoGua1 e ADUTOS de DNA exocídrico, como 1,n6-dAdo e 1,n2-dguo12. Apesar da sensibilidade, uma lacuna do uso de anticorpos para a detecção de lesões de DNA é a falta de especificidade devido à reatividade cruzada a outros componentes de amostras biológicas, incluindo as bases normais de DNA1,12. Os adutos exocílicos de DNA, incluindo 1, n6-DAdo e 1, n2-dguo, também podem ser detectados e quantificados por ensaios altamente sensíveis de 32P-postetiquetagem12. A sensibilidade elevada de 32P-postrotulagem permite o uso de quantidades muito pequenas de ADN (por exemplo, 10 μg) para a deteção de aproximadamente 1 aduto por 1010 bases normais19. No entanto, o uso de radioquímicos, a falta de especificidade química e a baixa acurácia são algumas desvantagens19,20.
Uma limitação compartilhada dos métodos citados acima é a baixa seletividade ou especificidade para a detecção das moléculas desejadas. Nesse cenário, a HPLC acoplada à espectrometria de massas em tandem de ionização por electrospray (HPLC-ESI-MS/MS e HPLC-MS3) evoluiu como padrão-ouro para quantificação de nucleosídeos modificados em matrizes biológicas, como DNA, urina, plasma e saliva 1. º , 19 anos de , 20. vantagens dos métodos de HPLC-ESI-MS/MS são a sensibilidade (tipicamente na baixa escala do fmol) e a especificidade elevada fornecida por i) a separação cromatográfica, II) o teste padrão característico e conhecido da fragmentação da molécula dentro da massa Câmara de colisão do espectrómetro, e III) a medida exata da massa selecionada para carregar a relação (m/z) no modo múltiplo da monitoração da reação1,19. O uso de padrões internos isotopicamente rotulados acrescenta a vantagem de correções para perdas de moléculas durante a hidrólise do DNA e as etapas de enriquecimento do analito, bem como para as diferenças da ionização do analito entre as amostras. Auxilia também na identificação do pico cromatográfico correto quando mais de um pico está presente1,12,19,20.
Vários métodos baseados em HPLC-ESI-MS/MS têm sido utilizados para quantificação de 8-oxodguo, 1,n6-dAdo e 1,n2-dguo em DNA extraído de diferentes amostras biológicas12,15,20 ,21,22,23,24,25,26,27,28,29 . Partículas finas (PM2,5) transportar produtos químicos orgânicos e inorgânicos, tais como hidrocarbonetos policíclicos aromáticos (PAHS), Nitro-PAHS, aldeídos, cetonas, ácidos carboxílicos, quinolinas, metais e íons solúveis em água, que podem induzir inflamação e estresse oxidativo, condições que favorecem a ocorrência de danos biomoléculas e doença30,31,32,33. Nós apresentamos aqui métodos validados de HPLC-ESI-MS/MS que foram aplicados com sucesso para a quantificação de 8-oxodGuo, de 1, den6-dAdo e de 1, den2-dguo no ADN do pulmão, do fígado e do rim de ratos de a/J para a avaliação do efeitos do ambiente PM2,5 exposição34.
Protocol
Representative Results
Discussion
Um problema principal encontrado nas análises 8-oxodguo por métodos da HPLC é a indução possível de sua formação durante os procedimentos do workup da extração do ADN, da hidrólise do ADN, e da concentração de hidrolisados do ADN22,38. A fim de minimizar o problema da formação vesícula 8-oxodguo, recomenda-se a adição de deferoxamina a todas as soluções de extração de DNA, armazenamento e hidrólise, o uso do método de iodeto de sódio agen…
Disclosures
The authors have nothing to disclose.
Acknowledgements
FAPESP (Fundação de Amparo à pesquisa do estado de São Paulo, proc. 2012/22190-3 e 2012/08616-8), CNPq (proc. 454214/2014-6 e 429184/2016-6), CAPES, PRPUSP (Pró-Reitoria de pesquisa da Universidade de São Paulo), INCT INAIRA (MCT/CNPq/FNDCT/CAPES/ FAPEMIG/FAPERJ/FAPESP; Proc. 573813/2008-6), INCT Redoxoma (FAPESP/CNPq/CAPES; Proc. 573530/2008-4), Redoxoma NAP (PRPUSP; Proc. 2011.1.9352.1.8) e CEPID Redoxoma (FAPESP; Proc. 2013/07937-8). T. F. Oliveira e A. A. F. Oliveira receberam bolsas de estudo da FAPESP (proc. 2012/21636-8, 2011/09891-0, 2012/08617-4) e CAPES (coordenação de aperfeiçoamento de pessoal de nível superior). M. H. G. Medeiros, P. di Mascio, P. H. N. Saldiva e A. P. M. Loureiro receberam bolsas do CNPq.
Algumas figuras e tabelas presentes neste trabalho foram originalmente publicadas em Oliveira A.A.F. et al. efeitos genotóxicos e epigenotóxicos em camundongos expostos a matéria particulada de partículas finas (PM2,5) da cidade de São Paulo, Brasil. Toxicologia de partículas e fibras. 15, 40 (2018).
Materials
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
References
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2′-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2′-deoxyguanosine in human cells. Biochemistry. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2′-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2′-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure?. Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2′-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2′-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson’s disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, &. #. 1. 9. 3. ;., Escobar, J. 7,8-Hydroxy-2′-deoxyguanosine/2′-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. . Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40 (2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2′-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2′-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2′-deoxyguanosine and 1,N2-propano-2′-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).

