Kvantificering af tre DNA-læsioner ved massespektrometri og vurdering af deres niveauer i væv af mus udsat for omgivende fine partikler
Summary
Her beskrives metoder til følsom og nøjagtig kvantificering af læsioner 8-oxo-7, 8-dihydro-2′-deoxyguanosin (8-oxodGuo), 1,n6-etheno-2′-deoxyadenosin (1,n6-Dado) og 1,n2– etheno-2′-deoxyguanosin (1,N2-DGUO) i DNA. Metoderne blev anvendt til vurdering af virkningerne af de omgivende fine partikler (PM2,5) i væv (lunge, lever og nyrer) af eksponerede A/J-mus.
Abstract
DNA-addukter og oxiderede DNA-baser er eksempler på DNA-læsioner, der er nyttige biomarkører til toksicitets vurdering af stoffer, der er elektro File, genererer reaktive elektrophiler ved biotransformation eller inducerer oxidativ stress. Blandt de oxiderede nukleobaser, den mest undersøgt en er 8-oxo-7, 8-dihydroguanin (8-oxoGua) eller 8-oxo-7, 8-dihydro-2′-deoxyguanosin (8-oxodGuo), en biomarkør af oxidativt induceret base skade i DNA. Aldehyder og epoxyaldehyder som følge af lipid-peroxiderings processen er elektro File molekyler, der kan danne mutagene exocycliske DNA-addukter, såsom etheno adkanalerne 1,n2-etheno-2′-deoxyguanosin (1,n2– εdGuo) og 1,n6-etheno-2′-deoxyadenosin (1,n6-εdado), som er blevet foreslået som potentielle biomarkører i Patofysiologi af inflammation. Selektive og følsomme metoder til kvantificering af DNA er nødvendige for udviklingen af forebyggende strategier til at bremse celle Mutations rater og kronisk sygdomsudvikling (f. eks. kræft, neurodegenerative sygdomme). Blandt de følsomme metoder til rådighed for deres påvisning (højtydende væskekromatografi koblet til elektrokemiske eller tandem massespektrometri detektorer, Comet assay, immunoassays, 32P-post mærkning), de mest selektive er dem baseret på højtydende væskekromatografi koblet til tandem massespektrometri (HPLC-ESI-MS/MS). Selektivitet er en væsentlig fordel ved analyse af komplekse biologiske prøver og HPLC-ESI-MS/MS udviklet som guld standard for kvantificering af modificerede Nukleosider i biologiske matricer, såsom DNA, urin, plasma og spyt. Brugen af isotopisk mærkede interne standarder tilføjer fordelen ved korrektioner for Molekylær tab under DNA-hydrolyse-og analyt-berignings trinnene samt for forskelle i analytioniseringen mellem prøverne. Det bidrager også til identifikationen af den korrekte kromatografi, når der er mere end et højdepunkt.
Vi præsenterer her validerede følsomme, præcise og præcise HPLC-ESI-MS/MS metoder, der blev anvendt med succes til kvantificering af 8-oxodGuo, 1,N6-Dado og 1,N2-DGUO i lunge, lever og nyre DNA af A/J-mus til vurdering af virkningerne af omgivelsernes PM2,5 -eksponering.
Introduction
Nogle reaktive oxygenarter (ROS) er i stand til at oxideres Carbon dobbeltbindinger af DNA-baser og nogle kulstofatomer i Deoxyribose-delen, genererer oxiderede baser og DNA-streng pauser1. Som et negativt ladet molekyle, der er rigt på nitrogen og oxygen atomer, er DNA også et mål for elektro File grupper, der kovalent reagerer med de nukleofile steder (nitrogen og ilt), hvilket giver produkter, der kaldes DNA-addukter2. Så, DNA addukter og oxiderede DNA-baser er eksempler på DNA-læsioner, der er nyttige biomarkører for toksicitets vurdering af stoffer, der er elektro File, generere reaktive elektro philes ved biotransformation, eller inducere oxidativ stress1, 2. i. Selv om de modificerede DNA baser kan fjernes fra DNA ved base eller nukleotid excision reparation (BER eller NER), induktion af en ubalance mellem generering og fjernelse af DNA-læsioner til fordel for førstnævnte fører til en nettostigning i deres niveauer i DNA overarbejde3 . Resultater er stigningen i DNA-Mutations rater, reduceret genekspression og formindsket protein aktivitet2,4,5,6,7, virkninger, der er tæt forbundet med udvikling af sygdomme. DNA-mutationer kan påvirke forskellige cellulære funktioner, såsom celle signalering, celle cyklus, genomintegritet, telomere stabilitet, epigenom, kromatin struktur, RNA splejsning, protein homøostase, metabolisme, apoptose og Celledifferentiering8 ,9. Strategier til at bremse celle Mutations rater og kronisk sygdomsudvikling (f. eks. kræft, neurodegenerative sygdomme) passerer gennem viden om Mutations kilderne, heriblandt DNA-læsioner og deres årsager.
ROS genereret endogent i overskud, på grund af forurening eksponering, vedvarende inflammation, sygdom Patofysiologi (f. eks diabetes), etc., er vigtige årsager til biomolekyle skade, herunder DNA og lipid skader1. Som et eksempel er den meget reaktive hydroxyl radikal (OH) dannet af H2O2 reduktion af Transition metalioner (fe2 +, cu+) oxiderer DNA baserne, DNA-sukker delen og flerumættede fedtsyrer ved diffusions kontrolleret priser10. Blandt de 80 allerede karakteriseret oxiderede nukleobaser3, den mest undersøgt ene er 8-oxo-7, 8-dihydroguanin (8-oxogua) eller 8-oxo-7, 8-dihydro-2′-deoxyguanosin (8-oxodGuo, figur 1), en læsion, der er i stand til at inducere gt Trans versioner i pattedyrsceller10,11. Det dannes ved mono elektronisk oxidation af guanin eller ved hydroxyl radikal eller singlet oxygen angreb af guanin i DNA1. Flerumættede fedtsyrer er andre vigtige mål for meget reaktive oxidanter, såsom •Oh, som indleder processen med lipid peroxidering1,12. Det giver anledning til fedtsyre hydroperoxider, der kan nedbrydes til elektro File aldehyder og epoxyaldehyder, såsom malondialdehyd, 4-hydroxy-2-nonenal, 2,4-decadienal, 4,5-epoxy-(2E)-decenal, hexenal, acrolein, crotonaldehyd, som er kunne danne mutagene exocycliske DNA-addukter, såsom malondialdehyd-, Propano-eller etheno-addukter1,12,13. Etheno adkanalerne 1,n2-etheno-2′-deoxyguanosin (1,n2-εdguo, figur 1) og 1,n6-etheno-2′-deoxyadenosin (1,n6-εdado, figur 1 ) er blevet foreslået som potentielle biomarkører i Patofysiologi af inflammation14,15.
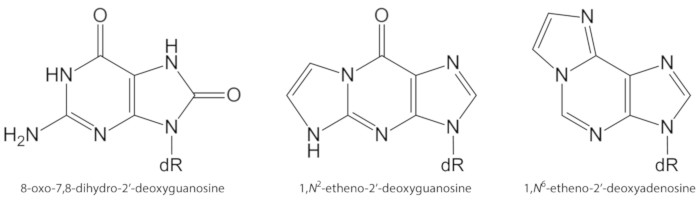
Figur 1. Kemiske strukturer af de DNA-læsioner, der er kvantificeret i nærværende undersøgelse. dR = 2 ́-Deoxyribose. Dette tal er blevet ændret fra Oliveira et al.34. Klik her for at se en større version af dette tal.
Undersøgelser foretaget i begyndelsen af 1980 ‘ erne tillod følsom påvisning af 8-oxodGuo ved højtydende væskekromatografi koblet til elektrokemisk detektion (HPLC-ECD). Kvantificering af 8-oxodguo ved HPLC-ECD i flere biologiske systemer udsat for oxiderende betingelser førte til anerkendelse af 8-oxodguo som en biomarkør af oxidativt induceret base skade i DNA1,16. Selv om den er robust og giver mulighed for kvantificering af 8-oxodGuo i lavfmol-området17, afhænger HPLC-ECD-målingerne af nøjagtigheden af analysand-retentionstiden for analyt-identifikation og af kromatografi opløsningen for at undgå interferenser med andre prøve bestanddele. Da elektrokemisk detektion kræver brug af salt (f. eks. kaliumphosphat, natriumacetat) i den mobile fase, skal vedligeholdelse af passende analytiske betingelser rutine kolonne og rengøringstiden for udstyr.
Alternativt, brugen af bakteriel DNA reparation enzym formamidopyrimidine DNA glycosylase (FPG) og bagefter, humant 8-oxoguanine glycosylase 1 (hOGG1), til påvisning og fjernelse af 8-oxoGua fra DNA, opstod som en måde for induktion af DNA alkali labile Websteder. De alkaliske labile steder omdannes til DNA-streng pauser og tillader en meget høj følsom indirekte kvantificering af 8-oxoGua ved alkalisk enkelt celle gel elektroforese (“Comet assay”). Den høje følsomhed og udførelsen af analyserne uden behov for cellulær DNA ekstraktion er de vigtigste fordele ved denne type analyse. Det giver de laveste Steady-State niveauer af 8-oxoGua i DNA, typisk 7-10 gange lavere end niveauerne opnået ved bioanalytiske metoder baseret på HPLC. Men det er en indirekte måling af 8-oxogua og nogle ulemper er manglen på specificitet eller den ukendte effektivitet af reparation enzymer brugt1,16,18.
Immunoassays er andre sæt metoder, der anvendes til påvisning af 8-oxoGua1 og exocyclic DNA addukter, såsom 1,n6-Dado og 1,n2-dguo12. På trods af følsomheden er en mangel ved brugen af antistoffer til påvisning af DNA-læsioner manglen på specificitet på grund af kryds reaktivitet til andre bestanddele af biologiske prøver, herunder de normale DNA baser1,12. De exocycliske DNA-addukter, herunder 1, n6-Dado og 1, n2-dguo, kan også påvises og kvantificeres af meget følsomme 32P-post mærknings-analyser12. Den høje følsomhed af 32P-post mærkning tillader brug af meget små mængder af DNA (f. eks 10 μg) til påvisning af omkring 1 adduct per 1010 normale baser19. Men brugen af radio-kemikalier, manglende kemisk specificitet og lav nøjagtighed er nogle ulemper19,20.
En fælles begrænsning af de ovenfor citerede metoder er den lave selektivitet eller specificitet for påvisning af de ønskede molekyler. I dette scenario er HPLC koblet til elektro spray ionisering tandem massespektrometri (HPLC-ESI-MS/MS og HPLC-MS3) udviklet som guld standard for kvantificering af modificerede Nukleosider i biologiske matricer, såsom DNA, urin, plasma og spyt 1 af , 19 ud af , 20. fordele ved HPLC-ESI-MS/MS metoder er følsomheden (typisk i den lave fmol Range) og den høje specificitet, som i) kromatografi separation, II) det karakteristiske og kendte mønster af molekyle fragmentering inde i massen spektrometer kollisions kammer og III) nøjagtig måling af den valgte masse til opladnings forhold (m/z) i flere reaktions overvågnings modus1,19. Brugen af isotopisk mærkede interne standarder tilføjer fordelen ved korrektioner for Molekylær tab under DNA-hydrolyse-og analyt-berignings trinnene samt for forskelle i analytioniseringen mellem prøverne. Det bidrager også til identifikationen af den korrekte kromatografi, når der er mere end én top til stede1,12,19,20.
Flere metoder baseret på HPLC-ESI-MS/MS er blevet anvendt til kvantificering af 8-oxodguo, 1, n6-Dado og 1,N2-dguo i dna ekstraheret fra forskellige biologiske prøver12,15,20 ,21,22,23,24,25,26,27,28,29 . Fine partikler (PM2,5) transporterer organiske og uorganiske kemikalier, såsom polycykliske aromatiske kulbrinter (PAH), nitro-PAH’er, aldehyder, ketoner, carboxylsyrer, quinoliner, metaller og vandopløselige ioner, som kan inducere betændelse og oxidativ stress, betingelser, der begunstiger forekomsten af biomolekyle skader og sygdom30,31,32,33. Vi præsenterer her validerede HPLC-ESI-MS/MS-metoder, der med succes blev anvendt til kvantificering af 8-oxodGuo, 1,n6-Dado og 1,N2-dguo i LUNGE-, lever-og nyre-DNA fra A/J-mus til vurdering af virkninger af omgivelsernes PM2,5 -eksponering34.
Protocol
Representative Results
Discussion
Et stort problem, der findes i 8-oxodguo-analyserne ved HPLC-metoder, er den mulige induktion af dets dannelse under arbejdsprocedurerne for DNA-ekstraktion, DNA-hydrolyse og koncentration af DNA-hydrolysater22,38. For at minimere problemet med 8-oxodGuo artifaktuel dannelse anbefales det at tilføje deferoxamin til alle DNA-ekstraktions-, opbevarings-og hydrolyse opløsninger, anvendelse af natriumiodide chaotrope metoden og undgåelse af phenol i DNA-ekstraktio…
Disclosures
The authors have nothing to disclose.
Acknowledgements
FAPESP (Fundação de Amparo à pesquisa do Estado de São Paulo, proc. 2012/22190-3 og 2012/08616-8), CNPq (proc. 454214/2014-6 og 429184/2016-6), CAPES, PRPUSP (Pró-Reitoria de pesquisa da Universidade de São Paulo), INCT INAIRA (MCT/CNPq/FNDCT/CAPES/ FAPEMIG/FAPERJ/FAPESP; Proc. 573813/2008-6), INCT Redoxoma (FAPESP/CNPq/CAPES; Proc. 573530/2008-4), NAP Redoxoma (PRPUSP; Proc. 2011.1.9352.1.8) og CEPID Redoxoma (FAPESP; Proc. 2013/07937-8). T. F. Oliveira og A. A. F. Oliveira modtog stipendier fra FAPESP (proc. 2012/21636-8, 2011/09891-0, 2012/08617-4) og CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior). M. H. G. Medeiros, P. di Mascio, P. H. N. Saldiva og A. P. M. Loureiro modtog stipendier fra CNPq.
Nogle tal og tabeller i dette arbejde blev oprindeligt offentliggjort i Oliveira A.A.F. et al. genotoksiske og epigeno toksiske virkninger hos mus eksponeret for koncentrerede omgivende fine partikler (PM2,5) fra São Paulo City, Brasilien. Partikel-og fiber toksikologi. 15af 40 (2018).
Materials
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
References
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2′-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2′-deoxyguanosine in human cells. Biochemistry. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2′-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2′-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure?. Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2′-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2′-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson’s disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, &. #. 1. 9. 3. ;., Escobar, J. 7,8-Hydroxy-2′-deoxyguanosine/2′-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. . Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40 (2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2′-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2′-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2′-deoxyguanosine and 1,N2-propano-2′-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).

