Kvantifiering av tre DNA-lesioner med masspektrometri och bedömning av deras nivåer i vävnader från möss som utsätts för omgivande fina partiklar
Summary
Vi beskriver här metoder för känslig och noggrann kvantifiering av lesioner 8-oxo-7, 8-dihydro-2 ‘-deoxyguanosin (8-oxodGuo), 1,n6-etheno-2 ‘-deoxyadenosin (1,n6-Dado) och 1,n2– etheno-2 ‘-deoxyguanosin (1,N2-DGUO) i DNA. Metoderna tillämpades på bedömningen av effekterna av omgivande fina partiklar (PM2,5) i vävnader (lungor, lever och njure) av exponerade A/J-möss.
Abstract
DNA-addukter och oxiderade DNA-baser är exempel på DNA-lesioner som är nyttiga bio markörer för toxicitetsbedömningen av substanser som är elektrofila, genererar reaktiva elektrofiler vid bio Transformation eller inducerar oxidativ stress. Bland de oxiderade nukleobaser, den mest studerade en är 8-oxo-7, 8-dihydroguanin (8-oxogua) eller 8-oxo-7, 8-dihydro-2 ‘-deoxyguanosin (8-oxodguo), en bio markör av oxidativt inducerad bas skador i DNA. Aldehyder och epoxyaldehyder till följd av lipidperoxidations processen är elektrofila molekyler som kan bilda mutagena exocykliska DNA-addukter, såsom etheno addukter 1,n2-etheno-2 ‘-deoxyguanosin (1,n2– εdGuo) och 1,n6-etheno-2 ‘-deoxyadenosin (1,n6-εdado), som har föreslagits som potentiella bio markörer i patofysiologin av inflammation. Selektiva och känsliga metoder för deras kvantifiering i DNA är nödvändiga för att utveckla förebyggande strategier för att bromsa cell mutations frekvenser och kronisk sjukdoms utveckling (t. ex. cancer, neurodegenerativa sjukdomar). Bland de känsliga metoder som finns tillgängliga för deras upptäckt (högpresterande vätskekromatografi kopplad till elektrokemiska eller tandem masspektrometri detektorer, komet analys, immunoassay, 32P-postmärkning), de mest selektiva är de som bygger på hög prestanda vätskekromatografi kopplad till tandem masspektrometri (HPLC-ESI-MS/MS). Selektivitet är en viktig fördel vid analys av komplexa biologiska prover och HPLC-ESI-MS/MS utvecklades som den gyllene standarden för kvantifiering av modifierade nukleosidor i biologiska matriser, såsom DNA, urin, plasma och saliv. Användningen av isotopiskt märkta interna standarder ger fördelen av korrigeringar för molekyl förluster under DNA hydrolys och analyten anriknings steg, samt för skillnader i analytjonisering mellan proverna. Det underlättar också identifieringen av den korrekta kromatografiska toppen när mer än en topp är närvarande.
Vi presenterar här validerade känsliga, exakta och exakta HPLC-ESI-MS/MS-metoder som framgångs rikt tillämpades för kvantifiering av 8-oxodGuo, 1,n6-Dado och 1,n2-dguo i lung-, lever-och njure DNA från A/J-möss för bedömningen av effekterna av den omgivande PM2,5 -exponeringen.
Introduction
Vissa reaktiva syreradikaler (ROS) kan oxidera kol dubbel bindningar av DNA-baser och vissa kol atomer i deoxyribose del, generera oxiderade baser och DNA strand raster1. Som en negativt laddad molekyl rik på kväve-och syre atomer är DNA också ett mål för elektrofila grupper som kovalent reagerar med de nukleofila platserna (kväve och syre), vilket ger produkter som kallas DNA-addukter2. Så, DNA addukter och oxiderade DNA baser är exempel på DNA-lesioner som är användbara bio markörer för toxicitet bedömning av ämnen som är elektrofila, generera reaktiva elektrophiles på bio Transformation, eller inducera oxidativ stress1, och 2. Även om de modifierade DNA-baser kan avlägsnas från DNA genom bas eller nukleotid excision reparation (BER eller NER), induktion av en obalans mellan generering och avlägsnande av DNA-lesioner till förmån för de förstnämnda leder till en nettoökning av deras nivåer i DNA övertid3 . Resultat är ökningen av DNA-mutations frekvenser, minskat gen uttryck och minskad protein aktivitet2,4,5,6,7, effekter som är nära relaterade till utveckling av sjukdomar. DNA-mutationer kan påverka olika cellulära funktioner, såsom cellsignalering, cell cykel, genom integritet, telomer stabilitet, epigenomet, kromatin struktur, RNA splitsning, protein homeostas, metabolism, apoptos, och cell differentiering8 ,9. Strategier för att bromsa cell mutations frekvenser och kronisk sjukdoms utveckling (t. ex. cancer, neurodegenerativa sjukdomar) passerar genom kunskapen om mutationskällorna, bland dem, DNA-lesioner och deras orsaker.
ROS genereras endogent i överskott, på grund av förorening exponering, ihållande inflammation, sjukdomspatofysiologi (t. ex., diabetes), etc., är viktiga orsaker till bio molekyl ära skador, inklusive DNA och lipid skador1. Som ett exempel, den mycket reaktiva hydroxylradikal (OH) bildas från H2O2 reduktion av över gång metall joner (Fe2 +, cu+) oxiderar DNA baser, DNA-socker delen och fleromättade fett syror vid diffusions-kontrollerad och räntor10. Bland de 80 redan karakteriserade oxiderade nukleobaser3, den mest studerade en är 8-oxo-7, 8-dihydroguanin (8-oxoGua) eller 8-oxo-7, 8-dihydro-2 ‘-deoxyguanosin (8-oxodGuo, figur 1), en lesion som kan inducera gt transversioner i däggdjurs celler10,11. Det bildas genom mono elektronisk oxidation av guanin, eller genom hydroxylgrupp radikal eller singlet syre attack av guanin i DNA1. Fleromättade fett syror är andra viktiga mål för mycket reaktiva oxidanter, såsom •Oh, som initierar processen för lipidperoxidation1,12. Det ger upphov till fett syra Hydro per oxider som kan sönderdelas till elektrofila aldehyder och epoxyaldehyder, såsom malondialdehyd, 4-hydroxi-2-nonenal, 2, 4-decadienal, 4,5-epoxi-(2E)-decenal, hexenal, acrolein, crotonaldehyd, som kunna bilda mutagena exocykliska DNA-addukter, såsom malondialdehyd-, Propano-, eller etheno addukter1,12,13. Etheno addukter 1,n2-etheno-2 ‘-deoxyguanosin (1,n2-εdguo, figur 1) och 1,n6-etheno-2 ‘-Deoxyadenosin (1,n6-εdado, figur 1 ) har föreslagits som potentiella bio markörer i patofysiologin av inflammation14,15.
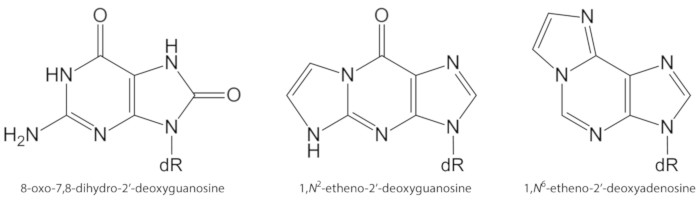
I figur 1. Kemiska strukturerna hos de DNA-lesioner som kvantifierats i den här studien. dR = 2 ́-deoxyribose. Denna siffra har ändrats från Oliveira et al.34. Vänligen klicka här för att se en större version av denna siffra.
Studier som genomfördes i början av 1980-talet tillät den känsliga upptäckten av 8-oxodGuo av högpresterande vätskekromatografi kopplad till elektrokemisk detektion (HPLC-ECD). Kvantifiering av 8-oxodguo av HPLC-ECD i flera biologiska system utsätts för oxiderande förhållanden ledde till erkännandet av 8-oxodguo som en bio markör av oxidativt inducerad bas skador i DNA1,16. Även om det är robust och gör det möjligt att kvantifiera 8-oxodGuo i det låga fmol-området17, förlitar sig HPLC-ECD-mätningar på noggrannheten hos analytretentions tiden för analytidentifiering och på kromatografiupplösningen för att undvika interferenser av andra prov bestånds delar. Eftersom den elektrokemiska upptäckten kräver användning av salt (t. ex. kalium fosfat, natriumacetat) i den mobila fasen, behöver underhållet av lämpliga analytiska tillstånd rutinmässig kolonn och utrustning rengörings tid.
Alternativt, användning av bakterien DNA reparation enzym formamidopyrimidine DNA glykosylase (FPG) och, efteråt, mänskliga 8-oxoguanin glykosylase 1 (hOGG1), för detektion och avlägsnande av 8-oxogua från DNA, framkom som ett sätt för induktion av DNA alkali labila Platser. De alkalilabila platserna konverteras till DNA-strandbryt och tillåter mycket hög känslig indirekt kvantifiering av 8-oxogua genom alkalisk Single cell gel elektrofores (“kometanalys”). Den höga känsligheten och utförandet av analyserna utan behov av cellulära DNA-extraktion är de främsta fördelarna med denna typ av analys. Det ger den lägsta Steady-State nivåer av 8-oxoGua i DNA, typiskt 7-10 gånger lägre än de nivåer som erhålls genom bio analytiska metoder baserade på HPLC. Det är dock en indirekt mätning av 8-oxogua och vissa nack delar är bristen på specificitet eller den okända effektiviteten i reparera enzymer som används1,16,18.
Immunoassay är andra uppsättning metoder som används för detektion av 8-oxoGua1 och EXOCYKLISKA DNA addukter, såsom 1,n6-Dado och 1,n2-dguo12. Trots känsligheten, en brist på användning av anti kroppar för detektion av DNA-lesioner är bristen på specificitet på grund av korsreaktivitet till andra komponenter i biologiska prover, inklusive de normala DNA-baser1,12. Den exocykliska DNA addukter, inklusive 1,n6-Dado och 1,n2-dguo, kan också upptäckas och kvantifieras av mycket känsliga 32P-postmärkning analyser12. Den höga känsligheten hos 32P-postmärkning gör det möjligt att använda mycket små mängder DNA (t. ex. 10 μg) för detektion av ca 1 ankring per 1010 normal baser19. Emellertid, bruket av Radios ände-kemikalieer, brist av kemisk specificitet och låg exakthet är några missgynnar19,20.
En delad begränsning av de metoder som nämns ovan är den låga selektivitet eller specificitet för detektion av de önskade molekylerna. I det här scenariot utvecklades HPLC kopplat till elektrospray jonisering tandem masspektrometri (HPLC-ESI-MS/MS och HPLC-MS3) som guld standard för kvantifiering av modifierade nukleosidor i biologiska matriser, såsom DNA, urin, plasma och saliv 1 den första , den 19 , 20. fördelar med HPLC-ESI-MS/MS-metoder är känsligheten (vanligt vis i det låga fmol-intervallet) och den höga specificitet som i) den kromatografiska separationen, II) det karakteristiska och kända mönstret av molekylfragmentering i massan spektrometer kollision kammare, och III) exakt mätning av den valda massan att ladda förhållandet (m/z) i flera reaktions övervakning läge1,19. Användningen av isotopiskt märkta interna standarder ger fördelen av korrigeringar för molekyl förluster under DNA hydrolys och analyten anriknings steg, samt för skillnader i analytjonisering mellan proverna. Det hjälper också i identifieringen av den korrekta kromatografiska toppen när mer än en topp är närvarande1,12,19,20.
Flera metoder baserade på HPLC-ESI-MS/MS har använts för kvantifiering av 8-oxodguo, 1,n6-Dado och 1,n2-dguo i DNA som extraherats från olika biologiska prover12,15,20 ,21,22,23,24,25,26,27,28,29 . Fina partiklar (PM2,5) bär organiska och oorganiska kemikalier, såsom polycykliska aromatiska kolväten (PAH), Nitro-PAH, aldehyder, ketoner, karboxylsyror, kinoliner, metaller och vattenlösliga joner, som kan framkalla inflammation och oxidativ stress, förhållanden som gynnar förekomsten av bio molekyl skador och sjukdomar30,31,32,33. Vi presenterar här validerade HPLC-ESI-MS/MS-metoder som framgångs rikt tillämpades för kvantifiering av 8-oxodGuo, 1,n6-Dado och 1,n2-dguo i lung-, lever-och njure DNA från A/J-möss för bedömning av effekter av ambient PM2,5 exponering34.
Protocol
Representative Results
Discussion
Ett stort problem som finns i 8-oxodguo analyser av HPLC metoder är en möjlig induktion av dess bildande under workup förfaranden för DNA-extraktion, DNA hydrolys, och koncentrationen av DNA-hydrolysater22,38. För att minimera problemet med 8-oxodGuo artifaktuella formation, rekommenderas tillsats av Deferoxamin till alla DNA-extraktion, lagring och hydrolys lösningar, användning av natriumjodid chaotropic metod och undvikande av fenol i DNA-extraktion, so…
Disclosures
The authors have nothing to disclose.
Acknowledgements
FAPESP (Fundação de Amparo à pesquisa do Estado de São Paulo, proc. 2012/22190-3 och 2012/08616-8), CNPq (proc. 454214/2014-6 och 429184/2016-6), CAPES, PRPUSP (Pró-Reitoria de pesquisa da Universidade de São Paulo), INCT INAIRA (MCT/CNPq/FNDCT/CAPES/ FAPEMIG/FAPERJ/FAPESP; Proc. 573813/2008-6), INCT Redoxoma (FAPESP/CNPq/CAPES; Proc. 573530/2008-4), NAP Redoxoma (PRPUSP; Proc. 2011.1.9352.1.8) och CEPID Redoxoma (FAPESP; Proc. 2013/07937-8). T. F. Oliveira och A. A. F. Oliveira erhöll stipendier från FAPESP (proc. 2012/21636-8, 2011/09891-0, 2012/08617-4) och CAPES (Coordenação de Aperfeiçoamento de pessoal de Nível Superior). M. H. G. Medeiros, P. di Mascio, P. H. N. Saldiva och A. P. M. Loureiro mottog stipendier från CNPq.
Några siffror och tabeller som finns i detta arbete publicerades ursprungligen i Oliveira A.A.F. et al. genotoxiska och epigenotoxiska effekter hos möss som exponerats för koncentrerade omgivande fina partiklar (PM2,5) från São Paulo City, Brasilien. Partikel-och Fibertoxikologi. 15, 40 (2018).
Materials
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
References
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2′-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2′-deoxyguanosine in human cells. Biochemistry. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2′-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2′-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure?. Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2′-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2′-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson’s disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, &. #. 1. 9. 3. ;., Escobar, J. 7,8-Hydroxy-2′-deoxyguanosine/2′-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. . Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40 (2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2′-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2′-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2′-deoxyguanosine and 1,N2-propano-2′-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).

