Fosfolipide mediator geïnduceerde transformatie in driedimensionale culturen
Summary
Het huidige protocol beschrijft het opzetten van 3D ‘bovenop’ culturen van een niet-getransformeerde borstepitheelcellijn, MCF10A, die is aangepast om door Bloedplaatjes Activerende Factor (PAF) geïnduceerde transformatie te bestuderen. Immunofluorescentie is gebruikt om de transformatie te beoordelen en wordt in detail besproken.
Abstract
Er zijn verschillende modellen ontwikkeld om kanker te bestuderen, zoals knaagdiermodellen en gevestigde cellijnen. Waardevolle inzichten in carcinogenese zijn verkregen door studies met behulp van deze modellen. Cellijnen hebben inzicht gegeven in de deregulering van moleculaire signalering geassocieerd met borsttumorigenese, terwijl knaagdiermodellen op grote schaal worden gebruikt om cellulaire en moleculaire kenmerken van borstkanker in vivo te bestuderen. De oprichting van 3D-culturen van borstepitheel- en kankercellen helpt bij het overbruggen van de kloof tussen in vivo en in vitro modellen door de in vivo omstandigheden in vitro na te bootsen. Dit model kan worden gebruikt om de deregulering van complexe moleculaire signaleringsgebeurtenissen en de cellulaire kenmerken tijdens de carcinogenese van de borst te begrijpen. Hier wordt een 3D-kweeksysteem aangepast om een door fosfolipide mediator geïnduceerde (Platelet Activating Factor, PAF) transformatie te bestuderen. Immunomodulatoren en andere uitgescheiden moleculen spelen een belangrijke rol bij tumorinitiatie en progressie in de borst. In de huidige studie worden 3D-acinaire culturen van borstepitheelcellen blootgesteld aan PAF vertoonde transformatiekenmerken zoals verlies van polariteit en veranderde cellulaire kenmerken. Dit 3D-kweeksysteem zal helpen bij het werpen van licht op genetische en / of epigenetische verstoringen geïnduceerd door verschillende kleine molecuulentiteiten in de micro-omgeving van de tumor. Bovendien zal dit systeem ook een platform bieden voor de identificatie van zowel nieuwe als bekende genen die betrokken kunnen zijn bij het transformatieproces.
Introduction
Een groot aantal modellen zijn beschikbaar om de progressie van kanker te bestuderen, elk van hen is uniek en vertegenwoordigt een subtype van deze complexe ziekte. Elk model biedt unieke en waardevolle inzichten in de biologie van kanker en heeft de middelen verbeterd om de werkelijke ziektetoestand na te bootsen. Gevestigde cellijnen die als monolaag zijn gegroeid, hebben waardevolle inzichten opgeleverd in vitale processen in vitro, zoals proliferatie, invasiviteit, migratie en apoptose1. Hoewel tweedimensionale (2D) celcultuur het traditionele hulpmiddel is geweest om de reactie van zoogdiercellen op verschillende omgevingsverstoringen te onderzoeken, lijkt extrapolatie van deze bevindingen om reacties op weefselniveau te voorspellen niet overtuigend genoeg. De belangrijkste beperking van de 2D-culturen is dat de gecreëerde micro-omgeving grotendeels verschilt van die van het borstweefsel zelf2. 2D-cultuur mist de interactie van de cellen met de extracellulaire matrix, die van vitaal belang is voor de groei van elk weefsel. Ook belemmeren trekkrachten die de cel in monolaagculturen ervaart de polariteit van deze cellen, waardoor de celsignalering en het gedrag veranderen 3,4,5. Driedimensionale (3D) kweeksystemen hebben een nieuwe weg geopend op het gebied van kankeronderzoek met hun vermogen om de in vivo omstandigheden in vitro na te bootsen. Veel cruciale micro-omgevingssignalen die verloren gaan in 2D-celcultuur kunnen worden hersteld met behulp van 3D-culturen van lamininerijke extracellulaire matrix (lrECM)6.
Verschillende studies hebben het belang van de tumor micro-omgeving in carcinogenese geïdentificeerd 7,8. Ontstekingsgerelateerde factoren zijn een belangrijk onderdeel van de micro-omgeving. Platelet Activating Factor (PAF) is een fosfolipidemediator die wordt uitgescheiden door verschillende immuuncellen en die meerdere immuunresponsen bemiddelt 9,10. Hoge niveaus van PAF worden uitgescheiden door verschillende borstkankercellijnen en worden geassocieerd met verhoogde proliferatie11. Studies van ons laboratorium hebben aangetoond dat de langdurige aanwezigheid van PAF in acinaire culturen leidt tot de transformatie van borstepitheelcellen12. PAF activeert de PAF-receptor (PAFR) en activeert de PI3K/Akt-signaleringsas13. PAFR wordt ook geassocieerd met EMT, invasie en metastase14.
Het huidige protocol demonstreert een modelsysteem om PAF-geïnduceerde transformatie te bestuderen, met behulp van 3D-culturen van borstepitheelcellen, zoals eerder is beschreven door Chakravarty et al.12. De borstepitheelcellen die op de extracellulaire matrix (3D-culturen) zijn gegroeid, hebben de neiging om gepolariseerde groei-arresteerde sferoïden te vormen. Deze worden acini genoemd en lijken sterk op de acini van borstweefsel, de kleinste functionele eenheid van de borstklier, in vivo15. Deze sferoïden (figuur 1A,B) bestaan uit een monolaag van dicht opeengepakte gepolariseerde epitheelcellen rond een hol lumen en bevestigd aan het keldermembraan (figuur 1C). Dit proces van morfogenese is goed beschreven in literatuur16. Wanneer ze op lrECM worden gezaaid, ondergaan de cellen deling en differentiatie om een cluster van cellen te vormen, die vervolgens vanaf dag 4 polariseren. Op dag 8 bestaan de acini uit een groep gepolariseerde cellen die in direct contact staan met de extracellulaire matrix en een cluster van niet-gepolariseerde cellen ingesloten in de buitenste gepolariseerde cellen, zonder contact met de matrix. Van deze niet-gepolariseerde cellen is bekend dat ze op dag 12 van de cultuur apoptose ondergaan en een hol lumen vormen. Op dag 16 worden groei-arresteerde structuren gevormd16.
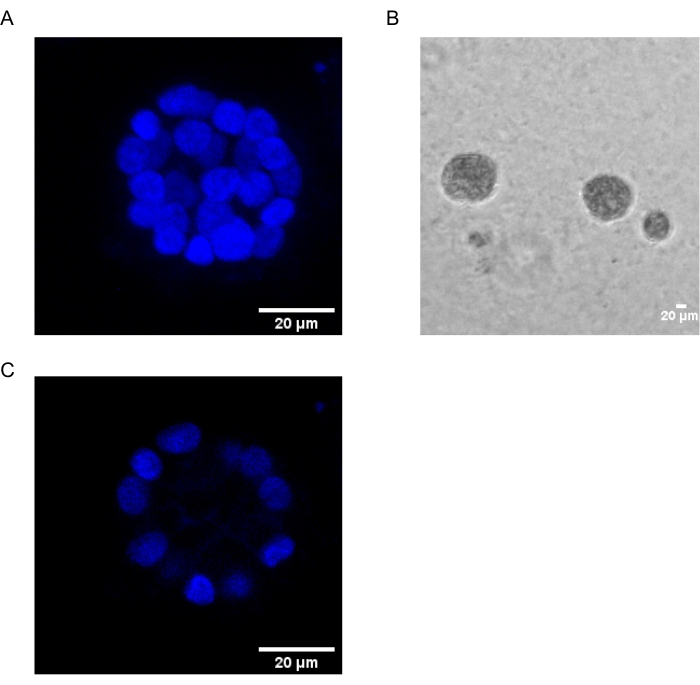
Figuur 1: Kernen van cellen in acini gekleurd met een kernvlek. (A) 3D-constructie van de acini. (B) Fasecontrastbeeld van MCF10A acini gekweekt op Matrigel gedurende 20 dagen. (C) Het middelste gedeelte toont de aanwezigheid van een hol lumen. Schaalbalk = 20 μm. Klik hier om een grotere versie van dit cijfer te bekijken.
In tegenstelling tot 2D-culturen helpen acinarculturen bij het onderscheiden van normale en getransformeerde cellen door middel van schijnbare morfologische veranderingen. Niet-getransformeerde borstepitheelcellen vormen acini met een hol lumen, dat de normale menselijke borst acini nabootst. Deze sferoïden vertonen bij transformatie een verstoorde morfologie die wordt gekenmerkt door een groot verlies van polariteit (een van de kenmerken van kanker), afwezigheid van een lumen of verstoring van het holle lumen (als gevolg van ontwijking van apoptose) die kan worden geïnduceerd als gevolg van deregulatie van verschillende genen 17,18,19,20 . Deze transformaties kunnen worden bestudeerd met behulp van veelgebruikte technieken zoals immunofluorescentie. Het 3D-celkweekmodel kan dus functioneren als een eenvoudige methode om het proces van borstacinaire morfogenese en carcinogenese van de borst te onderzoeken. Het opzetten van een 3D-kweeksysteem om het effect van een fosfolipidemediator, PAF, te begrijpen, zal helpen bij preklinische geneesmiddelenscreening met hoge doorvoer.
Dit werk heeft het 3D ‘on top’ cultuurprotocol16,21 aangepast voor het bestuderen van transformatie geïnduceerd door PAF22. De fenotypische veranderingen veroorzaakt door blootstelling van de acini aan de fosfolipide mediator werden bestudeerd met behulp van immunofluorescentie. Verschillende polariteit en epitheliale naar mesenchymale overgang (EMT) markers12,16 werden gebruikt in de studie. Tabel 1 vermeldt hun normale lokalisatie en hun verwachte fenotype bij transformatie.
| Antilichamen | Merken | Normale lokalisatie | Getransformeerd fenotype |
| α6-Integrin | Basolateraal | Basaal met zwakke laterale vlek | Sterke laterale / apicale vlek |
| β-Catenin | Cel-cel junctie | Basolateraal | Abnormale / nucleaire of cytoplasmatische lokalisatie |
| Vimentin | Emt | Afwezige / zwakke aanwezigheid | Up-regulering |
Tabel 1: Markers gebruikt in het onderzoek. Verschillende markers gebruikt met hun lokalisatie in de aan- en afwezigheid van PAF-behandeling.
Deze methode kan het best worden gebruikt om plausibele geneesmiddelen en doelgenen voor verschillende subtypen borstkanker te bestuderen / screenen. Dit kan een geneesmiddelresponsgegevens opleveren die dichter bij het in vivo scenario liggen, wat helpt bij een snellere en betrouwbaardere ontwikkeling van geneesmiddelen. Dit systeem kan ook worden gebruikt om de moleculaire signalering te bestuderen die verband houdt met medicijnrespons en medicijnresistentie.
Protocol
Representative Results
Discussion
Gevestigde op cellijn gebaseerde modellen worden veel gebruikt om het proces van carcinogenese te bestuderen. Monolaagculturen van cellen blijven inzicht geven in de verschillende moleculaire signaalroutes die karakteristieke veranderingen in kankercellen bemiddelen32. Studies naar de rol van bekende oncogenen zoals Ras, Myc en gemuteerde p53 werden voor het eerst gerapporteerd met behulp van monolaagculturen als het modelsysteem 33,34,35,36.</s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We bedanken de IISER Pune Microscopy Facility voor de toegang tot apparatuur en infrastructuur en ondersteuning voor de experimenten. Deze studie werd ondersteund door een subsidie van het Department of Biotechnology (DBT), Govt. of India (BT/PR8699/MED/30/1018/2013), Science and Engineering Research Board (SERB), Govt. of India (EMR/2016/001974) en deels door IISER, Pune Core funding. A. K. werd gefinancierd door CSIR-SRF fellowship, L.A. werd gefinancierd door DST-INSPIRE fellowship, V.C werd gefinancierd door DBT (BT/PR8699/MED/30/1018/2013).
Materials
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
References
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O’Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938 (2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287 (2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688 (2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12 (2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543 (2020).

